1. 서론
국민 소득수준의 향상과 식생활의 서구화로 만성 질환의 발병률이 높아지고 있다(Jang 등, 2012). 만성 염증에 의한 염증성 사이토카인의 분비는 세포 내 활성산소의 생성을 증가시켜 산화적 스트레스를 유발한다(Lee 등, 2022). 산화적 스트레스로 인한 활성산소는 세포의 구성성분인 지질, 핵산, 단백질 등에 과산화적 반응을 일으켜 세포막 손상, 핵산 및 지질의 손상으로 이어져 세포 내 정상적인 대사를 저해시킨다(Yoon 등, 2022). 산화적 스트레스와 염증은 다양한 만성 질환을 유발하는 기본적인 기전으로 알려져 있다(Jeon과 Kim, 2020). 염증 반응에 주요한 역할을 하는 대식세포에 lipopolysaccharide(LPS)로 자극하면 inducible nitric oxide synthase(iNOS)가 발현되고, nirtic oxide (NO)를 생성하면서 염증반응을 일으킨다(Lee와 Kang, 2020). 이러한 염증 인자들이 체내 과다 분비될 경우 만성적인 염증 상태가 되어 인슐린 저항성을 일으키기도 한다. 따라서 외부자극이 일어났을 때 염증 유도 물질들의 분비를 억제하고, 염증 반응을 조절할 수 있는 식품 유래 기능성 물질에 대한 연구가 활발히 진행되고 있다(Jang 등, 2021). 아울러 산화적 스트레스 억제를 위한 항산화 효능이 높고 부작용이 적은 천연 항산화제 개발의 필요성도 또한 커지고 있다(Kang과 Lee, 2022; Kim 등, 2019).
페놀 화합물은 식물계에 널리 분포되어 있는 2차 대사산물로 항산화 효능과 다양한 생리활성 기능을 가지고 있다(Lee 등, 2013). 또한, 그 종류와 함량에 따라 항산화 활성에 미치는 영향이 달라진다. 특히 폴리페놀은 산화 손상과 관련된 자유라디칼에 대한 소거제로 알려져 있고, 플라보노이드를 함유한 식물은 강력한 항산화 효능이 있는 것으로 보고되었다(Lim 등, 2021).
항산화 in vivo 평가를 위해 예쁜꼬마선충(Caenorhabditis elegans)을 활용하였다. 선충은 다세포 생물로 인간의 유전자와 70% 정도 유사하며, 관찰과 보존이 쉬우며, 평균 수명 20일(1세대 기간) 정도로 짧아 항산화 및 항노화 효과를 평가하기에 적합한 모델이다(Jeong 등, 2023). Lee 등(2016)의 연구에서 항노화 평가 모델로 선충을 이용하였고, Kim 등(2018)과 Kim 등(2019)의 연구에서는 juglone으로 유도된 산화적 스트레스에 대한 저항능력을 선충에서 확인하였다.
섬쑥부쟁이(Aster glehni Fr. Schmit)는 울릉도의 대표적인 산채 특산물로 국화과 개미취속 다년초이다. 울릉도에서는 부지깽이라고 부르며, 이른 봄 새순을 잘라 식용하면 향이 진하고 독특한 향기의 정유성분은 향신료로서 이용되며 칼슘과 철분을 다량 함유하고 있다(Kim과 Kim, 2004; Lee, 2006). 매년 3월 말에서 4월 초순에 1차 수확하여 생나물로 소비되고, 5월 말 이후 수확은 건조나물 형태로 소비되고 있다. 섬쑥부쟁이의 약리 성분은 염증, 천식, 해열, 이뇨 등이 알려져 있으며(Lee 등, 2019), 마우스를 활용한 고지방 식이에서 산화 스트레스 억제 효과와 대식세포(RAW 264.7 cells)에서 항산화 효과가 보고되었다(Kim 등, 2008; Kim 등, 2010; Kim 등, 2011). 기 보고된 생리활성을 바탕으로 기능성 원료로의 산업화와 제품 개발은 미비한 실정이다. 본 연구에서는 섬쑥부쟁이 추출물을 소비유형에 따른 생나물과 건조나물 형태로 나누고, 대식세포와 선충을 이용하여 항염증 및 항산화 효과를 평가하여 건강기능식품 개발 시 기초자료로 활용하고자 하였다.
2. 재료 및 방법
섬쑥부쟁이는 울릉군 노지에서 재배된 것을 경상북도 농업기술센터에서 제공받아 시료로 사용하였다. 3월에 수확한 생채용 섬쑥부쟁이(A. glehni, AG)와 4-5월에 수확하여 조직이 단단한 건조 가공형 섬쑥부쟁이(drying A. glehni for processing, DAG)를 이용하였다. 시료는 3회 세척 후 동결건조(PVTFD30R, Ilshin Lab Co., Ltd., Seoul, Korea)한 다음에 분쇄하여 −20°C에 보관하였다. 원물 자체의 기본 특성 분석을 위해 상압가열건조법에 의한 수분함량을 측정하였고, 동결건조 전후 중량 차이를 측정하여 수율을 계산하였다. AG와 DAG의 항산화 · 항염증 활성 분석을 위해 3가지 추출물로 제조하였다. 동결건조 및 분쇄된 시료에 20배(w/v)의 추출 용매(열수, 100% 에탄올, 70% 에탄올)를 넣고 160 rpm에서 교반(16시간) 후 냉장 침지(4시간)하였다. 분리된 상등액을 여과(Whatman International Ltd., Maidstone, England) 및 감압농축(R-100, DooYoung High Technology, Seoul, Korea)한 후, 동결건조한 시료를 dimethyl sulfoxide(DMSO, Sigma-Aldrich Co., St. Louis, MO, USA)에 녹여 −20°C에 보관하며 실험에 사용하였다. 사용한 추출 용매에 따라 교반 시간 및 온도를 달리하였고, 추출물의 동결건조 전후 중량 차이를 측정하여 수율을 계산하였다.
총폴리페놀 함량 측정을 위해 표준물질은 galic acid (Sigma-Aldrich Co.)를 80% 에탄올에 녹여 농도별로 제조 후 실험에 사용하였다. 시료 추출물 또는 표준물질과 2% Na2CO3(Sigma-Aldrich Co.)를 3분간 어두운 곳에서 반응한 후 50% Folin-Ciocalteu 시약을 넣고 다시 30분간 어두운 곳에서 반응하였다. 시료의 총폴리페놀 함량(mg gallic acid equivalentsGAE)/g of extract)을 산출하기 위한 표준물질 검량선을 작성하였고, Microplate reader (Infinite M200 Pro, TECAN, Mannedorf, Switzerland) 750 nm에서 흡광도를 측정하여 검량선 범위 내 신뢰구간을 활용하였다.
총플라보노이드 함량 측정을 위해 표준물질은 catechin hydrate(Sigma-Aldrich Co.)를 80% 에탄올에 녹여 농도별로 제조 후 실험에 사용하였다. 시료 추출물 또는 표준물질과 증류수, 5% NaNO2를 5분간 암소에서 반응한 후 10% AlCl3 · 6H2O를 넣고 암소에서 6분, 1M NaOH를 넣고 암소에서 11분 반응하였다. Microplate reader(Infinite M200 Pro, TECAN) 510 nm에서 흡광도를 측정하여 검량선 범위 내 신뢰구간을 활용하여 총플라보노이드 함량(mg catechin equivalents (CE)/g of extract)을 산출하였다.
짙은 자색의 DPPH 시약이 시료 내의 수산기와 반응하여 옅은 노란색의 Diphenylpicryl hydrazine으로 환원되는 원리를 이용해서 라디칼 소거활성을 측정하는 방법이다. 시료 추출물 또는 표준물질과 흡광도가 1.0으로 확인된 0.2 mM DPPH 용액(Sigma-Aldrich Co.)을 30분간 암소에서 반응한 후 Microplate reader (Infinite M200 Pro, TECAN) 520 nm에서 흡광도를 측정하였다. 시료는 에탄올에 녹여 사용하였고, 양성 대조군으로 L-ascorbic acid (Sigma-Aldrich Co.) 를 사용하였다. Blank와 시료 흡광도값을 이용해 DPPH 라디칼 소거 활성(%)을 산출하였다.
마우스 대식세포주인 RAW 264.7 세포는 미국세포주은행(American Type Culture Collection; ATCC, Manassas, WV, USA)에서 분양받아 10% fetal bovine serum(FBS; GenDEPOT, Katy, TX, USA)과 1% penicillin-streptomycin (P/S; Gibco, Waltham, MA, USA)을 함유한 Dulbecco’s modified Eagle’s medium(DMEM; Gibco, Waltham, MA, USA) 배지를 사용하여 37°C, 5% CO2 조건에서 배양하였다. RAW 264.7 세포에 대한 AG, DAG 추출물의 독성은 Ez-cytox(DoGen, Seoul, Korea)로 측정하였다. Ez-cytox 시약에 포함된 수용성의 tetrazolium salt(WST)가 살아있는 세포와 반응하여 오렌지색 수용성의 formazan을 생성하고, 이에 대한 흡광도 값을 측정하는 원리이다. lipopolysaccharide(LPS; Sigma-Aldrich Co.)를 처리하지 않은 RAW 264.7 세포와 LPS로 염증 자극을 유도한 RAW 264.7 세포로 나누어 생존율을 분석하였다. 세포를 1×104 cells/well의 농도로 96-well plate에 분주하여 4시간 배양한 후, 시료를 농도별(25, 50, 100 μg/mL)로 처리하여 24시간 반응하였고, LPS를 처리할 경우 시료 접종 1시간 후에 LPS를 1 μg/mL가 되도록 처리하여 24시간 배양하였다. 이후 Ez-cytox 시약을 분주하여 2시간 배양한 후 450 nm에서 흡광도를 측정하여 LPS 무처리 RAW 264.7 세포의 생존율을 기준(100%)으로 세포 생존율(%)을 산출하였다.
RAW 264.7 세포를 96-well plate에 5×105 cells/well의 농도로 4시간 배양하고 농도별(50, 75, 100 μg/mL) 시료처리 1시간 후에 LPS를 1 μg/mL를 첨가하여 세포의 염증을 유도하였다. 24시간 세포 배양한 배지의 상등액을 동량의 Griess reagent(Promega, Madison, WI, USA) 시약과 반응시켜 540 nm에서 흡광도를 측정한 후, 표준곡선에 대비하여 Nitric oxide(NO) 생성량(μM)을 산출하였다.
RAW 264.7 세포를 12-well plate에 5×105 cells/well의 농도로 4시간 배양한 후 시료(100 μg/mL)를 처리하고, 1시간 후 1 μg/mL의 LPS로 염증을 유도하기 위하여 24시간 배양하였다. Total RNA는 PURY RNA Plus kit (GenDEPOT)로 추출하여 1,000 ng/μL로 정량한 후 Reverse Transcription system(Promega)으로 역전사하여 cDNA를 합성했다. iNOS의 mRNA 발현량을 분석하기 위하여 AmfiSure qGreen Q-PCR Master Mix(GenDEPOT)를 사용하여 reverse transcription PCR을 수행하였다. 유전자의 상대적 발현량은 glyceraldehyde-3-phosphate dehydrogenase(GAPDH)를 기준으로 비교하였고, primer sequence는 Table 1과 같다.
예쁜꼬마선충은 wild-type인 N2 모델로 caenorhabditis genetics center(CGC, Minneapolis, MN, USA)에서 분양받아 실험에 사용하였다. 선충의 먹이원인 Escherichia coli(E. coli ) OP50(Korean Agricultural Culture Collection; KACC, Wanju, Korea)을 포함한 nematode growth media (NGM) 배지에 선충을 20°C에서 계대배양하였다. 동일한 성장단계의 선충을 수집하기 위해 선충의 알을 획득하고자 선충에 bleach(5.5% hypochlorite; Clorox Company, Oakland, CA, USA) 시약 및 5.0 M KOH(potassium hydroxide; JUNSEI, Seoul, Korea)를 처리하여 egg를 제외한 선충 몸체를 녹였고, 알을 10시간 배양 후 L1 단계 선충을 수집하여 OP50이 포함된 NGM 배지에 배양하였고, young adult 단계가 될 때까지 약 48시간 배양한 후 phosphate buffer saline(PBS; Gibco, Waltham, MA, USA)으로 세척 · 수집하여 insert membrane이 포함된 12-well plate에 배양하여 실험에 사용하였다.
선충을 배양한(100 worms/group) well plate에 OP50 (OD600=0.2-0.3), 5 mg/mL cholesterol(Sigma-Aldrich Co.), 120 μM fluorodeoxyuridine(FUdR; Sigma-Aldrich Co.), 시료 추출물(50, 100 μg/mL)을 동시에 첨가하고 산화적 스트레스 유도를 위해 50 μM juglone (H47003, Sigma-Aldrich Co.)을 처리한 후 2일 간격으로 배지를 교체하며 살아있는 선충의 개수를 확인하였다.
3. 결과 및 고찰
생채용 섬쑥부쟁이(A. glehni, AG)와 건조가공형(drying A. glehni for processing, DAG) 시료 원물의 동결건조 수율, 추출 용매별 수율은 Table 2와 같다. 상압가열건조법에 의해 측정한 수분함량(%)은 AG(85.87±0.11), DAG (84.06±0.09)로 두 시료의 값이 유사하였고 동결건조 수율도 비슷하나, 수분함량이 약간 낮은 DAG의 건조 수율(21.45%)이 AG의 건조 수율(18.20%)보다 높았다. 용매별 추출 수율은 AG는 열수 > 70% 에탄올 > 100% 에탄올 순이고, DAG는 70% 에탄올 > 열수 > 100% 에탄올 순이었다. 섬쑥부쟁이 시료의 추출에서 에탄올 용매는 100%보다 70% 농도에서 추출 수율이 높아지는 경향을 보였다.
| Sample | Moisture content (%)1) | Dry yield (%)2) | Extraction yield (%)3) | ||
|---|---|---|---|---|---|
| Hot water | 70% ethanol | 100% ethanol | |||
| AG | 85.87±0.11 | 18.20 | 41.06 | 23.29 | 18.31 |
| DAG | 84.06±0.09 | 21.45 | 36.61 | 38.27 | 33.58 |
추출조건을 달리한 AG와 DAG의 총폴리페놀과 총플라보노이드 함량은 Table 3과 같다. 총폴리페놀 함량(mg GAE/g)은 DAG 100% 에탄올군을 제외하고, 플라보노이드 함량(mg CE/g)은 DAG 70% 에탄올군을 제외하고 AG와 DAG 모두 에탄올 용매가 열수보다 높았다. 총플라보노이드 추출 함량도 열수보다 에탄올 추출물에서 대부분 높았고, 에탄올 농도 70%보다 100%에서 높은 플라보노이드 추출수율(AG100: 41.08±1.18, DAG100: 39.60±0.81)을 얻었다. 총폴리페놀의 함량은 AG 100% 에탄올 추출물(4.50±0.12)과 DAG 70% 에탄올 추출물(4.19±0.03)에서 가장 높았다.
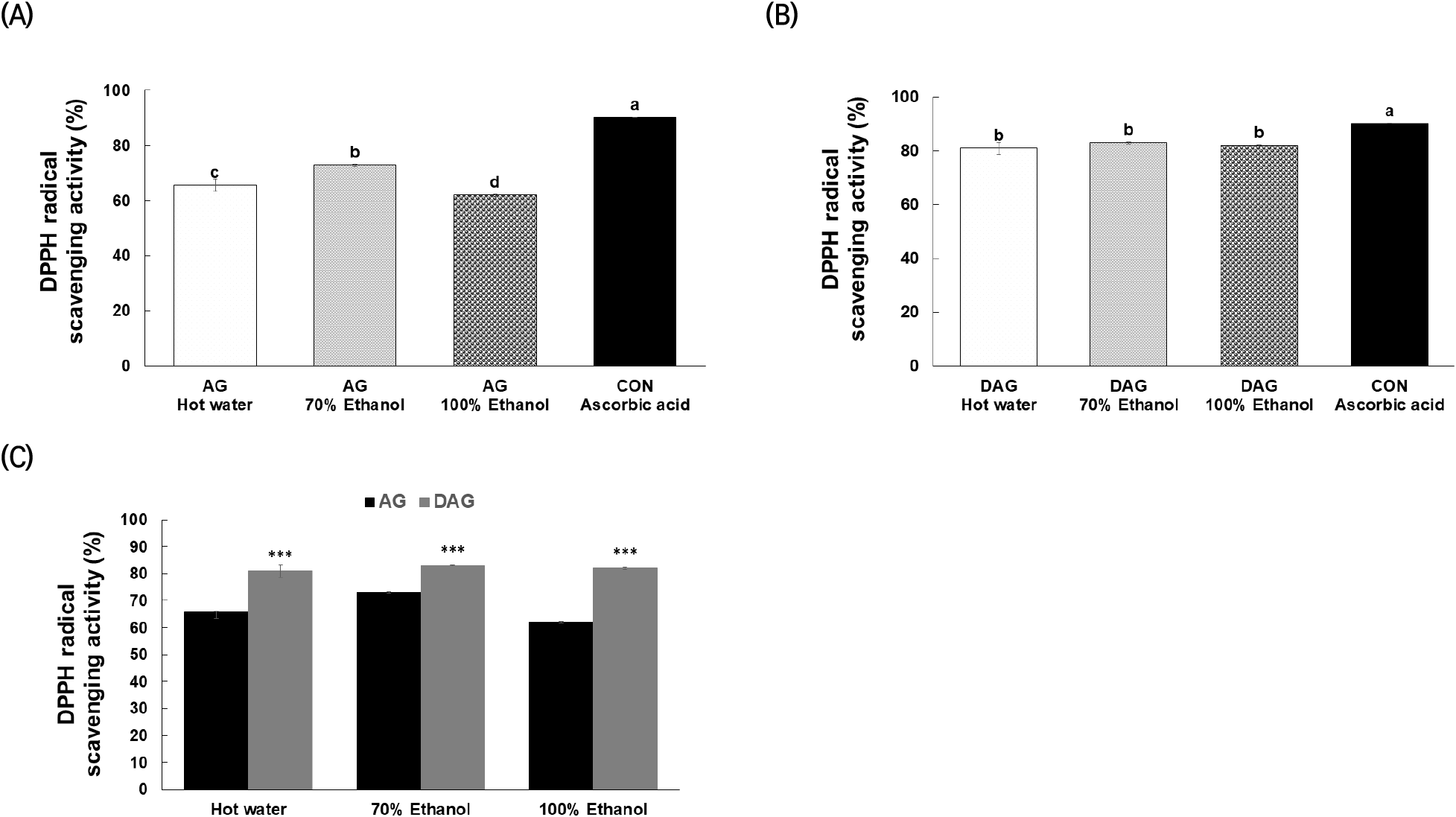
추출조건별 AG의 DPPH 라디칼 소거능은 70% 에탄올 추출물(72.87±0.28%)에서 가장 높았고(Fig. 1(A)), DAG는 용매추출 조건별로 의미있는 차이를 보이지 않았으나, 대조군인 Ascorbic acid(89.98±0.42%)와 유사한 수준(열수 82.61±1.18, 70% 에탄올 83.21±0.68, 100% 에탄올 83.09±1.74)을 보였다(Fig. 1(B)). 또한, AG와 DAG를 비교했을 때 모든 용매추출 조건에서 DAG가 유의적으로 높은 항산화 활성을 나타냈다(Fig. 1(C)). Gu 등(2017)의 연구 결과에서 해방풍의 DPPH 라디칼 소거활성이 에탄올 추출물에서 84.70%로 열수 추출물보다 높게 보고되어 본 연구 결과와 유사한 경향이었다. 항산화 성분의 추출 수율 및 라디컬소거 활성 결과를 종합하고 식품소재 활용을 고려하여 본 연구는 70% 에탄올을 최종 용매로 선정하고 대식세포와 선충에서 섬쑥부쟁이 에탄올 추출물의 항염증 및 항산화 효과를 평가하였다.
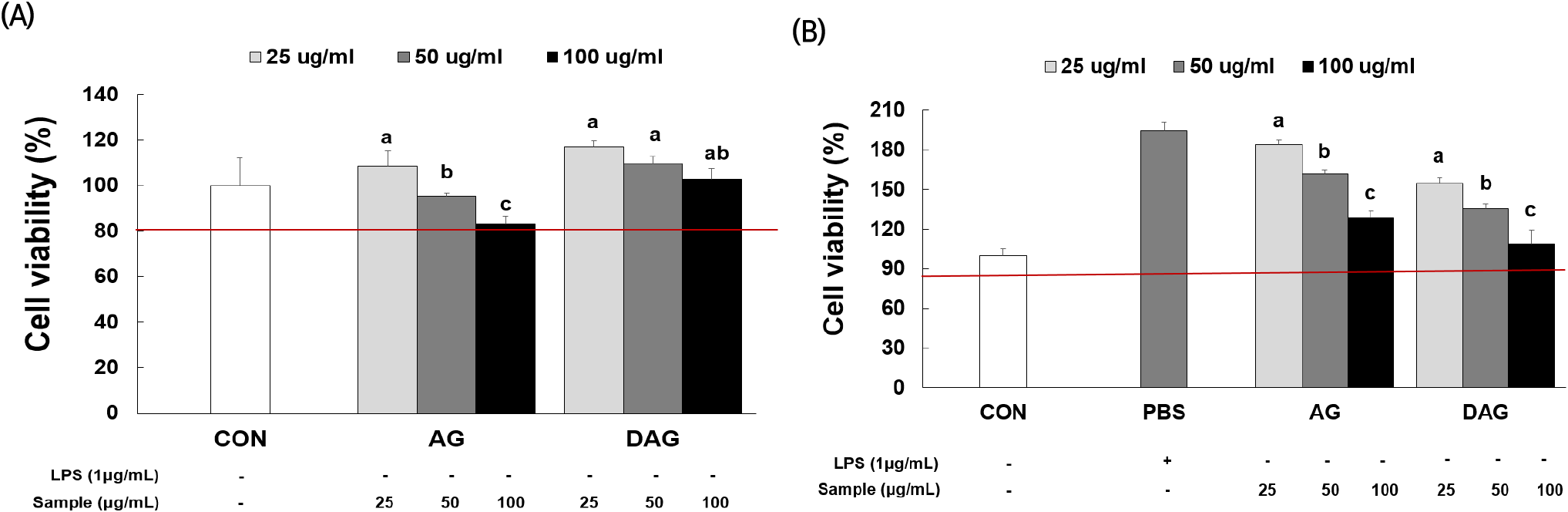
대식세포 RAW 264.7에서 울릉 섬쑥부쟁이 에탄올 추출물의 효과평가를 위한 최대 농도를 설정하고자 세포 생존율을 확인하였다. 섬쑥부쟁이 에탄올 추출물을 농도별(25, 50, 100 μg/mL)로 처리했을 때 대조군을 포함하여 모두 80% 이상의 생존율을 보였다(Fig. 2(A)). 그리고 LPS를 처리한 RAW 264.7 세포에서의 생존율(Fig. 2(B))도 대조군 포함하여 모든 농도에서 80% 이상의 생존율을 보였다. 따라서 이하 진행되는 실험에서 섬쑥부쟁이 에탄올 추출물 100 μg/mL를 최대 처리 농도로 설정하여 실험을 진행하였다.
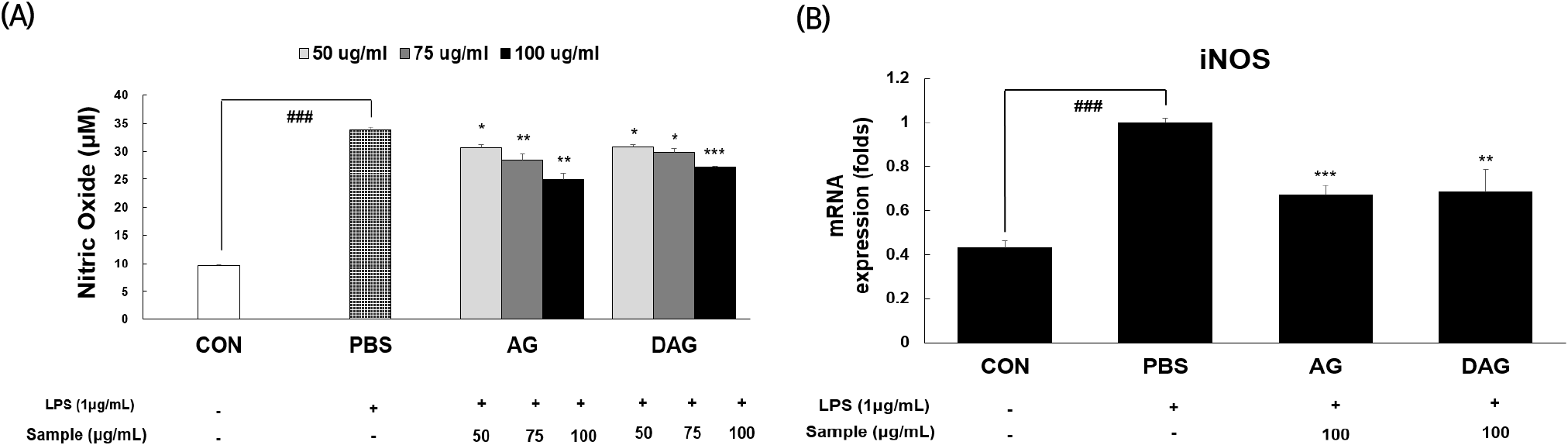
NO는 nitric oxide synthase(NOS)에 의해 L-citrulline으로 변환과정 중에 형성되는 활성 질소종 중의 하나로, 특히 iNOS에 의해 대식세포에서 분비되어 면역반응에 관여하는 대표적인 물질이다(Jang 등, 2021). RAW 264.7 대식세포는 LPS 자극에 민감하여 NO 생성이 잘 일어나므로 항염증 효과를 평가하는 데 널리 이용되고 있으며(Ryu 등, 2019), Choi와 Kim(2013)에 따르면 NO의 생성과 iNOS의 발현 및 활성을 억제할 수 있는 화합물은 항염증 물질로 이용될 수 있다고 보고하였다. 따라서 본 연구에서도 AG, DAG 추출물의 항염증 효과를 평가하기 위하여 LPS로 염증반응을 유도한 RAW 264.7 세포에 추출물을 농도별(50, 75, 100 μg/mL)로 처리하여 NO 생성 억제 활성을 살펴보았다(Fig. 3(A)). NO 생성량(μM)은 CON(음성대조군, 9.74±0.13)에 비해 PBS(LPS처리 양성대조군, 33.71± 0.65)에서 2.46배 증가하여 염증반응 모델이 잘 유도되었음을 확인하였다. 여기에 AG와 DAG 에탄올 추출물을 처리했을 때 모든 농도에서 PBS보다 유의적으로 NO 생성량이 감소하였고(p<0.05), 시료 100 μg/mL를 기준으로 AG (24.87±1.26)는 PBS 대비 26.23%, DAG(27.28±0.12)는 PBS 대비 19.08%로 NO 생성 억제 활성을 나타냈다. Fig. 3(B)는 NO 생성의 주요 유전자인 iNOS의 발현에 AG와 DAG 에탄올 추출물의 항염증 효과를 평가하기 위하여, LPS로 유도된 RAW 264.7에 두 시료의 에탄올 추출물 100 μg/mL를 각각 처리하였다. CON에 비해 PBS에서 iNOS 유전자 발현이 2.32배 증가하여 염증반응이 잘 유도되었음을 확인하였다. 또한, AG와 DAG 에탄올 추출물을 처리했을 때 PBS 대비 iNOS 유전자 발현이 AG는 33%, DAG는 32% 유의적으로 감소하여(p<0.01), NO 생성량 감소와 같은 양상을 보였다. NO 생성 및 iNOS 발현 억제 활성에서 AG와 DAG 에탄올 추출물의 활성은 유사하였다. 본 결과에서 AG, DAG의 에탄올 추출물은 iNOS의 유전자 발현을 억제하여 NO의 생성량 감소에 기여하였다고 사료된다.
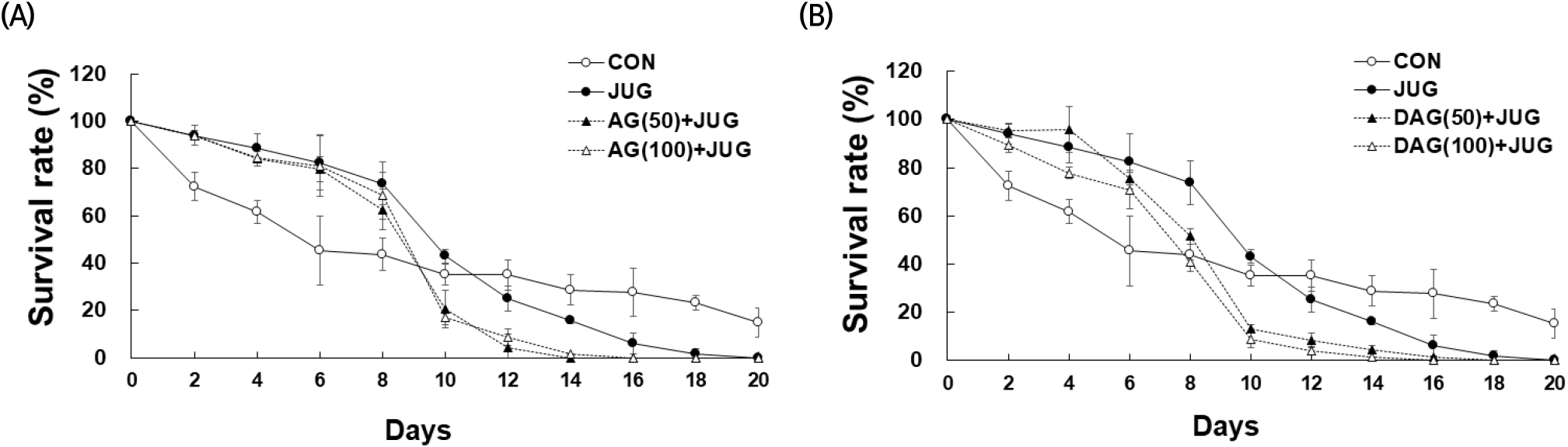
세포 손상에 의해 생성된 활성산소종은 산화 스트레스 및 노화 관련 질환과 체내 염증 생성과 관련됨이 보고된 바 있다(Farias 등, 2017). Kim 등(2017)은 juglone으로 유도한 선충의 산화적 스트레스 조건에서 음양곽 ethyl acetate 분획물의 생존율 개선 효과를 보고하였다. 본 연구에서는 선충에 산화 스트레스 유도 시약인 juglone(50 μM)과 AG 또는 DAG 에탄올 추출물을 농도별(50, 100 μg/mL) 처리하며 항산화 활성을 분석하였다. 선충의 생존율(%)은 2일 간격으로 총 20일 동안 측정하였다(Fig. 4). 분석 결과, AG+JUG 처리군은 8일 차까지 CON보다 선충의 생존율(%)이 증가하였고, 10일 차부터 생존율이 감소하였다. 12일 차(50 μg/mL, 4.29%)는 14일 차(100 μg/mL, 1.72%)까지 생존하였다(Fig. 4(A)). DAG+JUG 처리군도 8일 차까지 CON보다 선충의 생존율(%)이 증가하였으나, 10일 차부터 생존율이 감소하였다. 16일 차(50 μg/mL, 1.17%), 14일 차(100 μg/mL, 1.19%)까지 생존하였으나, 농도 의존적으로 생존율 연장의 결과를 보이지 않았다(Fig. 4(B)). CON보다 juglone 처리군(JUG)의 생존율이 감소하기 시작한 시점은 AG와 DAG군은 모두 12일 차였다. 산화적 스트레스를 유도한 선충에서 AG와 DAG 에탄올 추출물의 항산화 활성은 10일 차 중반기까지는 생존율이 CON보다 높았으나, 후반기의 생존율에는 영향을 미치지 못했다고 사료되며, AG와 DAG의 효과에는 차이가 없었다. 이는 JUG도 두 시료와 유사한 경향성을 보였다.
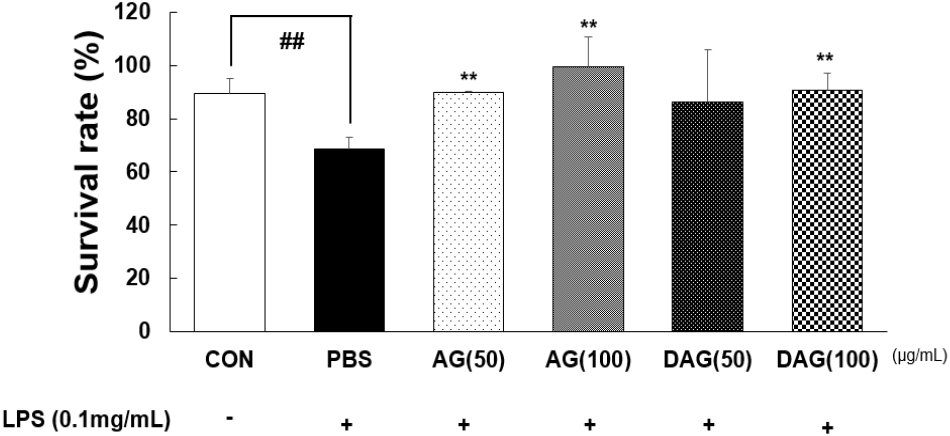
Ma 등(2020)은 LPS를 처리한 선충에서 carnosine은 선충의 생존율을 향상시켰다고 보고하였다. 의약 후보소재의 활성평가를 제외한 농산물의 항염증 평가를 위해 선충을 이용한 염증스트레스 모델 연구는 많이 보고되어 있지 않다. 본 연구에서는 선충에 LPS(0.1 mg/mL)로 염증 스트레스를 유도한 후 농도별 AG와 DAG 에탄올 추출물(50, 100 μg/mL)을 24시간 처리하여 LPS 반응 전(0 h)과 반응 후(24 h) 선충의 생존율(%)을 분석하였다(Fig. 5). 분석 결과, CON의 24시간 생존율은 89.29±5.95%, PBS(LPS 처리군)은 68.60±4.46%로, LPS 처리 시 CON보다 유의적으로 생존율이 감소하여(23.17%), 염증스트레스 모델이 잘 형성되었다고 확인할 수 있었다(p<0.01). 이를 이용하여 LPS와 함께 AG 또는 DAG 에탄올 추출물을 선충에 처리한 경우 LPS 단독 처리군보다 24시간 후 생존율이 증가하였다. AG 에탄올 추출물(50, 100 μg/mL) 처리 시 평균 94.60%(89.79±0.29%, 99.40±11.45%), DAG 에탄올 추출물(50, 100 μg/mL) 처리 시 평균 88.39%(86.11± 19.64%, 90.66±6.30%)의 생존율을 나타냈다. PBS와 비교했을 때 AG와 DAG 에틴올 추출물은 농도 의존적인 염증 개선효과를 보였다(p<0.01).
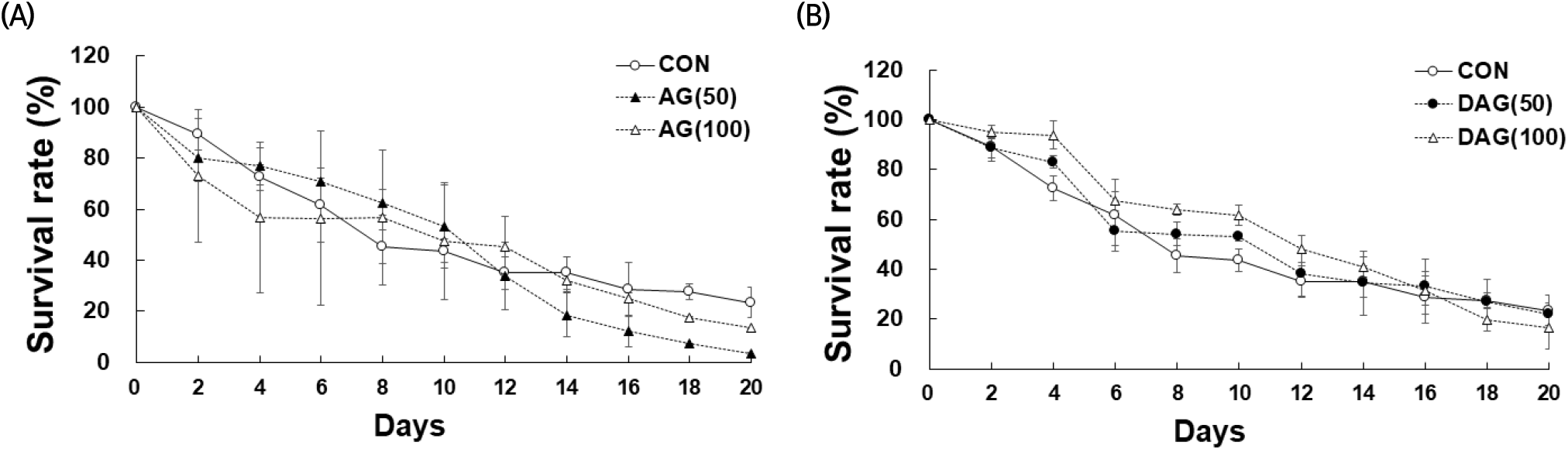
Lee 등(2013)에 따르면 도토리 분말 수용액의 항산화 성분이 선충의 산화성 스트레스 저항성을 증가시켜 수명을 연장시킨다고 보고하였고, Ji 등(2014)은 발효한 대추가 선충의 생명연장에 효과를 나타내었다고 보고하였다. 본 연구에서는 앞선 선충을 활용한 AG와 DAG 추출물의 산화적 스트레스 조건에서는 추출물 섭취 시 생존율이 개선되지 않았기에, 인위적인 스트레스 유도조건(JUG 처리) 없이 선충이 자연 노화됨에 따라 AG 또는 DAG 에탄올 추출물을 처리하고 생존율(%)의 변화를 살펴보았다(Fig. 6). 20일 동안 CON의 생존율과 비교했을 때 AG 에탄올 추출물을 처리한 경우에는 4-12일 차에 생존율이 증가하는 경향을 보였으나, 유의적 차이는 없었다(Fig. 6(A)). 반면에 DAG 에탄올 추출물은 처리한 경우 2-16일 차까지 CON보다 높은 생존율을 보였다(Fig. 6(B)). AG와 DAG 에탄올 추출물은 최대 16일 차까지 선충의 노화 스트레스에 긍정적 영향을 주었으나, 후반기부터 20일 차까지는 영향을 미치지 못하였다. 위 결과, AG보다는 DAG 에탄올 추출물에서 보다 노화방지의 효과를 확인할 수 있었다. Shin 등(2021)의 보고에서 유산균 유래 SRCM103472의 처리 시 16일 차까지 선충의 생존율을 높였다고 보고하여, 식품 유래의 선충 노화 스트레스 평가는 중반기까지 생존율에 긍정적인 효과를 보일 수 있다고 확인할 수 있었다. Juglone으로 유도된 산화 스트레스 조건에서는 8일 차 이후부터 CON보다 juglone과 추출물 복합 처리군의 생존율이 떨어졌으나, 자연 노화 조건에서는 AG 에탄올 추출물는 14일 이후, DAG 에탄올 추출물는 20일에 CON보다 생존율이 낮았다. 자연노화 조건에서 AG와 DAG 에탄올 추출물을 처리한 선충의 수명 및 생존율에 대한 중앙값과 최대값을 확인하였다(Table 4). 수명 중앙값은 모두 10일이었고, CON(43.72%)보다 AG와 DAG 에탄올 추출물을 처리했을 때 생존율 중앙값이 47.31%(AG 100), 53.25%(AG 50), 61.78%(DAG 100), 52.91%(DAG 50)로 높았다. 통계적 유의성은 중앙값에서 DAG 에탄올 추출물과 CON 간에만 확인되었다(p<0.05). 이 결과는 울릉 섬쑥부쟁이의 항산화 성분이 스트레스 저항성을 증가시켜 선충의 초기부터 중기까지의 수명연장에 도움을 줄 수 있다고 사료되었다. 수명 최대값은 모두 20일 차까지 생존하였으나 CON보다 AG와 DAG 에탄올 추출물 처리시 낮은 생존율을 보여 선충의 말기 수명연장에는 도움을 주지 못했다. 또한 생채용(AG)보다 건조 가공용(DAG)에서 선충의 생존율이 CON보다 높았으며, 20일 차의 생존율에서도 건조 가공용(DAG 50)이 21.85%로 CON(23.41%)과 유사한 결과 값을 보였다. 이 결과는 생체 내 염증반응이 높은 질병 상태보다 JUG 처리 염증 반응이 다소 낮은 건강한 상태에서 섬쑥부쟁이 섭취가 항노화 활성에 효과가 있을 것으로 사료되며, 조직이 강해져 생채소 형태의 섭취가 어려운 섬쑥부쟁이를 가공 처리하여 지속 섭취함으로써 유익한 생리활성을 얻을 수 있을 것으로 기대되는 결과이다.
4. 요약
본 연구는 울릉 섬쑥부쟁이의 생리활성을 평가하여 기능성 농식품 소재로서의 자료 제공을 목적으로 하였다. 대식세포와 선충을 활용하여 울릉 섬쑥부쟁이의 항산화 및 항염증 효과를 평가하였다. 총폴리페놀 함량과 총플라보노이드 함량은 AG와 DAG의 에탄올(70%, 100%) 용매가 열수보다 추출수율이 높았으며, 추출 조건별 항산화 활성 분석도 열수보다는 에탄올 추출물에서 가장 높았다. AG의 경우 100% 에탄올 추출물(4.50%)이, DAG의 경우 70% 에탄올 추출물(4.19%)로 수율이 가장 높았다. 항산화 성분의 추출 수율과 라디컬소거 활성 결과와 식품소재 활용을 고려하여 70% 에탄올을 최종 용매로 선정하였다. 시료의 효과평가를 위해 세포독성이 없는 100 μg/mL를 최대 농도로 설정하여 대식세포 RAW 264.7에서의 항염증 활성을 평가하였다. LPS로 염증을 유도하고 AG와 DAG 에탄올 추출물 처리군은 LPS 단독 처리군(양성 대조군)과 비교하여 NO의 생성과 iNOS의 발현이 유의적으로 감소하였다. 선충을 이용한 AG와 DAG 에탄올 추출물의 항산화 활성 분석 결과, juglone 처리로 인한 산화적 스트레스 조건하에서 선충의 생존율 연장에는 영향을 미치지 못했다. 선충에 LPS를 처리하여 염증 스트레스 조건하에서 AG와 DAG 에탄올 추출물이 LPS 단독 처리군에 비해 24시간 후 생존율이 증가하였고, 두 시료 모두 생존율 개선 효과가 농도 의존적으로 보였다. 염증과 산화의 스트레스 조건 없이 선충의 평균 수명 기간인 20일 동안 AG와 DAG 추출물을 처리하여 항노화 효과를 평가한 결과 AG와 DAG 에탄올 추출물을 처리한 선충의 생존율 중앙값(10일)은 CON보다 높았으며, DAG 에탄올 추출물은 농도 의존적으로 생존율을 높이는 경향을 보였으나, AG 에탄올 추출물은 그렇지 않았다. AG와 DAG의 20일 생존율은 CON보다 낮거나 유사(DAG 50)하였다. 본 연구의 결과, 울릉 섬쑥부쟁이 에탄올 추출물은 in vitro에서 항산화 활성을 보였고, 염증이 유도된 대식세포에서 iNOS 유전자 발현을 억제하여 NO의 생성량이 감소하였다고 사료된다. 또한, 염증 스트레스를 유도한 선충의 생존율 개선 효과를 보였다. 이 결과는 울릉 섬쑥부쟁이의 건강기능식품 개발 시 기초자료로 활용하고, 지역 농산물의 소비 활성화에 도움이 될 수 있을 것으로 기대된다.
