1. 서론
최근 많은 소비자들이 건강한 식습관 형성의 중요성을 인지하면서 발효식품의 수요와 관심이 K-Food와 한국 음식문화를 세계화로 이끌고 있다. 이런 음식문화를 주도하고 식탁을 풍요롭게 해주는 식재료 중 하나인 장류식품은 오랫동안 섭취되고 있는 우리 고유의 전통식품으로서 주로 콩을 발효시켜 만든다. 장류는 메주에 포함된 다양한 미생물이 콩의 단백질과 발효에 사용된 전분질을 아미노산, 당류, 유기산, 휘발성 물질 등의 향미성분과 같은 2차 대사산물로 전환시키는 것으로 알려져 있다(Kim 등, 2006). 또한, 이들 대사산물들 중에는 장류의 향과 맛을 증진하는 성분들뿐만 아니라, 여러 가지 생리활성물질도 포함되어 있어 면역력 강화(Lee 등, 2011), 혈당 조절(No 등, 2006), 항암(Kwon 등, 2004), 항산화(Oh와 Kim, 2007) 등의 기능성에 대하여 많은 연구가 보고되고 있다.
한편, 2011-2020년 사이 세계 평균 기온은 1850-1900년 기간에 비해 약 1.09°C 상승하 였으며, 폭염 일수도 꾸준히 증가하고 있어 기후변화가 심각해지고 있다(IPCC, 2023). 이러한 기후변화 이슈는 농업, 재배, 환경 등 영역에 큰 영향을 주고 있는데, 옥외환경에 장시간 노출되어 있는 우리나라 전통장의 품질에도 영향을 줘 수분 증발로 인한 생산량 감소와 이상발효 등의 어려움을 겪는 제조업체가 발생되고 있다.
막장은 메주를 빻아서 소금물과 섞어 담아낸 후 따뜻한 곳에서 발효시켜 짧은 발효기간을 거쳐 완성되므로 속성장으로 분류되고, 빠르게 담가 먹는 특징 때문에 막장이라 불리고 있다(Jang, 1999). 조선시대에는 막장이라는 표현이 문헌에 기록된 바 없지만, 당시의 급장(急醬)이나 급조장(急造醬)이 메주를 빻아서 소금물로 버무려 담가 보름 내외로 빠르게 익혀 먹는 제법으로 오늘날의 막장과 유사하다고 볼 수 있다(Kim과 Lee, 2004). 따라서 발효기간이 짧고 제조공정이 간단한 막장 제조법은 기온 상승에 따른 영향을 최소화하여 안전하게 장을 제조하는데 활용될 수 있을 것으로 사료된다.
전통장은 발효 ․ 숙성과정에서 여러 미생물들의 복합적인 작용으로 인해 집집마다 각양각색의 맛과 향을 나타내는데(Park, 1992), 초기에 어떤 미생물들이 착생하여 우점하는 지가 매우 중요하다(Lee 등, 2016). 따라서 제조 초기에 낮은 온도, 염수 등의 환경에 적응성이 있고, 단백질 분해력이 높은 단일 또는 복합종균을 사용하는 방법을 통해 우수 종균의 우점을 빠르게 유도하여 발효과정을 개선함으로 장류식품의 향미증진 및 생산 안정화 등의 이점을 높일 수 있을 것으로 판단된다.
된장 발효 과정에 관여하는 미생물들의 종류와 분포는 된장의 향과 맛을 형성하는 데 있어서 핵심적인 역할을 한다고 보고되었는데(Lee 등, 1996), Rye 등(2021)의 연구에 따르면, 된장에서는 Enterococcus, Tetragenococcus, Bacillus와 같은 세균과 Aspergillus, Debaryomyces, Candida, Mucor, Gibberella 등의 곰팡이들이 빈번하게 검출되며 우점하고 있다고 보고하였다. 특히 자연계에 널리 분포되어 있는 Bacillus sp.는 병원성 미생물을 억제하는 다양한 항균물질을 생산하는 것으로 알려져 있는데, 그중 B. velezensis는 고농도의 염분 환경에서도 안정적으로 생존하며, 높은 효소 활성으로 아미노산, 당류, 펩티드와 같은 풍미성분의 생성에 기여하는 것으로 보고되어 있다(Gil 등, 2022). 효모 중에는 Debaryomyces hansenii가 높은 염분과 낮은 pH의 장류식품에서의 성장 능력을 보유하고 있고(Prista 등, 2005), 젖산 및 시트르산 등 유기산 대사에도 중요한 역할을 한다(Ferreira과 Viljoen, 2003). Enterococcus sp.는 발효식품의 품질과 안전성을 향상시키는 enterocin을 생산하며 수수와 대두 등 원료가 함유된 발효식품 제조과정에서 중요한 역할을 하는 것으로 알려져 있다(De Kwaadsteniet 등, 2005; Kinouchi 등, 2012).
이에, 장류에서 유래한 우점 균주들을 된장의 발효 초기에 접종하여 주도적인 발효과정을 유도시킴으로써 미생물 군집이 조절된 환경을 유지하고, 잡균의 오염을 방지하여 일정한 된장의 품질과 맛을 유지할 수 있을 것이다. 따라서 본 연구에서는 발효종균을 이용하여 속성으로 섭취할 수 있는 막장을 제조하였고, 발효장소를 달리하여 품질 특성과 미생물 군집에 미치는 영향을 살펴보았다.
2. 재료 및 방법
본 실험에서 막장 제조를 위하여 사용한 균주들은 한식 된장 유래 Bacillusvelezensis NY12-2(KACC92193P), Debaryomyces hansenii D5-P5(KACC93386P), 그리고 Enterococcus faecium N78-11(KACC92330P)를 사용하였다. B. velezensis NY12-2와 E. faecium N78-11 균주들은 tryptic soy agar(TSA)와 lactobacilli MRS (Becton, Dickinson and Company, Sparks, MD, USA) 고체 평판배지에 각각 도말하여 37°C 배양기에서 24시간 배양하였고, D. hansenii D5-P5 균주는 yeast peptone dextrose(YPD, Becton, Dickinson and Company) 고체 평판배지에 30°C, 48시간 배양하여 사용하였다. 이후 이들 균주들은 동일한 제조사의 액체배지에 접종하여 각각의 최적온도 및 배양 조건에서 전배양하여 준비하였다. 각 균주들은 3,000 rpm에서 10분간 원심분리하여 상등액을 제거하고, 생리식염수로 3회 세척하여 pellet만 모아 막장 제조를 위한 starter로 사용하였다.
막장 제조를 위한 메줏가루는 강원도 평창 지역 내 장류업체로부터 구매하여 사용하였고, 그 외 부재료인 천일염(CJ CheilJedang Co., Seoul, Korea)은 전주 지역 내 로컬매장에서 구매하였다. 막장 제조를 위한 원료 배합비는 Table 1과 같다. 메줏가루:소금:물=40:12:48%의 비율로 하여 재료들을 혼합한 후 메줏가루를 넣고 메줏가루가 불도록 상온에서 약 1-2시간 방치하였다. 이후 각각 시험구별로 구분해둔 pellet을 흡광도 660 nm에서 OD 0.5로 맞춘 종균을 배합원료 대비 0.1%(w/v) 수준으로 첨가하여 균일하게 섞어주었다. 소독된 12L 항아리에 담아 3-5개월 동안 옥외(13.9°C, 63.7%)와 실내 발효실(35°C, 70.0%)에 90일 동안 두며 30일 간격으로 시료를 채취하여 품질분석을 실시하였다. 막장 시료들은 균을 접종하지 않은 대조구(control), B. velezensis NY12-2만 접종된 단일시험구(S1), D. hansenii D5-P5만 넣은 단일시험구(S2), E. faecium N78-11만 넣은 단일시험구(S3), 그리고 위에 언급된 3종 모두를 혼합하여 넣은 복합시험구를 M이라 명명하였다.
수분 함량은 105°C 상압건조법으로 AOAC법(AOAC, 1990)에 따라 분석하였으며, 막장 1 g을 건조기 (MOV-112, Sanyo Co., Ltd., Osaka, Japan)로 건조 후 백분율(%)로 환산하였다. 염도 측정은 AgNO3 적정법(Cho 등, 2014)을 일부 변형하여 측정하였다. 막장 5 g을 정확하게 칭량하여 증류수를 사용하여 20배 희석한 후, 진탕배양기(SI-IS20 model, Shin-il Co., Seoul, Korea)를 이용해 처리하고, 추출액은 여과지(Advantec No. 2, Tokyo, Japan)로 거른 후 지시약(5% K2CrO4)을 사용하여 0.1 N AgNO3로 적정을 수행하였다.
막장을 적당량 취해 증류수로 5배 희석한 시료액을 사용하여, homogenizer(polytron PT-MR 2100, Kinematica AG, Lucerne, Switzerland)로 균질화하였다. 8,000 rpm, 10분 동안 원심분리기(Supra 25k, Hanil Co., Ltd., Incheon, Korea)로 처리한 뒤, 여과지(Advantec No. 2)를 통해 걸러 분석시료액으로 사용하였다. 이후 pH meter (Corning 340, Corning Co., New York, NY, USA)를 사용하여 Choi 등(2016)의 방법에 따라 수행하였다. 산도를 측정하기 위해, 시료액 10 mL에 phenolphthalein 용액(1%, Daejung Chemicals & Metals Co., Ltd., Siheung, Korea)을 넣고, 0.1 N NaOH 용액을 첨가하여 pH가 8.3(미홍색)으로 될 때까지의 소비된 NaOH의 양을 측정하였다.
환원당 함량 측정을 위해, Kim과 Yi(2008)의 방법에 따라 dinitrosalicylic acid(DNS)법을 이용하여 분석하였다. DNS 시약 3 mL에 시료액 1 mL를 첨가하여 100°C 항온수조에서 5분 동안 처리 후 spectrometer(Libra S35, Biochrome Ltd., Cambridge, England)를 사용하여 흡광도를 측정하였다. 표준물질로 glucose(Sigma-Aldrich Co., Ltd., ST. Louis, MO, USA)를 사용하여 검량곡선을 작성하고 환원당의 백분율(%)을 계산하였다.
아미노산 질소(NO3-N) 측정은 AOAC법(AOAC, 1990)에 따라 수정된 Formol법을 사용하여 진행하였다. 증류수 10 mL에 시료 5 mL와 pH를 8.3으로 맞춘 formalin 10 mL를 첨가하고, 0.1 N NaOH로 적정하여 pH 8.4(미홍색)가 되게 중화시키고, 소모된 0.1 N NaOH의 양을 계산하여 아미노산 질소 함량을 산출하였다. 대조구 측정에는 중성 formalin 대신에 증류수를 사용하였다.
막장 시료를 취하여 건조시킨 다음, PITC(phenylisothiocyanate) 용액 20 μL(MeOH:TEA:PITC:H2O=7:1:1:1)에 30분간 유도체화하였다. 그런 다음, 용매 A(0.1% triethanolamine (TEA), 6% CH3CN, 140 mM sodium acetate(NaOAc), pH 6.1)에 용해시켜 원심분리하여 상등액을 얻고, 0.45 μm Syringe filter로 여과한 뒤 분석 시료로 사용하였다. 사용된 detector는 UV detector(HP Agilent 1100 HPLC, GMI, Ramsey, MN, USA)이고, 컬럼은 Waters Nova-Pak C18(4 μm, 3.9×300 mm)을 사용하여 254 nm 파장에서 검출하였고, 이동상은 용매 A와 용매 B(60% CH3CN)를 gradient 법으로 용매 이동속도 1.0 mL/min, 시료 주입량 10 μL, 컬럼 온도 46°C의 조건에서 측정하였다.
발효기간별 막장 시료에서 총균수, 유산균수, 그리고 곰팡이수의 변화를 살펴보기 위하여 시료 1 g을 0.85%(w/v) 멸균생리식염수 9 mL에 단계적으로 희석하여 각각의 plate count agar(Becton, Dickinson and Company), MRS agar(Becton, Dickinson and Company), PDA agar (Becton, Dickinson and Company)에 일정량 도말하였다. 총균수는 호기조건에서 37°C, 24시간 배양 후 PCA 배지, 유산균수는 혐기조건에서 48-72시간 배양 후 MRS 배지, 곰팡이수는 호기조건에서 48-72시간 배양 후 PDA 배지에서 각각의 집락을 측정하고 log CFU/g으로 환산하였다.
MiSeqTMplatform(Illumina, San Diego, CA, USA)를 사용한 차세대염기서열 분석법은 주식회사 마크로젠(Macrogen Inc., Seoul, Korea)에 의뢰하여 진행하였다. 막장으로부터 고품질의 genomic DNA(gDNA)를 분리하기 위해서 DNeasyPowerSoil kit(Qiagen, Hilden, Germany)을 이용하였다. 이후, 추출된 gDNA로부터 세균군집을 분석하기 위해 16S rRNA 유전자의 bacterial primer set (Herlemann 등, 2011)을 사용하였고, 진균군집은 ITS2 primer set (Schoch 등, 2012)를 사용하여 PCR을 수행하였다. 미생물 군집 구조를 파악하기 위하여 amplicon sequence variant(ASV)를 기반으로 분석하였고 또한, 샘플 내 군집 다양성 분석을 위하여 ASV 분석 결과를 바탕으로 Chao1 지수로 종 풍부도(richness)를, Shannon과 Simpson 지수로 종 다양성 및 균등성(diversity and evenness)을 측정하여 alpha-diversity를 분석하였다.
제조한 막장 시료들 간의 맛 변화를 알아보기 위하여 전자혀(electronic tongue system, Astree 5, Alpha MOS, Toulouse, France)를 사용하여 수행하였다. 막장 시료들에서 2 g씩을 취하여 증류수로 5배 희석한 다음, 8,000 rpm, 10분간 원심분리하고 여과지(Advantec No. 2)로 여과한 뒤, 전자혀 분석기에 시료를 80 mL을 넣고 5회 반복 측정하여 감칠맛(umami), 신맛(sourness), 짠맛(saltiness)의 지표를 측정하였다(Cha 등, 2006). 맛 성분의 패턴은 전자혀 시스템 AlphaSoft 17 version(Alpha MOS)을 사용하여 나타내었다.
본 실험은 3회 반복하여 분석하였고 평균±표준편차로 나타내었다. 실험값에 대한 통계적 분석은 SPSS (Statistical Package for the Social Science, Ver 12.0 SPSS INC., Chicago, IL, USA) 프로그램을 사용하였고, 분산분석(analysis of variance, ANOVA)을 적용하여 측정값들 사이의 유의성을 Duncan’s multiple range test로 평균값 간에 다중비교를 실시하였다. XLSTAT(Addinsoft, New York, NY, USA)을 이용하여 막장의 품질 특성, 아미노산 및 미생물 군집 분석의 평균값 간 상관성을 파악하기 위해 다중 요인 분석(multiple factor analysis, MFA)을 실시하였다.
3. 결과
본 연구에서는 막장 제조 시 발효장소와 종균 접종을 달리하여 90일간 발효한 후 품질과 미생물 변화에 미치는 영향을 살펴보고자 하였다. 먼저 수분함량과 염도의 변화를 측정하여 Table 2에 그 결과를 나타내었다. 옥외와 발효실에서 90일간 발효시킨 막장의 수분함량은 44.77±0.16-46.00±0.40%와 37.39±0.60-40.01±0.26%로 발효초기(51.40±0.16-52.23±0.29%) 대비 발효 전후에 유의적으로 감소되었다(p<0.05). Jeon 등(2015)에 따르면, 시판 막장의 수분함량은 평균 53.67±0.09%였다고 보고한 연구결과보다 다소 낮았지만, 이와 같은 변화는 원료의 수분함량, 숙성기간 동안의 상대습도 변화, 숙성 과정에서의 고형분 분해 정도에 영향을 받아 차이를 보인 것으로 사료된다(Jung 등, 1994). 막장의 염도는 제조 직후 12.16±0.06-12.67±0.13%이었으며, 옥외와 발효실에서 각각 14.04± 0.07-15.47±0.18%와 16.08±0.21-17.13±0.43%로 증가하는 경향을 보였지만 통계적인 유의성은 없었다(p<0.05). 이는 Choi 등(2016)이 12개월 동안 배양기(30도)에서 발효한 된장에서 수분 함량이 낮아짐에 따라 염도가 유의하게 증가하는 경향을 보고한 연구 결과와 유사하였다.
Control, no starter during the manufacture of makjang ; S1, manufactured using only B. velezensis NY12-2; S2, manufactured using only D. hansenii D5-P5; S3, manufactured using only E. faecium N78-11; M, manufactured using all of S1, S2, and S3 strains.
종균 처리에 따른 수분과 염도의 변화는 발효장소에서 언급된 경향성과 유사하게 나타났으며, 이는 발효기간이 경 과함에 따라 더 큰 차이를 보였다.
발효장소와 종균을 달리하여 제조한 막장 시료들의 pH와 총산의 변화를 측정하여 Table 2에 나타내었다. 막장의 제조 직후 pH는 5.84±0.01-5.86±0.00이었으며, 옥외와 발효실 환경에서 각각 5.46±0.01-5.59±0.01과 5.27± 0.01-5.38±0.01로 유의적인 수준(p<0.05)으로 감소하였다.
총산의 경우, 제조 직후의 막장은 0.65±0.01-0.88± 0.01%의 범위를 나타냈으나, 발효 90일 차에 옥외에서 1.67±0.06-1.77±0.01%, 발효실에서는 2.07±0.03-2.37± 0.06%로 유의적으로 증가하였다(p<0.05). 이러한 발효 중의 pH 감소와 산도의 증가는 발효과정에서 내염성 유산균이 생성한 유기산 때문에 발생한 것으로 판단된다(An 등, 1987; Kim 등, 2011). 또한 이와 같은 변화는 된장의 발효온도에 큰 영향을 받는데, Kim 등(2008)은 저온에서 발효할 때 pH의 감소가 상온에서 발효할 때보다 더 느리게 진행된다고 보고하여 발효실에서 제조한 막장이 야외에서 발효시킨 막장보다 더 낮은 pH를 보여 본 연구결과와 유사하였다.
한편, 종균 처리에 따른 막장의 pH 변화는 발효장소와 기간에 따라 유의미한 차이를 보였다. 총산의 경우에는 사용 종균의 종류와 무관하게 옥외에서 발효된 90일 차 대부분의 시료들은 1.67±0.06-1.77±0.01%의 범위로 대조구(1.73±0.03%)와 유사한 값을 보였다. 그에 반해, 발효실에서 숙성한 시료인 S1과 S3은 각각 2.25±0.10%와 2.37±0 .06%로 높은 값을 나타냈으나, 그 외의 다른 시료들은 2.07±0.03-2.20±0.04%의 범위로 유의적으로 낮은 값을 보였다(p<0.05).
각각의 막장 시료들에서 콩 전분을 이용하여 생성한 환원당 함량을 측정하여 Table 2에 제시하였다. 막장 제조 직후에는 미생물에 의해 생성된 당화효소(amylase)의 작용이 미약하여 환원당의 생성이 5.33±0.02-5.72±0.15%로 다소 낮았으나, 발효 30일 차에 당화효소의 활성이 비교적 높게 나타나 당 함량이 옥외와 발효실에서 각각 14.56± 0.24-16.39±0.30%와 13.03±0.14-16.25±0.73%로 최댓값을 나타내었다. 그 후 막장에 생육하는 미생물의 영양원, Maillard 반응, 알코올과 유기산 발효의 기질로 당이 이용되었기 때문에 발효 90일 차에는 환원당 함량이 옥외와 발효실에서 각각 7.28±0.14-8.43±0.05%와 6.02±0.00-7.39±0.11%로 점차 유의적으로 감소하였다(p<0.05). 이는 발효 중반기에 환원당이 증가하였다가 그 후 감소되었다는 Byun 등(2014) 및 Choi 등(2016)의 연구결과와 유사하였다.
한편, 종균 처리에 따른 변화는 발효 90일 차 옥외와 발효실에서 대조구의 환원당 값이 각각 8.43±0.05%와 7.39± 0.11%로 측정되었다. 이와 비교하여, 단일시험구(S3)와 복합시험구(M)는 옥외에서 각각 7.28±0.14%와 8.22±0.07%로, 발효실에서는 각각 6.33±0.14%와 6.02±0.00%로 유의적인 수준으로 차이를 나타내었다(p<0.05).
본 연구결과에서 단일시험구(S3)와 복합시험구(M)는 옥외와 발효실에서 90일 차에 유의적으로 낮은 환원당 함량을 보였다(p<0.05). 이는 공통적으로 접종된 E. faecium N78-11이 당을 분해하는 데 중요한 역할을 한 것으로 보여지며, 이로 인해 당 소비가 빨라져 환원당 함량이 감소한 것으로 사료된다.
막장 제조 시 발효장소와 종균 처리에 따라 숙성도에 미치는 영향을 살펴보기 위하여 아미노산 질소(NH2-nitrogen) 함량을 측정하여 Table 2에 나타내었다. 아미노산 질소는 대두 발효식품의 맛과 향미에 깊은 연관이 있으며 숙성 정도와 품질 수준을 알 수 있는 장류식품의 품질지표로, 미생물의 protease의 작용에 의하여 단백질이 아미노산의 형태로 분해되는 정도를 나타낸다(Lee 등, 1992; Lee 등, 2014). 이에 전통식품 표준규격(Ministry of Agriculture & MForestry, 2007)에 그 기준을 300 mg% 이상으로 규정하고 있다.
먼저, 발효장소에 따른 아미노산 질소 함량은 막장 제조 직후 122.75±0.99-155.01±2.98 mg%이었으며, 발효실에서 발효시킨 막장은 발효 30일 차에 대조구(469.94± 0.00 mg%)를 제외하고 대부분의 시험구들은 500 mg% 이상의 함량을 나타낸 반면, 옥외에서 발효시킨 막장은 331.76±2.98-364.03±0.99 mg%로 발효실보다 현저히 낮은 수준을 보였다(p<0.05). 모든 시료가 발효기간이 경과함에 따라 아미노산 질소 함량도 함께 증가하는 경향을 나타냈고, 발효 90일 차 이르러서는 옥외와 발효실에서 각각 472.74±15.87-484.67±0.99 mg%와 579.36±23.81-668.43±0.99 mg%를 나타내었다.
한편, 종균 처리에 따른 변화는 90일 이후 발효실에서 발효한 막장들 중 단일시험구(S3)와 복합시험구(M)의 아미노산 질소 함량은 625.65±11.90 mg%와 668.43±0.99 mg%로 E. faecium N78-11를 처리한 시험구에서 유의적으로 가장 높은 함량을 나타내었다(p<0.05). 그에 반해, 대조구와 단일시험구(S1, S2)는 600 mg% 미만의 함량을, 옥외에서 발효된 막장은 500 mg% 미만의 함량을 보였다. Park 등(1994)에 따르면 된장에서 아미노산 질소 함량을 높이는 데 단백질과 전분질을 효과적으로 분해하는 접종균주와 발효온도가 주요 요인으로서, 적절한 균주 선택과 생육 조건의 최적화를 통한 빠른 발효로 아미노산 질소의 증가를 기대할 수 있다고 보고하여 본 실험에서 사용한 균주들과 항온조건의 발효실이 단백질 분해에 긍정적인 영향을 미친 것으로 사료된다.
발효과정에서 특유의 풍미와 품질에 영향을 주는 미생물 수의 변화를 살펴보고 그 결과를 Table 3에 제시하였다. 먼저 제조 직후 모든 시료들은 8.87±0.04-9.21±0.08 log CFU/g 범위의 총균수를 보였으며, 90일 간 옥외와 발효실에서 발효된 막장은 각각 9.62±0.21-10.51±0.03 log CFU/g와 9.09±0.01-9.83±0.01 log CFU/g으로 옥외의 경우가 조금 높았다. 이는 된장의 염도가 낮을수록 총균수가 높아진다는 Mok 등(2005)의 보고와 유사하게, 본 실험에서도 옥외의 염도가 상대적으로 낮았기에 유사한 경향을 나타내었다. 유산균 수의 경우 발효기간이 증가함에 따라 감소되었다고 보고한 Lee 등(2015)과 Jeong 등(2018)의 결과와 유사한 경향으로, 본 실험에서는 막장 제조 직후 7.65±0.02-7.96±0.03 log CFU/g으로 검출되었고, 발효 90일 후에는 옥외에서 5.97±0.21-7.05±0.02 log CFU/g으로, 발효실의 5.82±0.00-6.26±0.06 log CFU/g의 범위로 유산균 수가 유의수준으로 점차 감소하였는데(p<0.05), 특히 옥외에서의 유산균수가 상대적으로 높은 값을 나타내었다. 곰팡이 수는 발효 90일 후 옥외와 발효실에서 4.91±0.12-5.33±0.05 log CFU/g과 5.15±0.21-5.45±0.04 log CFU/g을 나타내어 발효장소와 무관하게 비슷하였는데, 이는 Mok 등(2005)의 연구에서 된장을 배양기(20°C)에서 10-12주 발효시켰을 때와 비슷한 104-106CFU/g의 수준으로 검출되었다.
Control, no starter during the manufacture of makjang ; S1, manufactured using only B. velezensis NY12-2; S2, manufactured using only D. hansenii D5-P5; S3, manufactured using only E. faecium N78-11; M, manufactured using all of S1, S2, and S3 strains.
한편, 발효 90일 차 복합종균 처리 시험구(M)의 총균수는 옥외에서 10.41±0.09 log CFU/g과 발효실에서는 9.83±0.01 log CFU/g으로 단일시험구(S1, S2, S3)에 비해 통계적으로 유의하게 높은 값을 나타내었다(p<0.05). 이는 첨가된 복합종균 간의 상호작용이 발효장소(옥외와 발효실)의 환경적 차이에도 불구하고, 미생물의 생장과 활동을 촉진시킨 것으로 판단할 수 있다. 유산균 수의 변화를 살펴본 결과, E. faecium N78-11 균주가 첨가된 단일시험구(S3)와 복합시험구(M)는 대조구(5.97±0.21 log CFU/g) 대비 발효 90일 후 옥외에서 각각 7.05±0.02 log CFU/g과 6.35±0.18 log CFU/g을, 발효실에서는 대조구(6.17± 0.07 log CFU/g) 대비 각각 6.26±0.06 log CFU/g와 6.23±0.34 log CFU/g을 나타내며, 상대적으로 높게 측정되었다. 이러한 유산균의 생육은 Byun(2014)의 연구에서 언급된 바와 같이, 유산균이 생산하는 유산과 nisin이 잡균의 오염 및 성장을 억제하여, 최종 제품의 품질과 안정성 유지에 도움을 줄 것으로 사료된다.
장류식품이 맛과 영양학적 측면에서 우수하다고 평가받는 요소 중 하나는 발효 중 미생물 효소작용에 의해 생성된 유리아미노산과 관련이 있다(Jeon 등, 2015). 본 연구에서는 막장 제조 시 발효환경과 종균에 의한 발효기간별 유리 아미노산 함량의 상대적 풍부도를 heatmap으로 나타내었다(Fig. 1). 제조 직후 막장의 총아미노산 함량이 1,166.89-1,527.12 mg/g 범위였으며, 90일간 발효실에서 발효된 막장은 3,661.71-4,644.04 mg/g으로, 옥외에서 발효된 막장(3,150.73-3,615.08 mg/g)에 비해 높은 값을 나타내었다. 막장 발효 후 glutamic acid, lysine, leucine, serine 등의 유리아미노산이 순차적으로 높은 함량을 보였으며, glutamic acid의 함량은 592.20±8.90-867.42±77.27 mg/g의 가장 많은 양으로 검출되었고, 이는 전통된장에서 감칠맛을 주는 glutamic acid가 aspartic acid보다 더 많이 존재한다는 연구(Jung과 Roh, 2004)와 시판막장의 유리아미노산의 구성에서 glutamic acid가 가장 많았다(Jeon 등, 2015)는 결과와 일치하였다. 특히, 본 연구에서는 glutamic acid와 aspartic acid 함량이 발효실에서 각각 654.56±79.98-867.42±77.27 mg/g과 107.14±28.28-243.20±15.79 mg/g을, 옥외에서 각각 592.20±8.90-683.57±16.99 mg/g과 46.94±7.76-124.18±36.04 mg/g으로 상대적으로 발효실 조건에서 높은 함량으로 검출되었는데, 이러한 성분학적 차이는 Yang 등(1992)의 보고에서처럼 맛과 기호도를 결정하는 데 영향을 줄 것으로 여겨진다.
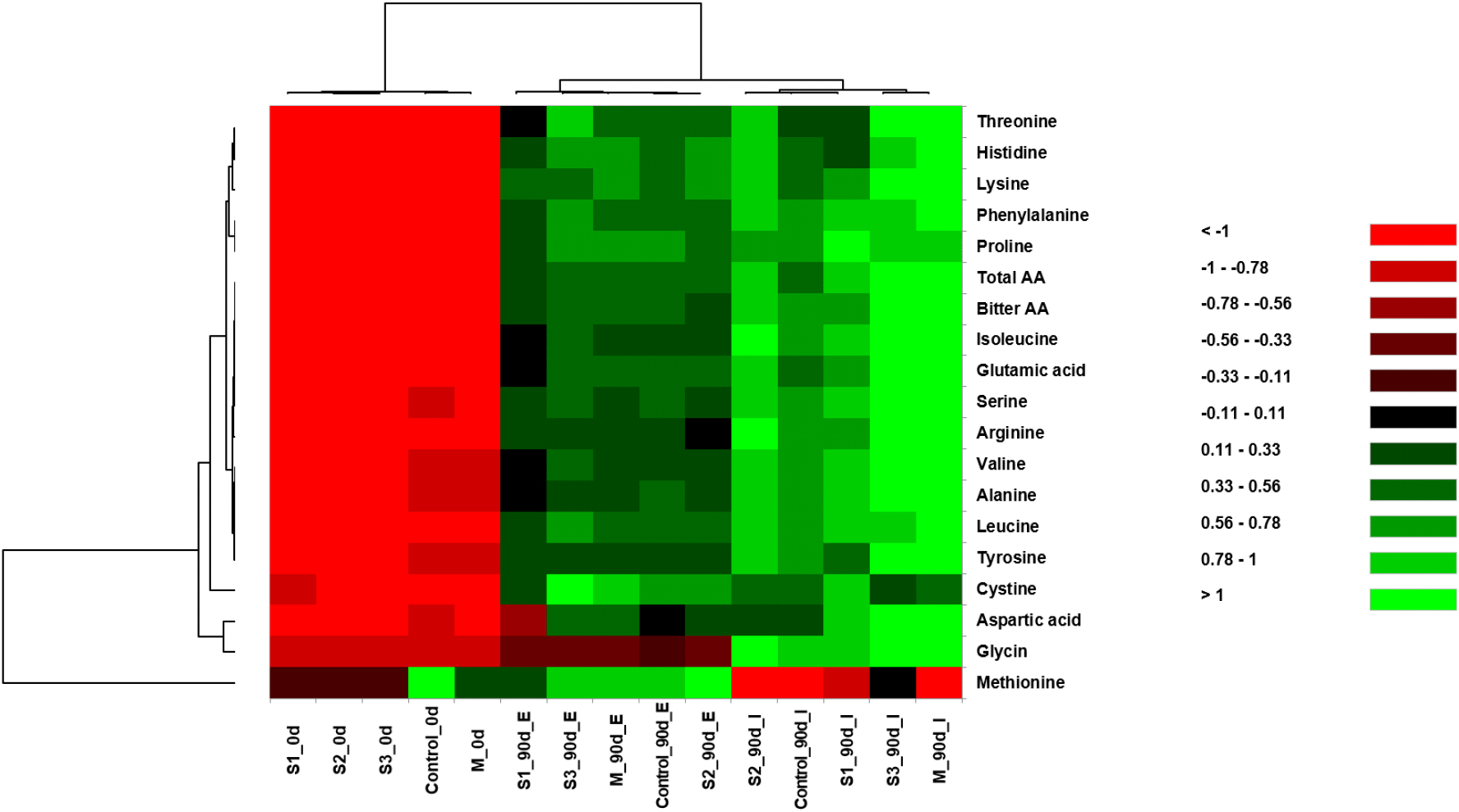
한편, 종균 처리 후 옥외에서 제조한 막장은 발효 전후에 아미노산 변화에서 큰 차이를 보이지 않았으나, 발효실에서 발효한 막장의 아미노산 변화는 상당히 뚜렷한 차이를 보였다. 종균을 접종한 단일시험구(S3)와 복합시험구(M)에서는 90일간 발효실에서 두었을 때, glutamic acid와 aspartic acid의 함량이 각각 859.74±126.34 mg/g과 197.56± 15.70 mg/g, 그리고 867.42±77.27 mg/g과 243.20± 15.79 mg/g으로, 대조구의 glutamic acid(654.56± 79.98 mg/g)와 aspartic acid(116.48±17.79 mg/g)에 비해 높은 함량을 나타내었는데, 이 같은 성분 차이는 관능적 평가에 있어 긍정적 영향을 미칠 것으로 사료된다. 또한, 단맛을 부여하는 glycine 함량은 대조구(50.44±1.95 mg/g)에 비해 모든 시료에서 51.82±7.53-73.22±7.38 mg/g의 범위로 높은 값으로 검출되었으며, 특히 복합시험구(M)는 73.22±7.38 mg/g으로 가장 많은 함량을 보였다.
미생물 군집 분석데이터가 1.00에 근접한 Good’s Lib. coverage를 나타내어 각 시료에서 얻어진 read 수가 미생물 군집 구조 분석에 통계적으로 충분하였다(Table 4). 아미노산 질소, 환원당 등의 품질 특성이 발효기간 내 뚜렷하게 차이를 보인 S3과 M 시험구를 대상으로 alpha-diversity 분석을 진행하였다.
Diversity indices of are compared between the bacterial (A) and fungal (B) communities in makjang distinguished into outdoors and indoors.
ASVs (amplicon sequence variants) are the inferred unique sequences after correcting for sequencing and PCR errors.
먼저 옥외와 발효실에서 90일 동안 발효시킨 막장의 미생물 군집에 대한 구조와 동질성을 분석한 결과, 세균군집의 경우 종 풍부도(richness)는 옥외에서 41.00-55.17, 발효실에서는 41.33-65.20을 나타내어 옥외에서보다 발효실에서 발효시킨 막장이 상대적으로 높은 것으로 분석되었다. 옥외의 종 다양성과 균등성(diversity and evenness)은 각각 3.40-3.52와 0.85-0.88의 값을 보였고, 발효실에서는 3.42-4.00과 0.87-0.92로 이들 지수들 간에는 두 환경적 차이에 의한 뚜렷한 변화를 보이지 않았다. 반면, 진균군집의 경우, 옥외에서의 종 풍부도가 21.00-28.00을, 발효실에서는 24.00-26.00을 나타내어 세균군집의 결과와 상이하게 옥외에서 조금 높은 값을 나타내었다. 또한, 종 다양성과 균등성에서도 각각 옥외에서 2.21-2.81과 0.66-0.79를, 발효실에서는 0.61-1.27과 0.14-0.34로 나타나 옥외에서의 값들이 발효실에 비해 상대적으로 높은 것으로 분석되었다. Cho 등(2017)의 연구에 따르면 된장의 지역 권역별 미생물 군집 분석 결과, 세균의 종 풍부도, 다양성, 및 균등성 지표에서 진균에 비해 상대적으로 높아, 된장에서 세균들이 진균에 비해 보다 더 다양하고 균등하게 분포되어 있다고 보고하여, 본 실험에서 제조한 막장에서는 옥외환경에 노출되었을 때에 진균이, 35°C 항온조건의 발효실에서는 세균이 상대적으로 발효를 주도했을 것으로 판단된다.
한편, 종균 첨가에 따른 막장의 세균군집 변화를 살펴본 결과, 대조구와 복합시험구 M은 옥외와 발효실에서 41.00-43.00의 유사한 풍부도를 보였지만, 단일시험구 S3은 옥외에서 55.00, 발효실에서는 64.00의 풍부도를 나타내며 상대적으로 높은 값을 보였다. 반면, 진균군집의 경우, 단일시험구 S3과 복합시험구 M은 옥외에서 둘 다 28.00을, 발효실에서는 각각 26.00과 24.00의 풍부도로 대조구(21.00)보다 조금 높은 값을 나타내었다. 종 다양성과 관련하여, 대조구(2.21)와 비교했을 때, 옥외에서 S3(2.47)와 M(2.81)은 높은 지수를 보였으나, 발효실에서의 S3(1.27)와 M(0.61)은 상대적으로 낮은 지수를 나타내었다. 종 균등성 또한 비슷한 경향을 보여, 대조구(0.66)에 비해 옥외에서는 0.75-0.79로 약간 높은 값을 나타냈지만, 발효실에서는 M(0.14)이 현저히 낮았고 S3(0.34)도 비교적 낮은 수치를 보였다.
결과적으로 발효실 환경에서 복합시험구 M의 미생물 군집 간 종 다양성과 균등성 지수가 낮게 나타난 것은 접종한 복합균주들이 일정한 발효조건에서 생육이 촉진되어 막장 내 우점하게 되었고, 이로 인해 다른 미생물들의 성장을 억제함으로 군집 내 복잡성을 낮춰(Zhang 등, 2022) 발효의 효율과 특성에 영향을 준 것으로 사료된다.
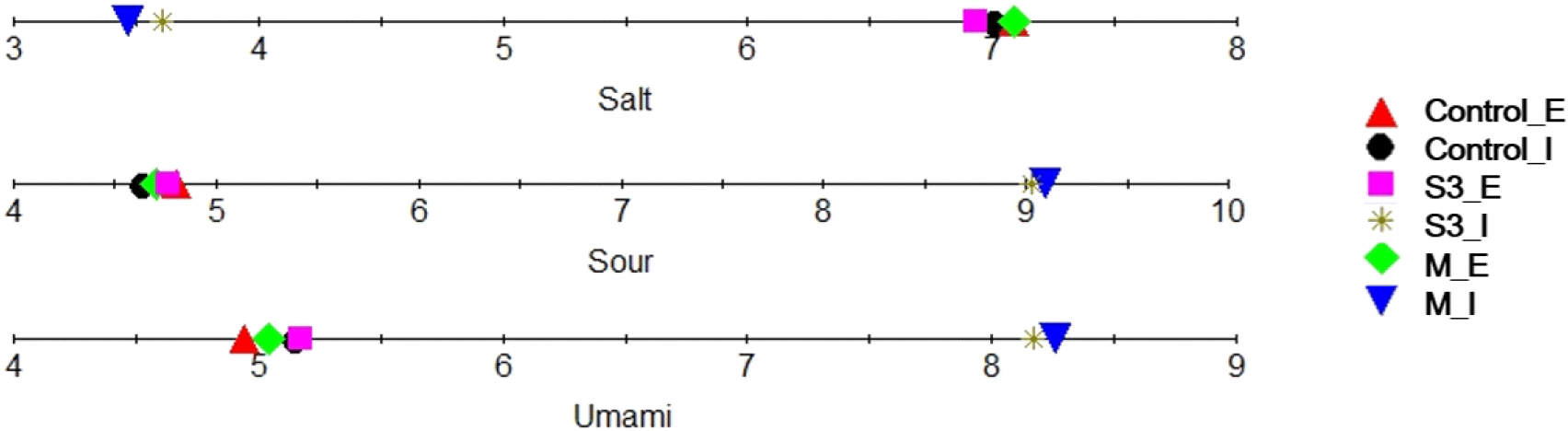
본 연구에서는 발효장소와 종균을 달리하여 90일간 발효시킨 막장의 관능적 요소인 짠맛, 신맛, 그리고 감칠맛의 강도를 전자혀로 측정하여 그 결과를 Fig. 2에 나타내었다. 발효실에서 숙성한 시험구 S3와 M 시료들의 짠맛 강도(CTS)는 3.61과 3.47로, 대조구(6.99)와 비교하여 낮은 값을 보였다. 반면, 옥외에서 발효시킨 S3와 M의 시료들의 경우 6.93과 7.09로, 대조구(7.09)와 뚜렷한 차이 없이 발효실에서의 시료들보다 상대적으로 높은 값을 보였다. 감칠맛(NMS)과 신맛(AHS)은 짠맛과 달리, 발효실에서 숙성한 S3과 M의 막장 시료들의 감칠맛은 각각 8.17과 8.26으로 대조구(5.14)에 비해 높은 값을 나타내었고, 옥외에서는 각각 5.17과 5.04로 대조구(4.95)와 비슷한 수준으로 발효실에 비해서 낮은 값을 보였다. 마지막으로 신맛의 경우 옥외와 발효실에서의 대조구는 각각 4.81과 4.62의 값을 나타내었고, 옥외에서의 S3과 M 시료들은 각각 4.76과 4.70으로 대조구와 비슷한 수준으로 측정되었다. 반면, 발효실에서는 종균처리구인 S3와 M의 시료들이 각각 9.03과 9.10으로 상대적으로 신맛 강도가 높았다. 전자혀 분석결과는 앞에서 언급된 바와 같이 발효실에서 종균을 처리하여 제조한 시료들이 높은 아미노산 질소 함량과 총산 값을 나타내어 품질 특성 결과와 상관성을 보였고, 특히 복합시험구(M)의 경우에는 다른 시험구에 비해 높은 감칠맛과 신맛, 그리고 낮은 짠맛 강도를 보여 관능적으로 긍정적인 평가를 기대할 수 있을 것으로 판단된다.
복합종균을 적용하고 발효장소를 달리하여 제조한 막장의 품질 특성, 아미노산 함량 및 미생물 군집 데이터를 이용하여 다중 요인 분석(multiple factor analysis, MFA)을 수행하였고, 그 결과는 Fig. 3(A)와 (B)에 나타내었다. F1과 F2 변수는 각각 전체 데이터 변동의 66.83%와 21.13%를 기여하여 총 87.96%의 설명력을 보였다.
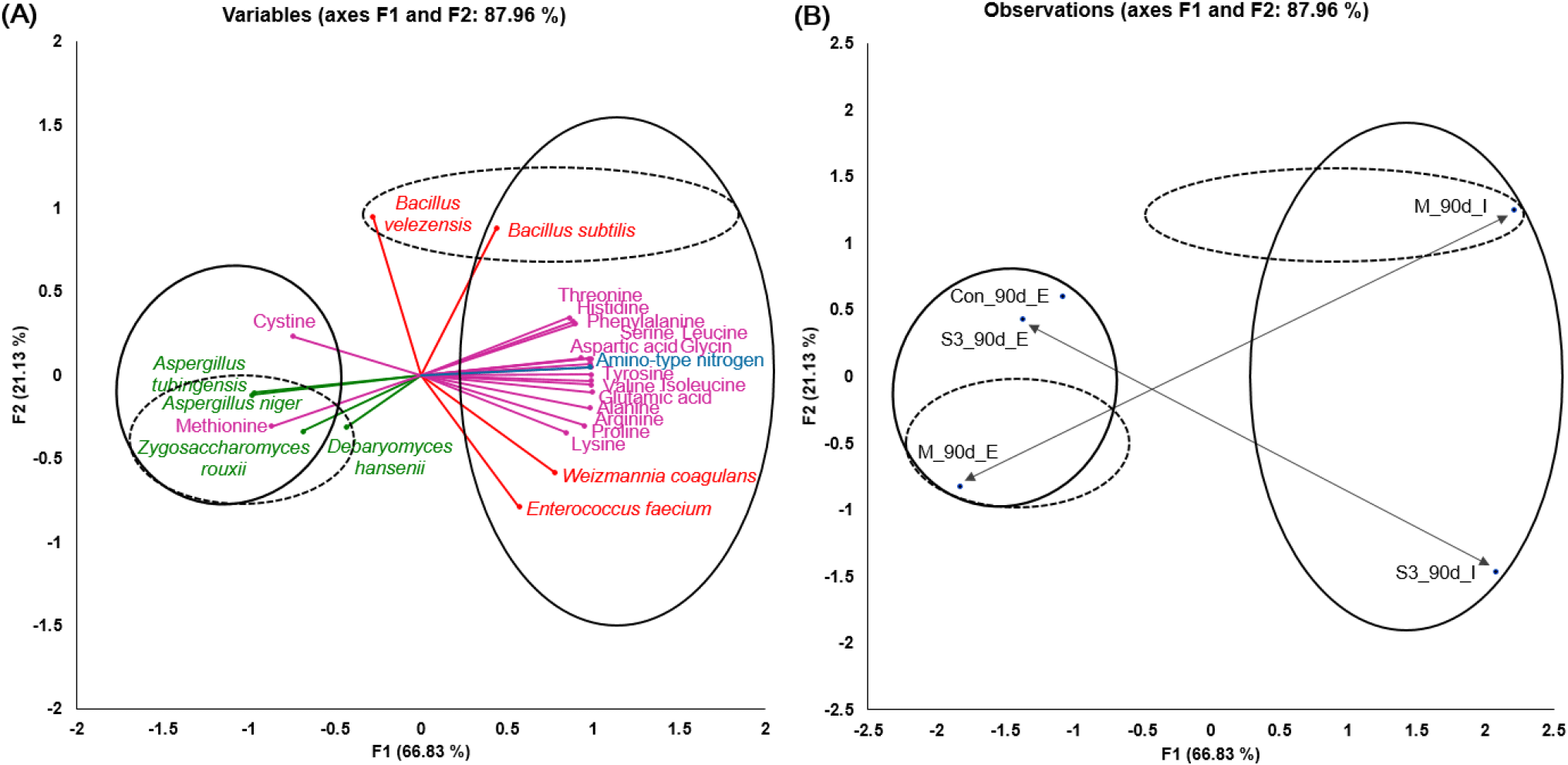
먼저 Fig. 3(B)에 표시한 바와 같이 옥외(E)와 발효실(I) 등 발효장소에서의 환경 변화는 미생물의 대사산물과 군집 차이로 F1 축을 통해 구분된다. 한편, Fig. 3(A)에서는 종균의 처리 여부와 무관하게 F1상 양의 방향에 아미노산과 아미노산 질소 함량 등이 분포하여 맛 성분 생성에 큰 영향을 주었고, 이들 그룹 내에 실내에서 발효한 종균처리구 중 복합종균(M) 처리로 B. velezensis(11.98%)와 B. subtilis (15.03%) 등의 Bacilli속이, 유산균 단일처리(S3)로는 Weizmannia(W.) coagulans(3.14%)와, E. faecium(4.28%) 등의 세균들이 우점하며, 발효에 밀접하게 기여하였음을 시사하고 있다. 반면, 옥외에서 발효시킨 막장은 Aspergillus (A.) tubingensis(5.08-7.50%)와 A. niger(20.38-31.79%)가 F1상 음의 방향에 위치하였고, D. hansenii(2.54%)와 Zygosaccharomyces(Z.) rouxii(4.52%) 등의 풍부도가 M시료에서 우세하였다. 이는 진균들이 생육온도가 상대적으로 낮았던 옥외 환경에서, 35°C로 유지한 발효실 조건에 비해 용이하게 증식했을 것으로 판단된다.
따라서 본 연구결과를 토대로 발효장소와 종균처리 등 발효조건의 변화는 미생물 군집 형성과 품질 특성에 큰 영향을 준다는 것을 알 수 있었고, 특히, 복합종균(B. velezensis NY12-2, D. hansenii D5-P5, E. faecium N78-11 등 3종)의 사용과 일정한 온도에서 발효시킬 경우, 보다 빠르게 세균 군집을 형성하여 맛 성분 변화에 긍정적인 역할을 한다는 것을 확인할 수 있었다.
4. 요약
본 연구에서는 B. velezensis NY12-2, D. hansenii D5-P5, 그리고 E. faecium N78-11 등을 단일 또는 복합종균으로 구성하여 막장을 옥외와 발효실(35°C) 등의 발효장소를 달리하여 90일간 발효장소와 종균이 품질변화에 미치는 영향을 살펴보고자 수행하였다.
먼저 발효환경 및 종균처리와 무관하게 수분함량과 pH는 발효기간이 경과함에 따라 전반적으로 감소하는 경향을 보였으며, 그로 인해 염도와 산도는 증가하였다. 또한, 총균수는 발효기간이 경과함에 따라 유의적으로 증가한 반면, 유산균 수는 감소하였고, 곰팡이 수는 발효기간 내내 비슷한 수준을 유지하였다. 환원당 함량은 초기에 5.33± 0.02-5.72±0.15%에서 발효 30일 차에 가장 높게 증가하였다가 90일 차에는 미생물의 영양원 소비, Maillard 반응, 알코올 및 유기산 발효에 따른 당 소비로 인해 옥외와 발효실에서 각각 7.28±0.14-8.43±0.05%와 6.02±0.00-7.39± 0.11%로 급격히 감소하였다. 제조 직후 막장 시료들의 아미노산 질소 함량은 122.75±0.99-155.01±2.98 mg%이었고, 발효 30일 만에 대부분의 시험구(대조구 제외)들은 500 mg% 이상 상승하였으며, 특히 발효실에서 35°C, 90일간 발효한 복합시험구(M)는 최대 668.43±0.99 mg%로 가장 높은 값을 보였다.
총아미노산 함량은 제조 직후 1,166.89-1,527.12 mg/g이었고, 90일 발효 후 옥외(3,150.73-3,615.08 mg/g) 대비 발효실에서 3,661.71-4,644.04 mg/g 수준으로 높은 값을 나타내었다. 특히 단일시험구(S3)와 복합시험구(M)는 옥외에서 각각 3615.08 mg/g과 3546.91 mg/g을, 발효실에서는 4484.95 mg/g과 4644.04 mg/g으로 시험구 중 높은 값을 나타내었다. 또한, 발효 후 막장 시료들 간 세균군집의 풍부도는 발효실이 옥외에 비해 상대적으로 높았고 B. subtilis, W. coagulans, E. faecium 등이 높은 빈도로 검출되었지만, 종 다양성 및 균등성에서는 두 환경 간 큰 차이는 없었다. 반면, 진균군집의 경우, 발효실에서의 풍부도가 옥외에 비해 상대적으로 낮았는데, 종 다양성 및 균등성 또한 옥외 대비 상대적으로 낮은 값을 보였다. 주로 검출된 진균들은 A. tubingensis, A. niger, D. hansenii, Z. rouxii 등이었다. 또한, 전자혀를 이용한 막장의 맛 패턴 분석결과에서도 발효실에서 복합종균을 접종하여 제조한 시험구(M)에서 낮은 짠맛과 높은 감칠맛 강도를 나타내었는데, 이는 아미노산 질소와 아미노산 등 함량이 높았던 품질 특성과 깊은 상관성을 보여주었다.
종합적으로, 본 연구에서 옥외와 발효실이라는 발효환경 조건과 복합종균 사용이 미생물 군집 형성에 영향을 주어 맛 성분 증가라는 긍정적인 효과와 연계됨을 알 수 있었다. 향후 유용 종균과 함께 일정한 온도의 발효환경을 조성하여 제조한다면 장류식품의 품질향상 및 발효관리에 도움을 줄 수 있을 것으로 기대된다.
