1. 서론
고수분 식품에서의 부패와 변질은 주로 화학적, 물리적 변화보다는 미생물에 의해 발생되고, 이를 방지하기 위해 다양한 합성보존료를 사용하고 있다. 그러나 이에 따른 인체의 부작용 발생 가능성이 지속적으로 제기되고 있어 기존 합성보존료를 대체할 수 있는 천연보존료 개발을 위한 연구가 다양하게 수행되고 있다(Han 등, 2020; Kang 등, 2022). 국내의 천연보존료 산업화 기술은 미진한 실정이며, 자몽종자 추출물 외에는 국내에서 산업적으로 활용 가능한 제품이 거의 없어 새로운 천연보존료 기술 개발이 매우 필요한 실정이다(Kim 등, 2019). 녹차는 발효시키지 않은 차나무(Camellia sinensis)의 잎을 사용해서 만든 차로서 동아시아 지역이 주 생산지로 전 세계 생산량 중 82%를 차지하고 있으며, 아시아 지역 내 녹차의 주 생산국은 중국, 일본, 대만, 한국이다. 녹차에는 카테킨, 카페인, 아미노산, 무기질 등 인체 내 다양한 생리활성을 나타내는 성분들이 다량 함유되어 있고(Vishnoi 등, 2018), 오래전부터 항산화, 항염증, 항균, 항암, 항노화, 항알레르기 활성 등 다양한 효능이 있는 것으로 밝혀져 있다(Namita 등, 2012). 이러한 연유로 녹차는 건강식품, 식품 보존료, 항균제 등 다양한 기능성 소재로 개발되었을 뿐 아니라, 높은 산업적 잠재 가치를 가지고 있다(Chung과 Yoon, 2008).
식물 유래 phytochemical 물질들은 비타민, 미네랄 등과 같은 필수 영양소는 아니지만 phenolic, alkaloid, flavonoid, terpenoid 등으로 존재하고, 이들은 항산화, 항균, 항염증, 항암 등 다양한 인체 생리 활성을 나타낸다(Joung 등, 2007). 녹차 잎에는 catechin과 flavonol이 풍부하게 함유되어 있고, 이러한 polyphenol 물질은 구성성분의 약 36% 이상 차지한다(Al Hroob 등, 2019; Prasanth 등, 2019). 식물 잎 세포 mesophyll 영역에는 1차 대사를 위한 엽록소를 포함하여 생체방어기작을 담당하는 2차 대사산물인 phytochemical 물질이 축적되어 있고(Isah, 2019), 세포 내에서 합성 또는 전환되어 세포 외로 배출된다(Liu 등, 2018). 식물 잎 세포벽은 대부분 cellulose, hemicellulose, pectin 및 lignin 등으로 구성되어 있어(Schädel 등, 2010) 세포벽 파괴를 거치지 않고 phytochemical 물질을 회수하는 것은 효율적이지 않을 수 있다. 세포벽 물질은 grinding을 포함하여 초음파 처리, 산 가수분해 또는 효소 분해로 파괴가 가능하며, phytochemical 물질은 비교적 극성도가 있는 유기용매에 잘 추출되어 회수 용매로 알코올류가 자주 사용된다(Altemimi 등, 2017).
한편, Trichoderma reesei로부터 생산된 cellulase는 cellulose를 glucose, cellobiose 및 glucose 중합체 등으로 분해하며, Aspergillus aculeatus로부터 생산된 pectinase에는 pectintranseliminase, polygalacturonase, pectinesterase, hemicellulase 및 cellulase가 포함되어 있어(Sigam-Aldrich, 2023a; Sigam-Aldrich, 2023b), 이 두 효소를 사용하면 식물 잎 세포벽 분해가 가능하다. 효모는 다양한 식품산업에서 활용되고 있으며, 와인 발효에 대표적으로 Saccharomyces cerevisiae가 사용되고 있다. 이 효모는 혐기적인 당 발효를 통해 알코올, CO2 이외 향기 성분 등과 같은 2차 대사산물을 생성하며, 재료로부터 polyphenol류의 회수를 용이하게 하고 향을 부여하여 최종 제품의 품질을 높여주는 역할을 한다(Li 등, 2017; Oh와 Jin, 2020; Yoon 등, 2015).
이와 관련하여 본 연구에서는 항산화와 항균 활성 등이 우수한 녹차 잎으로부터 phytochemical 물질 회수에 적합한 에탄올의 농도 설정과 세포벽 분해 효소 및 효모 발효가 phytochemical 물질과 위 두 활성을 높이는 데 도움을 줄 수 있는지 살펴보았다. 녹차 잎 에탄올 추출물을 포함하여 녹차 잎을 cellulase와 pectinase 혼합 효소로 처리하거나 S. cerevisiae로 발효한 추출물 또는 효소 처리와 효모 발효를 병행한 추출물의 수율, 총페놀화합물 및 플라보노이드 함량을 조사하였고, 처리 방법에 따른 항산화 및 항균 활성 비교를 통해 활성이 증진된 녹차 잎 추출물의 제조방법을 제시하고자 하였다.
2. 재료 및 방법
재료로 사용된 녹차 잎(leaf of Camelia sinensis)은 건조 분말 형태로 가공 포장된 것을 화개악양농협(Hadong, Korea)으로부터 구입하여 사용하였다. 항균 활성 평가에는 다음과 같이 식품위해균 7종이 사용되었다. Bacillus cereus KCTC 3062, B. licheniformis KCTC 1918, Listeria monocytogenes KCTC 13064, Staphylococcus aureus subsp. aureus KCTC 3881, Aeromonas hydrophila subsp. hydrophila KCTC 2358과 Escherichia coli KCTC 2441은 생물자원센터(Korean Collection for Type Cultures; Jeongeup, Korea)로부터 분양 받았다. Salmonella Typhimurium NCCP 12219는 국가병원체자원은행(National Culture Collection for Pathogens; Cheongju, Korea)으로부터 분양받았다. 시험 균주는 모두 brain heart infusion(Difco; Becton Dickison and Co., Sparks, MD, USA)에서 활성화시킨 다음, tryptic soy agar(Difco)에 보관하면서 사용하였다. 효모 발효에 사용된 Saccharomyces cerevisiae KFRI 122는 전통주로부터 분리된 stock 균주로 yeast mold agar(Difco)에 보관하면서 사용하였다.
녹차 잎 분말의 일반성분은 AOAC 방법(2005)에 따라 분석하였다. 수분 함량은 상압가열건조법(method 950.46), 회분 함량은 직접회화법(method 923.03), 조단백질 함량은 자동화 장치를 이용한 semi-Kjeldahl 법(method 976.05), 조지질 함량은 diethyl ether를 사용한 용매침지 추출법(method 991.36)으로 각각 분석하였다. 탄수화물 함량은, 탄수화물(%) = 100 - (수분 함량 + 조단백질 함량 + 조지질함량 + 회분함량) 계산식을 활용하여 산출하였다.
녹차 잎 분말의 구성당은 HPAEC-PAD(high-performance anion-exchange chromatography combined with pulsed amperometric detector; Thermo Fisher Scientific Inc., Waltham, MA, USA)로 분석하였다(Jun 등, 2018). 시료 10 mg에 72% sulfuric acid 100 μL를 가한 뒤 121°C에서 1시간 동안 가수분해를 진행하였고, 2.8 mL 탈이온수(deionized water, DW)에 희석한 다음 0.20 μm PTFE Syringe filter(Advantec Toyo Kaisha, Ltd., Tokyo, Japan)에 여과 후 분석용 시액으로 사용하였다. 컬럼은 Dionex™ CarboPac™ PA-1(10 μm, 4×250 mm; Thermo Fisher Scientific Inc.)을 사용하였고, 시액 20 μL를 주입한 뒤 18 mM sodium hydroxide를 1 mL/min 유속으로 흘리면서 분석하였다. 단당류 동정 및 정량을 위해 8종의 단당류 표준시약(fucose, rhamnose, arabinose, galactose, glucose, mannose, xylose, fructose; Sigma-Aldrich Inc., St. Louis, MO, USA)을 사용하였고, 산성당 동정 및 정량을 위해 3종의 산성당 표준시약(glucuronic acid, galacturonic acid, mannuronic acid; Sigma-Aldrich Inc.)을 사용하였다. 혼합한 표준시약을 시료와 동일한 방법으로 분석하여 얻은 머무른 시간과 비교하여 동정하였고, 3-point 농도의 외부 표준용액 분석법으로 정량하였다.
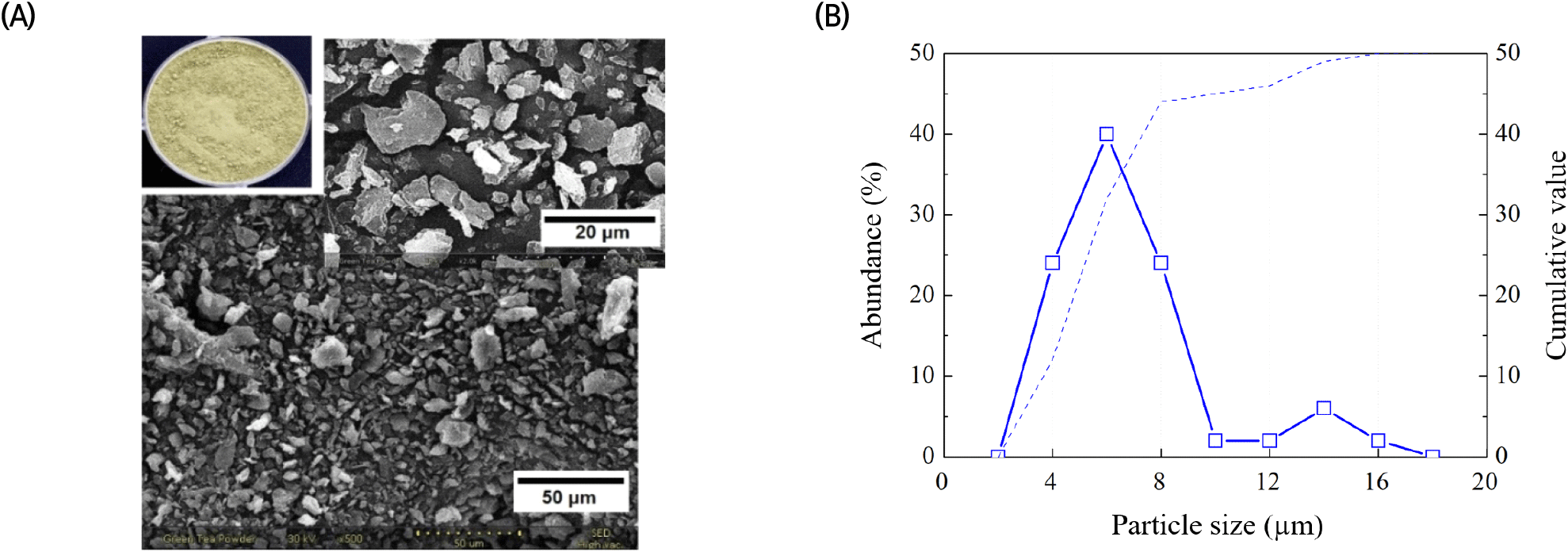
녹차 잎 분말의 형태학적 관찰 및 입도 분포 분석을 위해, 별다른 처리 없이 녹차 분말을 백금도금 후 주사전자현미경(Nanoeye, SNE-3000M; SEC Co., Ltd., Suwon, Korea)으로 관찰하였고, Image J 프로그램을 사용하여 녹차 잎 분말의 입자 크기 분포도를 측정하였다.
녹차 잎 분말로부터 phytochemical 물질 추출에 적합한 에탄올의 농도 설정을 위해 다음과 같이 에탄올 농도별 추출물을 제조하였다. 녹차 잎 분말에 25 배수 DW 또는 25, 50, 75% 에탄올을 각각 가하고 균질(10,000 rpm, 5 min)하였고, 원심분리(8,000 ×g, 4°C, 30 min)하여 얻은 상등액을 용매 추출물로 하였다. 가열 처리에 의한 용매 추출물의 항산화 및 항균 활성 변화를 살펴보기 위해, 앞서 기술한 바와 동일하게 균질 처리를 진행하였고, 121°C에서 15분간 가열 처리하였다. 이 후 실온에서 냉각한 뒤 원심분리(8,000 ×g, 4°C, 30 min)하여 상등액을 얻어 가열 처리 용매 추출물로 하였다.
세포벽 분해 효소 처리 또는 효모 발효를 진행하여 얻은 추출물의 제조방법은 Fig. 1과 같다. 세포벽 분해 효소 처리 및 S. cerevisiae 발효가 녹차의 항산화 및 항균 활성에 미치는 영향을 살펴보기 위해 다음과 같이 실험 그룹을 설정하였다. 가열 처리한 녹차 잎 50% 에탄올 추출물을 대조구(50% EOH-H)로, 효소 처리 단독(Ecp25), 효모 발효 단독(SC), 효소 처리 후 효모 발효(Ecp25+SC), 효모 발효 후 효소 처리(SC+Ecp25)로 각각 설정하여 진행하였고, 이들의 항산화 및 항균 활성을 평가하여 비교하였다. 효소 처리를 위해, 녹차 분말에 12배수에 해당하는 DW를 가하고 균질(10,000 rpm, 5 min)하였고, cellulase(from Trichoderma reesei, ≥700 unit/g; Sigma-Aldrich Inc.)와 pectinase (from Aspergillus aculeatus, ≥3,800 unit/mL; Sigma-Aldrich Inc.)를 녹차 분말의 각 2.5%(v/w dry sample)가 되도록 첨가한 뒤 50°C에서 12시간 반응시켰다. 이후 121°C에서 1분간 열처리하여 효소를 불활성화시켰고, 에탄올을 최종 농도 50%가 되도록 가한 다음 원심분리(8,000 ×g, 4°C, 30 min)하여 상등액을 얻었고, 이를 효소 처리 추출물(Ecp25)로 하였다. 효모 발효의 경우 녹차 잎 분말에 12 배수에 해당하는 DW를 가하여 균질하였고, 121°C에서 1분간 순간 살균한 다음 yeast mold broth(Difco)에서 전배양(35°C, 20 h) 한 S. cerevisiae KFRI 122를 최종 효모수 약 5 log CFU/mL가 되도록 접종하였다. 이후 35°C에서 3일간 흔들면서 배양하였고, 121°C에서 15분 멸균처리를 진행하였다. 여기에 에탄올을 최종 농도 50%가 되도록 가한 다음 원심분리(8,000 ×g, 4°C, 30 min)하여 상등액을 얻었고, 이를 효모 발효 추출물(SC)로 하였다. 순서와 관계없이 효소 처리 및 효모 발효를 병행 진행한 것은 에탄올 첨가 전까지 동일하게 효소 처리 또는 효모 발효를 진행한 뒤 최종 추출물 회수 시 에탄올을 최종 농도 50%가 되도록 가한 다음 원심분리(8,000 ×g, 4°C, 30 min)하여 상등액을 얻었다.
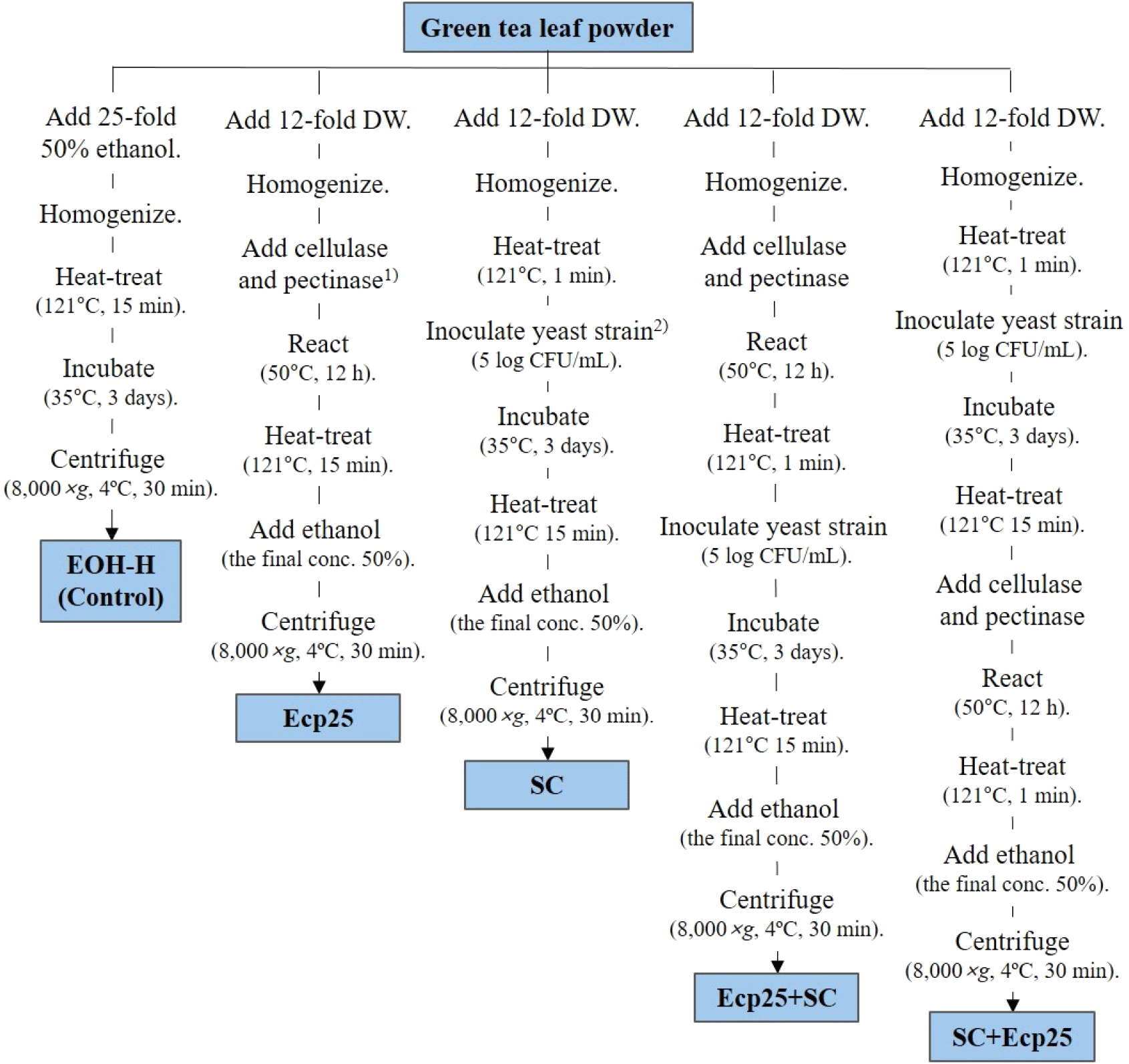
사용된 녹차 잎 분말로부터 용매 추출, 세포벽 분해 효소 처리 및 효모 발효를 통해 얻은 추출물의 수율을 구하기 위해, 얻은 액상 추출물의 총 부피와 추출물 내 고형분 함량을 측정하였다. 추출물의 총 부피는 50 mL 메스실린더(tolerance 0.5 mL)를 사용하여 측정하였고, 항량된 도가니에 액상 추출물 10 mL를 취하고 60°C에서 약 3시간 예비 가열한 다음 105°C에서 약 6시간 가열건조하여 고형분 함량을 측정하였으며, 아래 계산식에 대입하여 수율(%)로 나타내었다.
녹차 잎 용매 추출물을 포함한 세포벽 분해 효소 처리 및 효모 발효 추출물의 항산화 활성은 DPPH(2,2-diphenyl-1-picrylhydrazyl; Sigma-Aldrich Inc.) 라디칼 소거 활성 측정 방법(Sharma와 Bhat, 2009)을 약간 변형하여 평가하였다. 0.25 mM DPPH-ethanol 반응액을 517 nm에서 흡광도 약 1.2가 되도록 조제하였고, 시료액마다 50% ethanol을 사용하여 2배씩 희석한 7단계 희석액을 각각 준비하였다. 각 시료의 희석액 200 μL에 DPPH-ethanol 반응액 600 μL를 가한 뒤 vortex하였고, 상온에서 30분간 반응시켰다. 각 반응액은 5,000 ×g(4°C)에서 5분간 원심분리하였고, 상등액 200 μL를 96-well plate에 옮긴 뒤 517 nm에서 흡광도를 측정하여 아래 계산식에 대입해 DPPH 라디칼 소거 활성(%)으로 나타내었다. EC50 값을 구하기 위해, 각 시료 희석단계 별 농도를 x 축, 활성을 y 축으로 하여 1차 함수식을 구하였고, y값에 소거활성 50% 일 때를 가정한 50을 대입하여 얻은 x 값을 EC50 값으로 정의하였다.
녹차 잎 추출물의 항균 활성은 agar-well diffusion 방법으로 평가하였다(Jun 등, 2015). 평가전 L. monocytogenes KCTC 13064는 tryptic soy broth(Difco), 나머지 시험 균주 6종은 mueller hinton broth(Difco)를 사용하여 30°C에서 약 15시간 전배양하였고, 전배양과 동일한 배지조성의 agar에 시험 균주의 최종 농도가 약 5 log CFU/mL가 되도록 접종한 뒤 plate에 부어 굳혔다. 각 균주가 접종된 agar plate에 가열 살균한 직경 5 mm의 실린더를 사용하여 well을 제작하였고, 시험 물질 50 μL를 주입한 뒤 30°C에서 24시간 배양하였다. 배양이 끝난 뒤 버니어캘리퍼스를 사용하여 균의 증식이 저해된 저해존(diameter of inhibition zone, DIZ)의 직경을 측정하였고, well의 직경을 감하여 저해존의 크기를 나타내었다. 각 시험 물질의 평가 농도는 10 mg/mL이었고, 용매 대조구(solvent control)로 DW, 50% 또는 75% ethanol을 사용하여 시험 물질과 동일하게 평가하였다.
총페놀화합물 함량은 Folin-Denis 방법(Dewanto 등, 2002)에 따라 측정하였다. 시료 125 μL에 Folin & Ciocalteau’s phenol reagent(Sigma-Aldrich Inc.) 125 μL, 75% ethanol 0.5 mL를 순차적으로 가하고 혼합한 다음 5분 동안 정치하였다. 여기에 4% sodium carbonate 2.25 mL를 가하고 90분 동안 실온에서 정치한 후 740 nm에서 흡광도를 측정하였다. Gallic acid(Sigma-Aldrich Inc.)를 표준물질로 0-600 μg/mL의 농도로 조제하여 시료와 동일하게 측정하였다. 결과로부터 1차 함수식을 얻었고, 시료의 흡광도 값을 대입하여 총페놀화합물 함량을 계산하였다.
총플라보노이드 함량은 Chang 등(2002)의 방법에 따라 측정하였다. 시료 500 μL에 80% ethanol 1.5 mL를 가하고 혼합하였다. 여기에 10% aluminum chloride와 1M potassium acetate 각 100 μL와 DW 2.8 mL를 순차적으로 가하고 혼합한 다음 30분간 정치하였다. 이것을 3,000 ×g(4°C)에서 10분간 원심분리하여 얻은 상등액을 415 nm에서 흡광도를 측정하였다. 표준물질로 rutin trihydrate (Sigma-Aldrich Inc.)를 사용하였고, 0-600 μg/mL 농도로 조제하여 시료와 동일한 방법으로 측정하였다. 결과로부터 1차 함수식을 얻었고, 시료의 흡광도 값을 대입하여 총플라보노이드 함량을 계산하였다.
3. 결과 및 고찰
재료로 사용된 녹차 잎 분말의 화학적 조성을 파악하고자 일반성분 및 구성당 분석을 진행하였고, 그 결과를 Table 1로 나타내었다. 녹차 잎 분말은 탄수화물 69.94%, 조단백질 16.86%, 회분 5.79%, 조지질 3.05%로 구성되어 있었다. 재배 지역, 시기, 수확 후 처리 및 보관 방법에 따라 달라질 수 있지만, 녹차 잎은 polyphenols 36%, 탄수화물 25%, 단백질 15%, lignin 6.5%, 회분 5%, 아미노산 4%, methyl xanthines 3.5%, 지질 2%, 유기산 1.5%, chlorophyll 0.5% 등으로 구성되어 있다 보고된 바 있다(Al Hroob 등, 2019). 녹차 잎 분말의 구성당 분석 결과 7종의 중성당과 1종의 산성당이 검출되었다. 이를 높은 비율 순으로 나열하면, glucose, galacturonic acid, galactose, arabinose, xylose, rhamnose, mannose 및 fucose 순으로 나타났고, glucose 비율이 검출된 구성당의 54.34%를 차지하는 것으로 나타났다. 식물 잎의 hemicellulose는 대부분 xyloglucan 형태로 glucose와 xylose가 주요 구성당이며(Zhang 등, 2020), 녹차 잎 분말 내 pectin의 주요 구성당인 galacturonic acid의 비율은 검출된 총구성당의 14.83%를 차지하는 것으로 나타났다. 쌍떡잎 식물의 세포벽은 15-30% cellulose, 30-40% pectin, 20-30% hemicellulose 및 소량의 lignin 등으로 구성되어 있는 것으로 보고되고 있다(Avci, 2022). 형태학적 관찰에서 녹차 잎의 외형은 불규칙적이지만 타원형으로 나타났고, 대부분 2-10 μm 범위에서의 입자 크기 분포도를 보였다(Fig. 2).
식물 유래 phytochemical 물질들은 유기용매 가운데 알코올과 같은 비교적 극성도가 있는 용매에 잘 추출된다(Altemimi 등, 2017). 녹차 잎 분말로부터 항산화 및 항균 활성이 높은 물질을 회수하기 위해, DW를 포함한 다양한 농도의 에탄올을 조제하여 추출 용매로 사용하였다. 또한, 살균, 가열 등의 목적으로 열처리가 필요한 식품 제조공정에 보존료로 사용하기 위해서는 추출물 내 활성 물질의 열에 대한 안정성이 요구되므로, 가열 처리에 따른 항산화 및 항균 활성 변화를 함께 살펴보았다(Table 2와 3).
녹차 추출물 제조 시 25% 에탄올을 추출 용매로 사용하고 가열 처리(121°C, 15 min)를 할 경우 가장 높은 수율을 나타내었고, 물을 사용하여 상온에서 추출할 때 유의적으로 가장 낮은 수율을 보였다(p<0.05). 이 두 경우를 제외하고 75% 이내 에탄올 농도 및 가열 처리에 따른 추출물간 수율 변화는 거의 없었고, 평균적으로 약 26% 수율을 보였다. DPPH 라디칼 소거 활성은 추출 용매인 에탄올 농도에 따라 차이를 보였으며, 가열 처리 유 ․ 무와 관계없이 50% 에탄올 사용 시 가장 낮은 EC50 값을 나타내었다. 즉, 이 농도에서 항산화 잠재력이 가장 우수한 추출물을 제조할 수 있는 것으로 판단되었다. 가열 처리 유·무에 따라 추출물의 DPPH 라디칼 소거 활성은 큰 차이를 보이지 않아 121°C, 15분간 가열 처리에 항산화 활성 물질은 비교적 안정한 것으로 예상되었다.
식품 보존료로써 녹차 잎 추출물의 활용 가능성 평가를 위해, 대상균으로 식품 위해균 7종을 선택하였고, 추출물의 항균 활성은 agar-well diffusion 방법으로 측정하였다. 녹차 잎 용매 추출물에 의해 균의 증식이 억제된 저해존(DIZ)은 B. cereus, B. licheniformis, S. aureus subsp. aureus 및 A. hydrophila subsp. hydrophila에서 관찰되었고, 물 추출물은 모든 대상균에 대해 항균 활성을 나타내지 않았다(Table 3). 추출 용매로 25% 에탄올 사용 시 B. licheniformis에 대해 항균 활성을 보이지 않았던 반면, 에탄올 50% 농도부터 앞서 나열한 균종 모두에 대해 항균 활성을 나타내었다. 가열 처리에 의한 항균 활성 변화는 없었다. 다만, A. hydrophila subsp. hydrophila의 경우 에탄올 농도의존적으로 감수성이 증가하는 것으로 나타났다. 이 세균은 수인성으로 담수어 양식장에서 주로 발견되며, 이와 관련된 생물 원료 또는 일부 가공식품 등에서 발견된다(Stratev와 Odeyemi, 2016).
녹차 잎 또는 녹차 추출물은 여러 연구에서 넓은 항균 스펙트럼을 가지며 catechins이 주요 유효 물질로 알려져 있다. 이 가운데에서도 (−)-epigallocatechin gallate와 (−)-epicatechin gallate는 methicillin 내성 S. aureus를 포함하여, Helicobacter pylori, 충치 원인균인 Streptococci 등에 대해 증식 저해 활성을 가지며, 항생제와의 상승효과를 보여 다양한 약제 내성균들의 제어를 위해 평가되고 있다(Taylor 등, 2005). Liu 등(2022)은 녹차 잎을 에탄올로 추출한 다음 ethyl acetate로 분획하여 catechins이 풍부한 추출물을 제조할 경우 최소억제농도 10-35 mg/mL 수준에서 Enterococcus faecalis, S. aureus, E. coli와 Sal. Typhimurium에 항균 효과를 나타낸다 하였다.
본 연구에서 평가한 녹차 잎 용매 추출물은 A. hydrophila subsp. hydrophila를 제외하고 추출 용매로 50% 에탄올 사용 시 75% 에탄올과 유사한 수준의 항균 활성을 나타내었는데, 에탄올 사용량을 줄여 경제적일 수 있다는 점에서 추출 용매로 50% 에탄올을 사용하는 것이 효율적이다 판단되었다.
섹션 3.1.에서 기술한 바와 같이 녹차 잎 분말에는 세포벽 구성성분으로 알려진 cellulose, hemicellulose 및 pectin이 존재하는 것으로 예상되었다. 2차 대사산물인 phytochemical 물질들은 식물 세포 내에서 합성 또는 전환되어 세포 외로 배출된다(Isah, 2019; Liu 등, 2018). 녹차 잎의 세포벽 분해는 이들 물질의 추출 효율을 높일 수 있을 것으로 예상되었고, 분해율을 높이고자 cellulase와 pectinase를 혼합하여 처리하였다.
효소 제조사의 기술 설명에 따르면, 본 실험에 사용된 cellulase의 최적 활성 pH는 6, 온도는 약 52°C이다(Sigma-Aldrich, 2023a). Pectinase는 pH 5.0-6.5, 반응 온도 30-50°C에서 높은 활성을 기대할 수 있는 것으로 나타난다(Omeje 등, 2023). 녹차 분말에 약 12배수 DW를 가하여 균질한 것의 pH는 약 6.5로 나타나 별도의 pH 조절은 하지 않았고, 두 효소의 높은 활성을 기대하기 위해 반응 온도는 50°C로 설정하였다.
일반적인 Saccharomyces sp.는 cellulase를 생산하지 않는 것으로 보고되고 있지만, 양조 및 제빵 산업에서 혐기적인 당 발효를 통해 알코올, CO2 및 향기 성분 생성 목적으로 널리 사용되고 있다(Oh와 Jin, 2020). 본 연구에서의 효모의 사용은 알코올 생성 목적보다는 효모 발효과정 중 일어나는 녹차 잎 phytochemical 물질의 변환과 휘발성 화합물 생성에 주목하였다. 일부 선행 연구에서 Saccharomyces sp. 효모 발효를 통해 생성된 휘발성 물질 등은 다양한 생리활성 효과를 나타낸다고 보고된 바 있고(Park, 2012), Yoon 등(2015)은 블루베리의 착즙액과 효모 발효물의 총페놀화합물과 플라보노이드 함량 및 항산화 효과를 비교한 결과, 효모 발효 후 모두 증가하는 것으로 나타난 바 있다.
녹차 잎을 세포벽 분해 효소로 처리, 효모 발효 또는 효소 처리와 효모 발효를 병행하여 얻은 추출물의 수율과 항산화 활성은 Table 4와 같다. 수율에서는 효소 처리를 단독으로 진행한 Ecp25구가 약 41.2%로 가장 높았고, 대조구인 50% 에탄올 용매 추출(50% EOH-H)구와 효모 발효 단독(SC)구는 각각 26.3%와 28.1%로 나타나 다른 그룹에 비해 유의적으로 낮았다(p<0.05). 반면, 진행 순서와 관계없이 효소 처리와 효모 발효를 병행한 두 그룹의 수율은 앞선 두 그룹에 비해 약 5.3-9.2%가량 높았다. 다르게 말하면, 효소 처리 시 추출물의 수율은 증가되었고, 효모 발효는 수율 변화에 영향을 주지 않았다. 자몽종자추출물(GSE)은 비교물질로 사용되었다. 결과에는 나타내지 않았지만, 효모 발효를 진행한 모든 그룹에서 효모 접종 후 24시간 이내 초기 접종 효모 수 약 5.0 log CFU/mL에서 최대 약 7.2 log CFU/mL로 증가되어, 녹차 잎 분말 이외 다른 영양성분 첨가 없이 균이 잘 증식되는 것을 알 수 있었다(data not shown).
그룹들 사이 최대 DPPH 라디칼 소거활성은 약 85.9-87.7% 범위로 유사한 수준으로 나타났다. 그러나 EC50 값 비교에서 SC구가 가장 낮아 항산화 활성이 가장 우수한 것으로 나타났고, GSE가 가장 높아 항산화 활성이 가장 낮았다. 처리 방법에 따라 효소 처리만 진행할 경우 용매 추출인 대조구에 비해 항산화 활성이 감소하였고, 효모 발효가 병행될 경우 그 활성은 증가되었다.
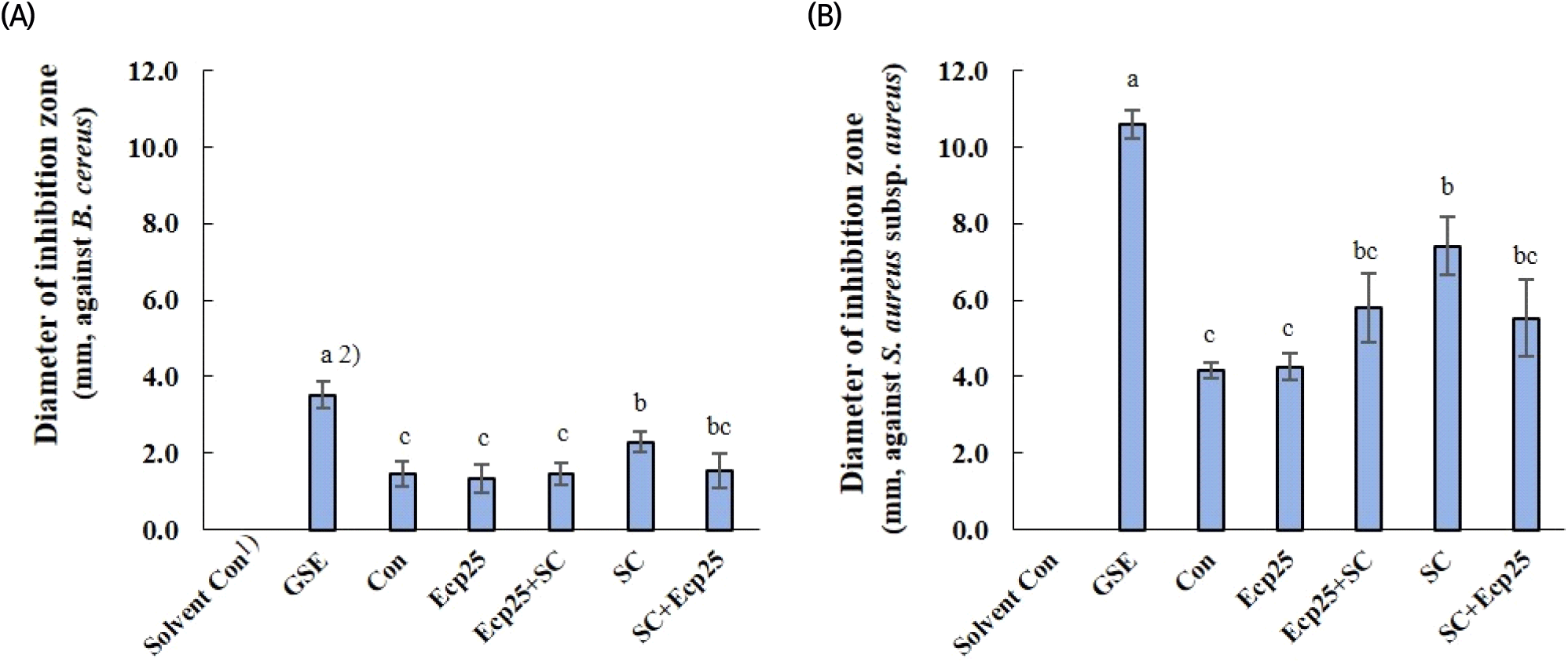
식품일반의 기준 및 규격에 따르면(MFDS, 2023), 위생지표균으로 세균수와 대장균군에 대한 기준이 있고, 식품 특성에 따라 Salmonella sp., Vibrio parahaemolyticus, Listeria monocytogenes, 장출혈성 E. coli, Campylobacter jejuni/coli, Yersinia enterocolitica, B. cereus, Clostridium perfringens, S. aureus 등 식중독 균에 대한 세부 규격이 있다. 녹차 잎 추출물은 B. cereus, B. licheniformis, S. aureus subsp. aureus 및 A. hydrophila subsp. hydrophila에 대해 항균 활성을 나타내었다. 식품 보존료로서의 사용 가능성 평가를 위해 녹차 잎 추출물이 항균 활성을 보인 균종 가운데 식품일반의 기준 및 규격에 고시된 식중독 균인 B. cereus와 S. aureus subsp. aureus를 항균 활성 평가 대상균으로 선택하였다.
녹차 잎을 세포벽 분해 효소로 처리, 효모 발효 또는 효소 처리와 효모 발효를 병행하여 얻은 추출물의 항균 활성 결과는 Fig. 3과 같다. Solvent control로 사용된 50% 에탄올의 두 세균에 대한 저해 활성은 없었다. 녹차 잎 추출물은 시판 자몽종자추출물(GSE)에 비해 평가된 두 세균 모두에서 다소 낮은 항균 활성을 나타내었다. S. aureus subsp. aureus가 B. cereus에 비해 감수성이 높은 것으로 나타났고, 추출물의 활성은 균종에 따라 조금 다른 양상을 보였다. B. cereus에서는 효모 발효 단독으로 진행한 SC구만 용매 추출 대조구에 비해 활성이 높았고, S. aureus subsp. aureus에서는 효소 처리 단독구(Ecp25)를 제외한 다른 그룹 모두에서 그 활성이 증가하였다. 다르게 말하면, 효모 발효 단독으로 진행 시 대조구에 비해 항균 활성이 증가하였으나, 효소 처리를 병행할 경우 처리 순서와 관계없이 효모 발효 단독보다 항균 활성이 감소하였다. 녹차 잎에 존재하는 phytochemical 물질은 catechin, epicatechin, gallocatechin, epigallocatechin, epicatechin gallate, epigallocatechin gallate, gallocatechin gallate, myricetin, caempherol, quercetin, chlorogenic acid, coumarylquinic acid 및 theogallin 등이 있으며, 이 가운데 catechin 유도체들이 주요 항균 물질인 것으로 알려져 있다(Prasanth 등, 2019; Taylor 등, 2005).
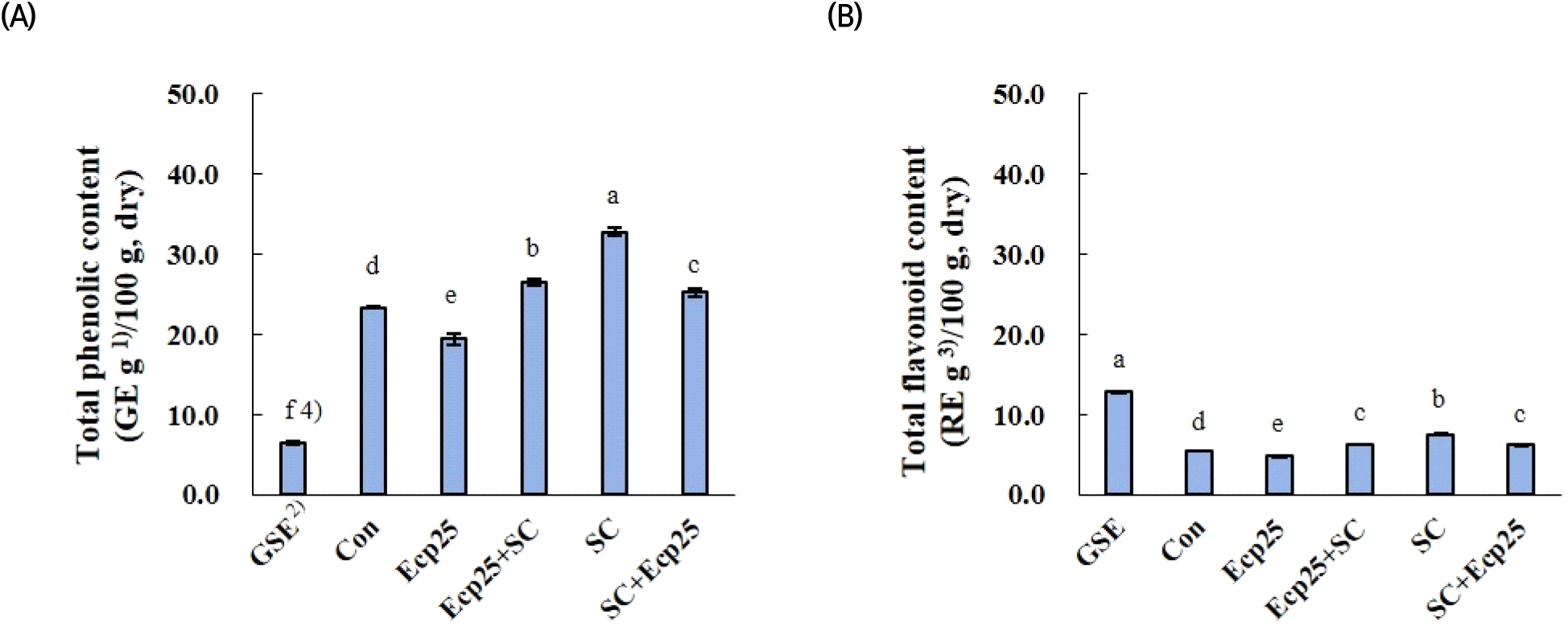
녹차 잎 추출물 내 phytochemical 물질의 양을 예상하기 위해 총페놀화합물과 플라보노이드 함량을 측정하여 Fig. 4에 나타내었다. 이들은 항산화 및 항균 활성과 연관성이 높다고 알려져 있다(Joung 등, 2007). 총페놀화합물 함량에서 녹차 잎 추출물 모두는 GSE보다 유의적으로 높게 나타났고(p<0.05), 이러한 결과는 앞선 항산화 활성 결과(Table 4)와 잘 일치하였다. 플라보노이드 함량에서는 GSE가 가장 높게 나타났고, 세포벽 분해 효소 처리만 진행(Ecp25)할 경우 용매 추출 대조구보다 유의적으로 낮아졌다(p<0.05). 이것은 세포벽 분해 효소 처리로 인해 페놀화합물과 플라보노이드가 감소되었다고 해석하는 것보다, 효소 처리 후 추출물의 수율이 증가된 것에 비추어 볼 때 추출물 내 페놀화합물과 플라보노이드 이외 다른 물질이 늘어난 것에 의한 결과로 예상된다. 효소 처리에 효모 발효를 병행하거나 효모 발효만 진행할 경우 용매 추출 대조구에 비해 총페놀화합물 및 플라보노이드 함량 모두 유의적으로 높아지는 것으로 나타났다(p<0.05). 소재는 다르지만, Ngadze 등(2018)의 보고에 따르면, Strychnos cocculoides juice 착즙 전 열과 pectinase의 처리는 juice의 수율과 페놀화합물 함량을 증가시켜 항산화 활성을 높인다고 보고한 반면, orange 가공부산물로부터 페놀화합물 회수 목적으로 pectinase를 처리할 경우 그 함량이 감소된다는 보고가 있어(Shaharam 등, 2019), 세포벽 분해 효소 처리에 의한 페놀화합물 변화는 재료에 따른 차이가 있었다. 처리 방법에 따른 결과를 요약하면, 세포벽 분해 효소 처리는 녹차 잎 추출물의 수율을 증가시키나 추출물 내 페놀화합물과 플라보노이드의 순도를 낮출 수 있고, 효모 발효는 추출물 내 총페놀화합물 및 플라보노이드 함량을 높이는데 긍정적으로 작용할 수 있는 것으로 나타났다.
4. 요약
본 연구에서는 항산화와 항균 활성 등이 우수한 녹차 잎을 대상으로 관련 물질 회수에 적합한 추출 용매의 농도 설정과 세포벽 분해 효소 처리 및 효모 발효가 활성을 높이는데 도움을 줄 수 있는지 살펴보았다. 입도 약 4-10 μm의 녹차 분말을 사용하여 추출물을 제조할 때, 다양한 에탄올 농도 가운데 50% 에탄올을 추출 용매로 하고 가열 처리(121°C, 15 min)를 진행할 경우 높은 수율과 DPPH 라디칼 소거능 및 항균 활성을 나타내었다. 이 추출물은 B. cereus, B. licheniformis, S. aureus subsp. aureus 및 A. hydrophila subsp. hydrophila에서 항균 활성을 나타내었다. 녹차 잎 분말에 효소 처리 및 효모 발효 진행 시 최종 녹차 잎 추출물의 항산화와 항균 활성에 미치는 영향을 조사하기 위해, 효소 처리에는 cellulase와 pectinase를 혼합(2.5%+2.5%)하여 사용하였고, 효모 발효에는 S. cerevisiae가 사용되었다. 녹차 잎을 효소 처리할 경우 추출물의 수율은 증가되었으나, 50% 에탄올 추출물(대조구)에 비해 항산화와 항균 활성은 유의적으로 감소되었다(p<0.05). 그에 반해 효모 발효를 단독으로 진행할 경우 최종 추출물의 수율 증가는 없었지만, 총페놀화합물과 플라보노이드 함량을 높여 항산화와 항균 활성을 높이는데 긍정적으로 작용하였다.
