1. 서론
대두는 전 세계적으로 경제적 측면에서 중요한 작물로 인식되고 있다. 탄수화물, 지방 및 단백질 등의 필수영양소 함량이 높으며, 특히 단백질 함량은 평균 38.6%(31.6-45.3%)로 함유하여 식물성 단백질의 주요 공급원으로서 우수한 작물이다(Hwang 등, 2020; Vagadia 등, 2017). 그 밖에도 페놀, 식물성 스테롤, 소야사포닌, 이소플라본 등의 다양한 기능성 성분이 포함된것으로 보고되고 있다(Maria John 등, 2016; Rizzo, 2020). 대표적인 생리활성 물질인 이소플라본은 그 형태에 따라 대두에 총 12가지가 있는 것으로 알려져 있다. 기본적으로 aglycones(daidzein, genistein 및 glycitein) 형태에서 당이 결합하여 glucosides(daidzin, genistin 및 glycitin) 형태가 되며 여기에 acetyl 또는 malonyl 그룹이 에스테르화된 acetylglucosides(acetyldaidzin, acetylgenistin 및 acetylglycitin) 및 malonylglucosides(malonyldaidin, malonylgenistin 및 malonylglycitin)가 있다(Ha 등, 2019). 대두 원료에는 대부분 배당체 형태로 존재한다. 그러나 이소플라본의 생물학적 활성은 주로 체내 흡수력이 우수한 비배당체에 의해 얻어진다. 따라서 이소플라본의 약리작용을 향상시키기 위해서는 비배당체 형태로 전환이 필요하다. 섭취 후 장내미생물에 의해서 비배당체 형태로 전환되거나 발효 과정 중 생물전환기술(bioconversion) 즉, 미생물이 생산하는 β-glucosidase 효소에 의해 전환된다(Araújo 등, 2013; Kim 등, 2022). 버섯 균사체를 이용한 생물전환과 관련된 연구로는 송이버섯 균사체를 이용한 콩 발효(Lee 등, 2019) 및 콩잎 발효(Cho 등, 2023)를 통해 이소플라본 전환에 관한 연구, 식용버섯인 찹쌀떡버섯 균사체를 이용한 생물전환 루모라고사리 추출물에 관한 연구(Hong 등, 2023), 기계층 버섯 균사체를 이용한 나물콩 발효물의 휘발성 성분 변화(Kim과 Kim, 2020)에 관한 연구가 보고되고 있다.
식용 버섯은 항산화 물질 및 미네랄이 풍부하여 특히 아시아와 유럽에서 많이 소비된다(Sarikurkcu 등, 2015). 주로 자실체를 이용하며, 최근에는 균사체에 생리활성 물질이 다량 함유되어 있으며 독성이 거의 없는 것으로 보고되어 균사체 이용에 대한 관심이 증가하고 있다(Choi 등, 2010). 이러한 영향으로 최근 눈꽃동충하초(Kim과 Kim, 2018), 차가버섯(Na 등, 2018), 영지버섯(Kim 등, 2023), 송이버섯(Cho 등, 2023) 등의 다양한 버섯 균사체를 이용한 약용작물 및 식용작물 발효를 통해 항산화 활성, 항염증 활성 증가 등의 연구가 보고되었다.
따라서 본 연구에서는 송이버섯(Tricholoma matsutake) 균사체의 생물전환기술을 대두에 적용하여 발효 기간별 고체발효물을 제조하였고, 각 발효 기간 따라 β-glucosidase, 영양성분(지방산 및 유리아미노산), 이소플라본 구성, 항산화 활성 및 소화효소 저해 활성의 변화를 확인하여 최적의 발효 기간을 확인하고, 더 나아가 기능성 식품 소재로서의 활용가능성을 검토하였다.
2. 재료 및 방법
본 연구에 사용된 콩은 농촌진흥청 국립식량과학원으로부터 공급받은 대원콩을 사용하였다. 송이버섯 균사체(Tricholoma matsutake) 평판배양에는 potato dextrose agar 배지(Difco., PDA, Becton, Dickinson and Co., Sparks, MD, USA)를 사용하였고, 액체 배양에는 증류수에 10%(w/v) 쌀을 첨가하여 살균한 쌀배지를 사용하였다. 총 phenolics, 총 flavonoids, 12가지 이소플라본 표준품(daidzin, glycitin, genistin, malonyl-daidzin, malonyl-glycitin, malonyl-genistin, acetyl-daidzin, acetyl-glycitin, acetyl-genistin, daidzein, glycitein 및 genistein), 총 phenolics(TP), 총 flavonoids(TF), 항산화 활성 및 소화효소 저해 활성 측정에 사용된 Folin-Ciocalteu phenol, dietyleneglycol, 2,2'-diphenyl-1-picrylhydrazyl(DPPH), 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), thiobarbituric acid (TBA), trichloroacetic acid(TCA), p-nitrophenyl-β-D-glucopyranoside(p-NP-β-G), p-nitrophenyl-α-D-glucopyranoside(p-NP-α-G), p-nitrophenyl-butyrate (p-NPB) 및 p-nitrophenol(p-NP) 등 대부분의 시약들은 Sigma-Aldrich Co. Ltd(St. Louis, MO, USA)에서 구매하여 사용하였다. 이소플라본 분석 및 추출물 제조에 사용된 water 및 methanol은 HPLC 등급으로 Fisher Scientific International, Inc.(Fairlawn, NJ, USA)에서 구매하여 사용하였다.
발효에 사용한 송이버섯 균사체는 경상국립대학교 목재화학실험실에서 분양받아 PDA 배지에 접종하여 25℃에서 15±5일간 정치 배양하였다. 이후 살균한 쌀배지에 접종하여 25°C에서 5일간 160 rpm으로 진탕 배양하여 균사체 발효 스타터로 사용하였다. 준비된 스타터는 12시간 불려 121°C에서 15분간 살균 처리한 콩에 5%(v/w) 접종하여 살균된 스푼으로 고루 혼합하여 25°C에서 정치시켜 0, 3, 6, 9 및 12일간 발효하였다.
생체중은 각 발효 기간별로 발효가 끝난 즉시 무게를 측정하며, 발효 0일 시료는 살균 처리 후 무게를 측정하였다. 이때 용기 무게와 함께 측정하고, 이후 사전에 기록해 두었던 용기 무게를 제외하여 생체중을 구하였다. 생체중 측정 후 발효물은 각각 동결건조하여 분쇄 후 지퍼팩에 넣어 −70°C에 보관하여 실험에 사용하였다.
β-Glucosidase 활성 측정을 위한 시료 전처리는 건조 시료 20 g에 100 mL(w/v)의 증류수를 첨가하고, 5분간 균질화한 후 이를 13,000 rpm로 4°C에서 10분 원심분리하였다. 상등액을 취하여 0.45 μm syringe filter(Whatman Inc., Maidstone, UK)로 여과 후 Lee 등(2019)의 방법을 변형하여 측정하였다. 준비된 시료는 37°C 항온수조에서 5분간 활성화시켜 준비하였다. 기질 용액은 50 mM sodium phosphate buffer(Na3PO4, pH 7.0)에 5 mM p-NP-β-G가 되도록 제조하였다. 기질 용액과 시료를 각각 0.25 mL 혼합하여 반응(37°C, 20분)시키고, 50 mM sodium carbonate buffer(Na2CO3, pH 7.0) 용액 0.5 mL를 첨가하여 반응을 정지시켜 분광광도계(UV-1800 spectrophotometer, Shimadzu CO., Kyoto, Japan)를 이용해 405 nm에서 흡광도를 측정하였다. 반응 후 분해물의 양은 p-NP 표준곡선으로부터 계산하였으며, 효소 활성 단위 1 unit은 시료 1 g에 의해 1분간 1 μM의 p-NP-β-G가 유리되는 수로 하였다.
송이 버섯 균사체 발효물의 지방산 햠량은 Hwang 등(2019)의 방법에 따라 건조 분말 시료를 메틸에스테르화시켜 gas chromatogram(GC, Agilent 7890A, Boeblingen, Germany)과 SP-2560 capillary column(100 m×0.25 mm×0.20 μm, Supelco, Bellefonte, PA, USA)을 사용하여 분석하였다. 불꽃 이온화 검출 온도는 200°C, 이동상(N2) 유속은 분당 1 mL로 설정하였으며, 주입 온도 및 주입량은 200°C 및 20 μL로 하였다. 오븐 초기 온도는 180°C로 설정 후 230°C까지 분당 4°C 상승시켜 20분간 유지시켰다.
송이버섯 균사체 발효물의 유리아미노산 함량은 Lee 등(2022)의 방법에 따라서 수행하였다. 유리아미노산 분석은 유리아미노산 자동분석기(L-8900, Hitachi, Tokyo, Japan)를 사용하여 분석하였다. 건조된 분말 시료는 10% sulfosalicylic acid를 사용하여 60°C에서 1시간 가수분해시켜 6,000 g으로 15분간 원심분리 후 상등액은 감압농축기를 이용해 농축하였다. 농축물은 pH 2.2의 0.2 N lithium buffer로 적당히 희석하여 최종 0.45 μm Syringe filter로 여과하여 분석에 사용하였다.
동결 건조한 시료를 50% methanol로 30±2°C로 12시간 진탕 추출하여 6,000 rpm으로 30분간 원심분리하여 상등액을 0.45 μm Syringe filter 여과하여 추출물을 제조하였다. 제조한 추출물은 TP, TF, 이소플라본, 항산화 활성 및 소화효소 저해 활성 측정에 사용하였다.
송이버섯 균사체 추출물의 TP 및 총 TF 분석은 Lee 등(2020)의 방법에 준하여 수행하였다.
TP 함량은 추출물과 25% Na2CO3 용액을 1:1로 혼합하여 3분간 반응시켜 Folin-Ciocalteu phenol 시약을 25% Na2CO3 용액 혼합량에 0.5배 첨가하여 30°C에서 1시간 반응 후 750 nm 조건에서 흡광도 값을 확인하였다. TP 함량은 gallic acid equivalent(GAE)를 이용한 표준곡선으로부터 구하였다.
TF 함량은 추출물, diethylene glycol 및 1 N NaOH를 1:2:0.02가 되도록 혼합하여 37°C 항온수조에서 1시간 반응시켜 420 nm 조건에서 흡광도 값을 확인하였다. 이때 TF 함량은 rutin equivalent(RE)을 이용한 표준곡선으로부터 구하였다.
이소플라본 분석은 Lee 등(2020)의 연구방법에 준하여 HPLC로 분석하였다. 분석에 사용된 컬럼은 Lichrophore 100 RP C18(5 μm, 125 mm×4 mm, Merck KGaA, Darmstadt, Germany)이며, 이동상 용매는 0.2% acetic acid(v/v) 함유 water(용매 A)와 0.2% acetic acid(v/v) 함유 acetonitrile(용매 B)로 분석하였다. 분석 조건은 용매 A 기준으로 0-15분에 90%, 25분에 80%, 35분에 75%, 45분에 65%, 50분에 65%로 설정하고, 컬럼 온도 30°C, 시료는 20 μL 주입하였다. 이동상 유속은 분당 1 mL의 유속으로 diode array detector (Agilent 1200 series, Agilent Co., Waldbronn, Germany)를 통과하여 254 nm 조건에서 검출하였다.
DPPH 라디칼 소거 활성은 Cho 등(2023)의 방법에 준하여 측정하였다. 추출물 0.2 mL와 DPPH 시약(0.4 mM, methanol) 0.8 mL를 혼합하여 암실에서 30분 반응 후 525 nm에서 흡광도 값을 확인하였다.
ABTS 라디칼 소거 활성은 측정 전날 ABTS 용액(7.4 mM) 7.5 mL와 potassium persulphate(2.6 mM) 7.5 mL를 혼합하여 암실에서 12시간 반응시켰다. 준비된 ABTS 용액을 methanol(HPLC grade)를 혼합하여 732 nm에서 흡광도 값이 0.80±0.05로 조제된 ABTS 용액과 추출물을 9:1로 혼합하여 3분간 반응시켜 732 nm에서 흡광도 값을 확인하였다(Joo 등, 2018).
Hydroxyl 라디칼 소거 활성은 FeSO4-EDTA 용액(0.01 M) 0.1 mL, 2-deoxylribose(0.01 M) 0.1 mL, 추출물 0.6 mL와 H2O2(0.01 M) 0.2 mL를 혼합하여 4시간 동안 37°C에서 반응시켰다. 반응 후 water(HPLC grade)에 용해시켜 준비한 TBA(1%) 1 mL와 TCA(2.8%)를 1 mL를 가하여 20분/100°C 반응시켜 525 nm에서 흡광도 값을 확인하였다(Cho 등, 2023). 음성대조구는 시료 대신 추출 용매를 사용하여 확인하였다. 항산화 활성은 아래의 식 (1)에 따라 계산하여 나타내었다.
추출물의 α-glucosidase 저해 활성 측정은 Lee 등(2019)의 방법을 응용하여 측정하였다. 효소는 α-glucosidase from Saccharomyces cerevisiae를 사용하였고, 기질은 p-NP-α-G를 사용하여 p-NP 생성량을 측정하였다. 추출물 100 μL, Na3PO4 buffer(0.1 M, pH 6.8) 50 μL, Na3PO4 buffer(0.1 M, pH 6.8)에 용해시켜 제조한 α-glucosidase 100 μL(1.0 U/mL) 및 p-NP-α-G(10 mM) 200 μL를 가하여 혼합한 다음 37°C에서 20분 동안 반응시켰다. 0.1 M NaOH 100 μL를 넣어 반응을 정지시킨 후 405 nm에서 흡광도를 측정하였다. 음성대조군으로 시료 대신 추출 용매를 사용하였고, 반응 후 p-NP 생성량의 표준 곡선으로부터 α-glucosidase의 저해 활성을 측정하였다. α-Glucosidase 저해 활성은 아래의 식(2)에 따라 계산하여 나타내었다.
추출물의 췌장 lipase 저해 활성 측정은 Hwang 등(2019)의 방법을 응용하여 측정하였다. 효소는 lipase from Aspergillus niger를 사용하였고, 기질은 p-NPB를 사용하여 p-NP 생성량을 측정하였다. 추출물 100 μL, Na3PO4 buffer(0.1 M, pH 7.2) 50 μL, Na3PO4 buffer (0.1 M, pH 7.2)에 용해시켜 제조한 췌장 lipase(30 U/mL) 100 μL와 p-NPB(10 mM) 200 μL를 가하여 혼합한 다음 37°C에서 20분 동안 반응시켰다. 0.1 M Na2CO3 100 μL를 넣어 반응을 정지시킨 후 405 nm에서 흡광도를 측정하였다. 음성대조군으로 시료 대신 추출 용매를 사용하였으며, 반응 후 p-NP 생성량의 표준곡선으로부터 췌장 lipase 저해 활성을 측정하였다. 췌장 lipase 저해 활성은 아래의 식 (2)에 따라 계산하여 나타내었다.
3. 결과 및 고찰
송이버섯 균사체를 증자콩에 접종하여 발효 기간별로 발효물의 생체중 및 β-glucosidase 활성을 측정한 결과는 Fig. 1과 같았다. 생체중은 발효 기간이 증가함에 따라 감소함을 보였으나, 유의미한 차이는 없었다. 발효 과정 중 생체중의 감소는 발효 과정 중 수분 증발 및 휘발성 물질의 증산을 통해 소량 감소되는 것으로 판단되며, 까치 버섯을 균사체를 이용한 고체 발효 후 중량이 감소하는 것으로 보고하여 이와 유사한 결과를 보였다(Lee, 2016). 반면 β-Glucosidase 활성은 발효 0일 3.9 unit/g으로 시작하여, 발효 3일(10.61 unit/g)에서 9일(38.89 unit/g)까지 급격한 증가를 보였고, 발효 12일(37.26 unit/g)에는 약간 감소하였다. 발효 0일과 비교하여 발효 3, 6, 9 및 12일 각각 2.7배, 6.5배, 10배 및 9.6배 증가하여 발효 9일에 가장 높은 수치를 보였다.
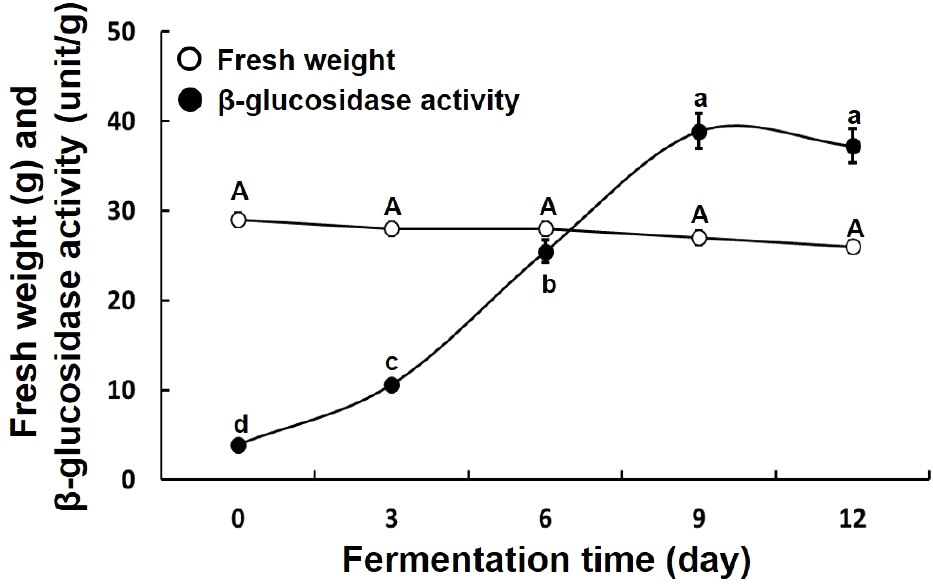
β-Glucosidase는 미생물이나 식물에 널리 분포하고 있는 것으로 알려져 있다(Yang 등, 2015). 이를 바탕으로 발효 기간별 발효물의 β-glucosidase 활성을 확인한 결과, 발효물에서 β-glucosidase 활성을 확인할 수 있었으며, 발효 9일 가장 높은 활성을 보였다. 이러한 결과는 송이버섯 균사체로부터 유래된 β-glucosidase가 9일에 최대치를 나타내는 것으로 판단되었다(Kusuda 등, 2008). β-glucosidase는 β-glucoside bond를 분해시켜 glycoside 형태에서 aglycone 형태로 전환시킨다(Lee 등, 2016). 이에 따라서 β-glucosidase 활성이 가장 높았던 9일차 발효물에서 aglycones 전환이 가장 많이 일어났을 것으로 예상된다. 송이버섯 균사체 발효 중 이러한 β-glucosidase의 증가는 2가지의 영향에 의한 것으로 예상할 수 있었다. 송이버섯 균사체의 성장이 더딘 발효 초기의 경우, 실험 과정 중 대두 수침이나 가열 처리를 통해 대두의 β-glucosidase가 용출되어 증가하였을 수 있으며, 발효 3일 이후에는 균사체 성장에 따라 송이버섯 균사체의 β-glucosidase 생산량 증가에 의한 것으로 판단되었다(Lee 등, 2016).
발효 기간별 송이버섯 균사체 대두 발효물의 지방산 함량을 분석한 결과는 Table 1과 같았다. 총 지방산 함량, 포화 및 불포화 지방산 함량은 발효 기간이 길어짐에 따라 증가하는 경향을 보여, 발효 0일 90.33, 17.79 및 72.54 mg/g에서 발효 12일 130.85, 26.25 및 104.60 mg/g으로 약 1.5배 증가를 보였다. 검출된 포화지방산 중 palmitic acid (13.16, 15.32, 18.07, 19.16 및 20.18 mg/g)가 모든 발효 기간에서 73% 이상 차지하여 주요 포화 지방산으로 확인되었다. 모든 발효 기간에서 불포화 지방산 중 oleic acid와 linoleic acid는 주요 불포화 지방산으로 검출되었으며, 두 지방산의 합은 총 지방산 함량과 불포화 지방산 함량 중 각각 80% 및 99%를 차지하였다.
대두의 대표적인 지방산으로 palmitic(16:0), stearic (18:0), oleic(18:1), linoleic(18:2) 및 linolenic acid (18:3)가 있으며, 한국의 대두 품종 172종의 지방산 함량을 분석한 결과, 포화지방산(palmitic acid 11.1%, stearic acid 3.7%)이 14.8%, 불포화지방산(oleic acid 26.4%, linoleic acid 50.9%, linolenic acid 14.8%)이 84.9%로 보고하였으며(Hwang 등, 2020), 송이버섯 균사체를 이용한 발효 시 대두 발효물의 지방산 함량은 증가하였으나, 총 지방산 함량 중 이러한 주요 지방산의 비율은 대두 원료와 비슷한 결과를 나타내었다. 최근 Lee 등(2019)은 송이버섯 균사체를 이용하여 발아 대두 발효 시 발효 기간에 따라 포화지방산 및 불포화지방산 함량이 증가하는 것으로 보고하여 본 연구와 같은 결과를 보였다. 식품산업에서 세균, 효모 및 진균류로부터 lipase를 획득하여 상업적으로 적용하고 있으며, 진균류의 lipase에 대한 연구는 1950년대부터 이루어졌고, Rhizopus, Aspergillus, Penicillium, Mucor 등 다양한 균류로부터 lipase를 분리하여 산업에 적용되고 있으며, lipase를 생산하는 다양한 버섯 균사체 또한 산업적으로 적용이 가능할 것으로 판단된다. 본 연구에서 송이버섯 균사체 발효 후 지방산 함량 증가를 확인하였고, 이를 통해 송이버섯 균사체의 lipase 생산능을 예측되며, 향후 송이버섯 균사체로부터 lipase를 획득하여 상업적으로 이용이 가능할 것으로 판단된다(Basheer 등, 2011; Costa 등, 2012).
발효 기간별 송이버섯 균사체 대두 발효물의 유리아미노산 함량을 분석한 결과는 Table 2와 같았다. 총유리아미노산 함량은 발효 0일(9.5 mg/g)에서 발효 3일까지 큰 변화를 보이지 않았으나, 발효 6일부터 발효 12일까지 3.1배(29.15 mg/g)에서 8.5배(80.49 mg/g)로 큰 폭의 증가량을 보였다. 비필수 아미노산 중 aspartic acid, serine, glutamic acid, tyrosine 및 arginine이 발효 12일 각각 4.31, 3.51, 8.37, 4.31 및 8.39 mg/g으로 많은 증가량을 보였다. 그 중, glutamic acid와 arginine은 발효 3일 감소하여, 이후 발효 12일까지 점차적으로 증가를 보였다. 필수 아미노산의 경우 특히 leucine, phenylalanine 및 lysine 발효 0일과 비교해 발효 12일 적게는 27배, 많게는 85배 증가하였다(6.87, 7.55 및 11.07 mg/g). 그밖에 필수아미노산 역시 발효 12일째 17배 이상 증가를 보였다.
대두는 단백질이 풍부한 식품으로 발효 시 미생물이 생산하는 효소에 의해 가수분해되어 유리아미노산 함량이 증가되며, 본 연구에서 또한 발효 기간에 따라 유리아미노산 함량의 증가를 확인할 수 있었다. 특히, 체내에서 합성되지 않으며 결핍 시 장애를 유발할 수 있는 필수아미노산(Park 등, 2017) 또한 송이버섯 균사체 발효를 통해 증가함을 확인하였다. 특히 가지사슬 아미노산(branched-chain amino acid, BCAA)인 valine, leucine 및 isoleucine은 발효 기간이 증가함에 따라 유의적인 증가를 보여 발효 12일 발효물은 정상적인 성장, 근육 발달(Hutson 등, 2005), 알코올성 간 손상 예방(Chung 등, 2009), 인슐린 신호전달 및 지질대사 조절(Yao 등, 2016)에 영향을 미칠 것으로 판단된다. 발효 12일 감칠맛 성분이며 정미에 가장 큰 영향을 미치는 것으로 알려진 aspartic acid와 glutamic acid 함량이 발효 0일과 비교해 각각 10배와 2.7배 증가를 보여 송이버섯 균사체 발효 시 발효물의 감칠맛 증가에도 기여할 것으로 판단된다(Guo 등, 2019; Jung과 Roh, 2004; Park 등, 2000). 그 밖에 달콤한 맛에 기여하는 serine, glycine, alanine, threonine, valine 및 lysine의 증가도 확인되었으며, 감칠맛과 단맛을 내는 성분은 발효 0일과 비교해 발효 12일 8.73배(4.23 → 36.91 mg/g) 증가하였다. 한편 tyrosine, arginine, isoleucine, leucine 및 phenylalanine과 같은 쓴맛과 관련된 성분(Guo 등, 2019) 또한 송이버섯 균사체 발효를 통해 성분의 합이 발효 12일에 9.80배(3.04 → 29.8 mg/g) 증가함을 확인하였다. 따라서 송이버섯 균사체 발효 시 균사체에서 유래된 protease에 의해 증가된 유리아미노산은 대두 발효물에 영양적 측면뿐 아니라 감칠맛과 단맛을 부여하여 추후 식품 분야에서 활용성이 높을 것으로 기대된다.
발효 기간별 송이버섯 균사체 콩 발효물의 TP 및 TF 함량을 측정한 결과는 Fig. 2와 같았다. 발효 기간이 증가함에 따라 TP 및 TF 함량은 유의적으로 증가하였다. 특히 발효 3일 이후로 급격한 증가를 보였으며, 발효 12일에는 발효 0일(5.58 GAE mg/g 및 0.36 RE mg/g)에 비해 2.7배(15.09 GAE mg/g) 및 4.4배(1.58 RE mg/g) 증가를 보였다.
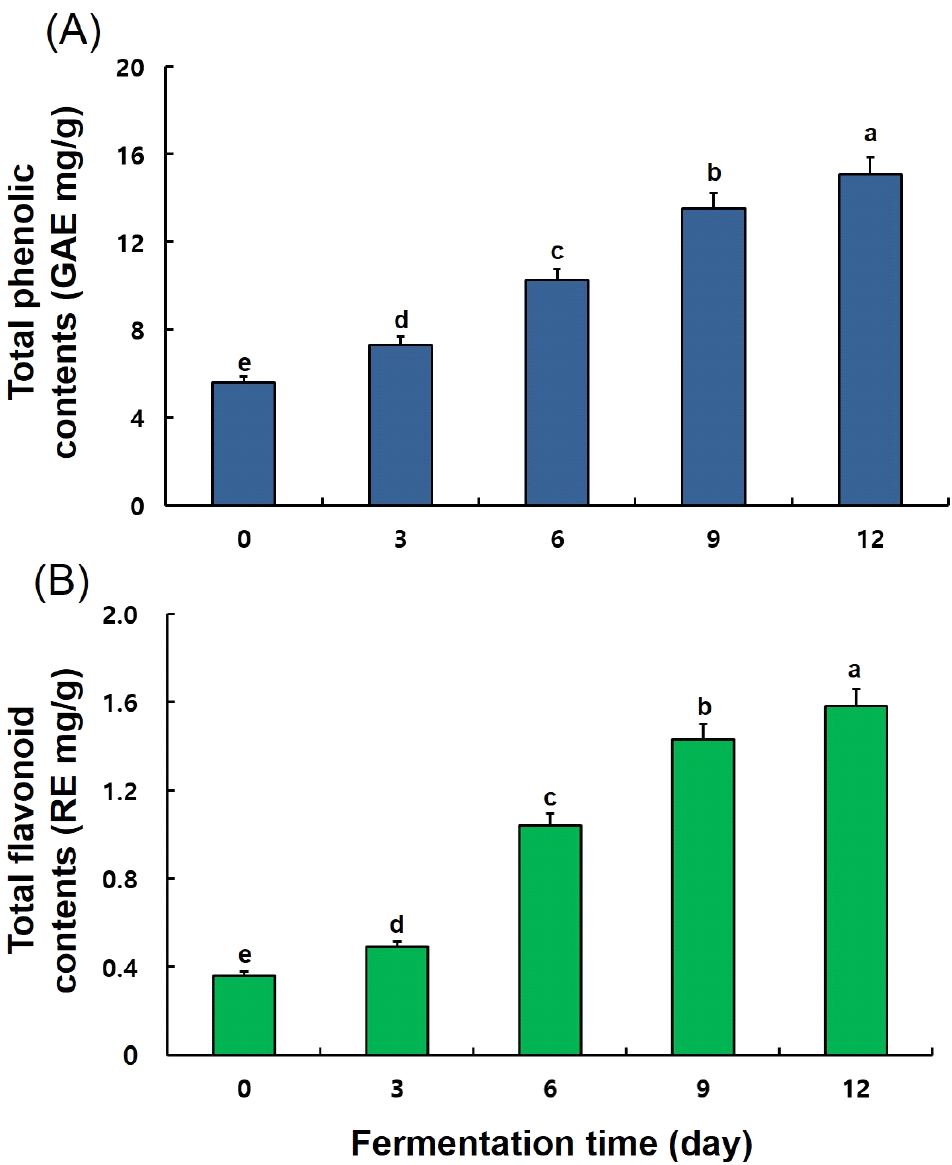
식물체 발효 시 미생물이 분비하는 효소에 의해 식물 세포벽의 다당체가 가수분해되고, 다당체와 결합하고 있는 페놀성 화합물이 유리되어 페놀화합물이 증가한다고 보고되어 송이버섯 균사체 발효를 통해 이와 관련된 TP와 TF 함량의 변화를 확인하였다(Adebo과 Medina, 2020; Cho 등, 2018; Gan 등, 2016). 페놀 화합물은 자유라디칼 소거능을 통해 항산화 활성을 가지며(Sombié 등, 2011), 그 밖에도 항암, 항궤양, 관절염억제 등 다양한 생물학적 효과가 있으며(Sulaiman 등, 2012), 기존의 연구결과, 유산균(Hwang 등, 2018), 고초균(Cho 등, 2011), 그리고 노루궁뎅이버섯균, 수실노루궁뎅이버섯균(Suruga 등, 2020), 영지버섯균, 노랑느타리버섯균(Han, 2022a)과 같은 버섯균을 이용하여 대두 발효 시 폴리페놀과 플라보노이드 함량이 증가한 것으로 보고하였고, 본 연구 결과 또한 발효 후 TP 및 TF 함량이 증가함을 확인하였다. 이러한 결과는 대두 발효 시 송이버섯 균사체가 생산하는 효소가 대두 세포벽의 페놀화합물 복합체에 작용하여 가수분해가 이루어져 TP 및 TF 함량이 증가한 것으로 판단되며, 증가된 TP 및 TF는 발효물의 항산화능에 기여할 것으로 판단된다.
발효 기간별 송이버섯 균사체 대두 발효물의 이소플라본 함량을 분석한 결과는 Table 3, Fig. 3과 Fig. 4와 같았다. 12가지 이소플라본 함량을 분석한 결과, 총 이소플라본 함량은 발효 기간에 따라 감소하였으며(0일: 3,489.41 μg/g → 12일: 1,325.66 μg/g), 이에 상응하여 glycosides(0일: 2,753.87 μg/g → 12일: 212.43 μg/g)와 malonylglycosides (0일: 556.51 μg/g → 12일: 133.04 μg/g) 함량 또한 감소함을 보였다. 이에 반해, aglycones 함량은 발효 3일 감소 후 발효 9일 최대 함량을 보였다(163.03 → 141.27 → 532.09 → 1,074.28 → 962.34 μg/g). 각 발효 기간의 총이소플라본 함량에 대한 glyscosides, malonylglycosides, acetylglycosides 및 aglycones 함량을 비율로 확인한 결과, 발효 0일 78.92, 15.95, 0.46 및 4.67%에서 발효 3일차에는 큰 변화를 보이지 않았다. 발효 6일부터 glyscosides의 비율이 감소하며, aglycones의 비율이 급격하게 증가하여 발효 12일 16.30(glyscosides), 9.44(malonylglycosides), 0.43(acetylglycosides) 및 73.84%(aglycones)로 aglycones 형태의 비율이 가장 높게 확인되었다.
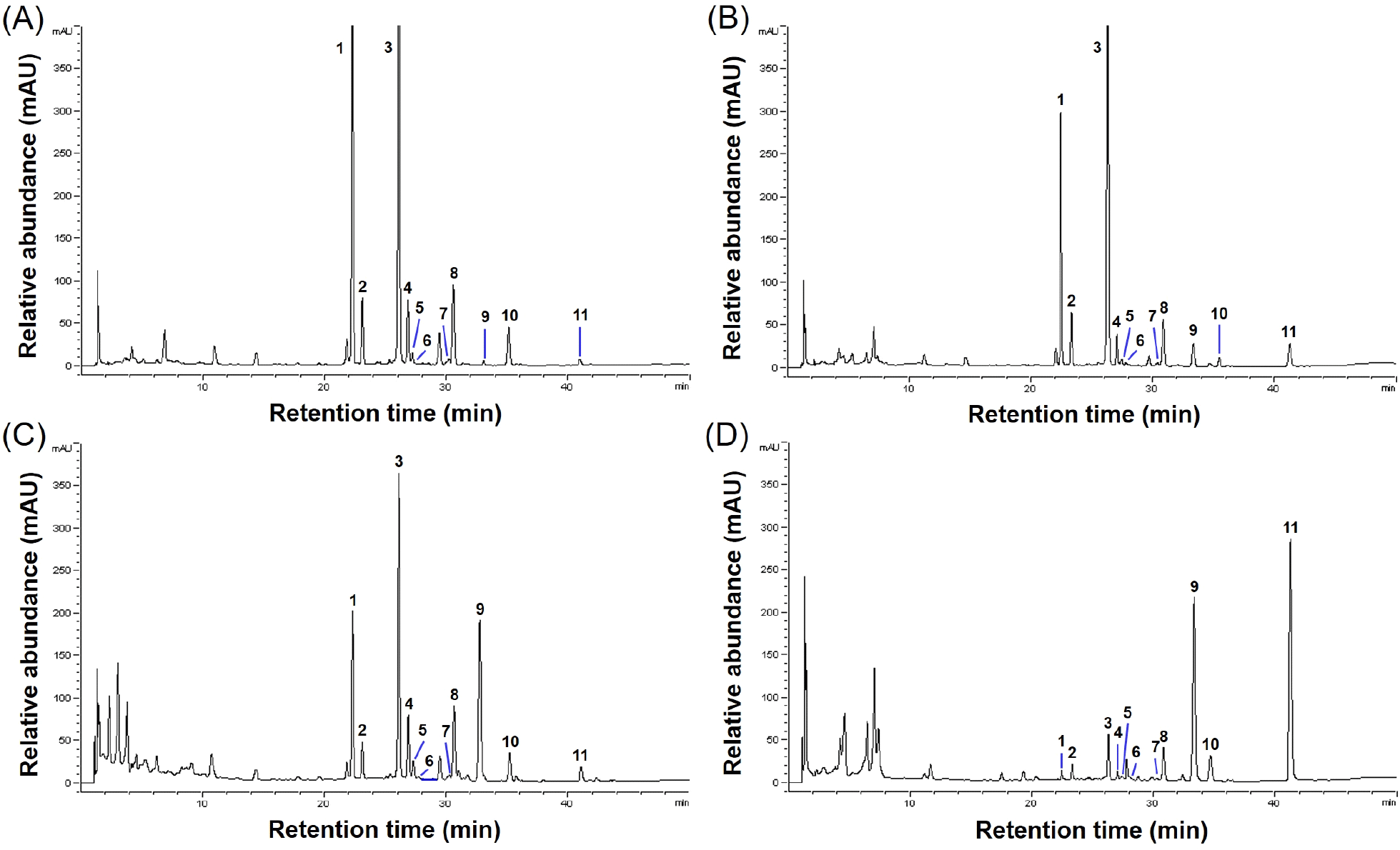
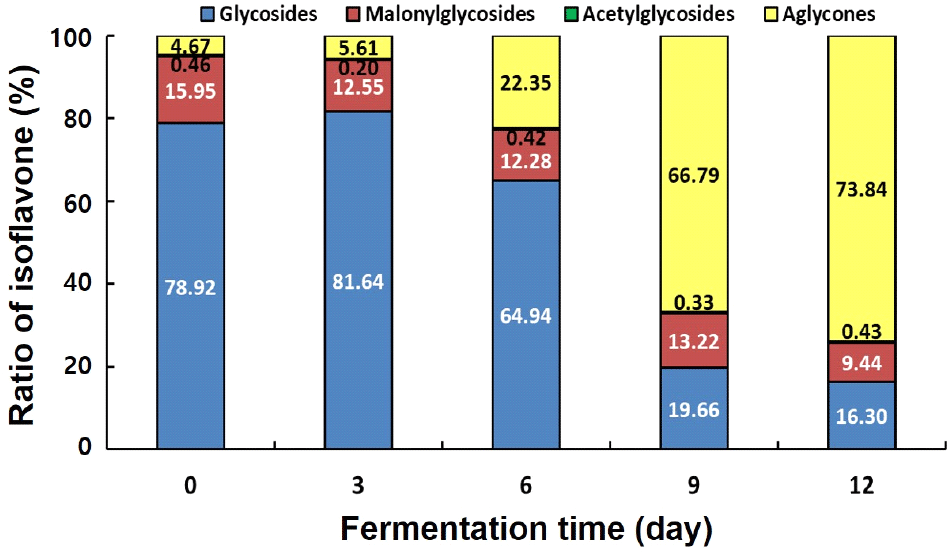
대두의 12가지 이소플라본은 aglycones 〉 glycosides 〉 acetyl glycosides 〉 malonyl glycosides 순으로 항산화력이 우수하며, 특히 daidzein, glycitein 및 genistein는 ABTS 라디칼 소거능이 뛰어난 것으로 보고되어(Kim 등, 2022), 송이버섯 균사체 발효에 따라 증가된 aglycones 함량이 라디칼 소거 활성에 영향을 미친 것으로 판단된다. 발효 초기 aglycones 함량의 증가는 대두 열처리 및 발효 과정 중 증가한 것으로 판단되며(Cao 등, 2019), 특히 발효 12일 송이버섯 균사체 발효물은 glycosides, acetyl glycosides 및 malonyl glycosides와 비교해 생체이용률이 뛰어난 aglycones 함량이 높아 섭취 시 발효 0, 3, 6, 및 9일 발효물에 비해 생체이용율이 우수할 것으로 판단된다(Kim 등, 2022). Han(2022c)은 영지버섯균과 노랑 느타리버섯균을 이용한 두유 발효 시 aglycones 함량이 증가하였으며, 특히 daidzein 및 genistein 함량이 영지버섯균 발효 두유에서 4배-4.4배, 노랑 느타리버섯 발효 두유에서 12-29배 증가하는 것으로 보고하였다(Han, 2022c). 본 연구의 송이버섯 균사체 발효물 또한 daidzein과 genistein 함량이 발효 9일 각각 44배와 37배 증가를 보였고, 이는 β-glucosidase 활성과 같은 경향을 보였으며, 기존의 연구와도 동일한 경향을 보였다. 본 연구에서 송이버섯 균사체를 이용해 대두 발효 시 β-glucosidase 활성에 의해 glycosides 함량은 감소하고 daidzein과 genistein 함량이 증가하는 생물전환을 확인할 수 있었으며, 증가된 daidzein 및 genistein은 대두 발효물의 항산화능에 기여할 것으로 판단된다.
발효 기간별 송이버섯 균사체 대두 발효물의 라디칼 소거 활성을 측정한 결과는 Fig. 5와 같았다. 발효 기간이 증가함에 따라 라디칼 소거 활성은 유의적으로 증가하였지만, 발효 3일까지 DPPH, ABTS 및 hydroxyl(8.06 → 20.92%, 21.94 → 34.17% 및 16.01 → 17.82%)은 큰 변화는 없었다. 발효 3일 이후부터 발효 12일까지 2-3배 증가하였다. 발효 12일 DPPH 71.98%, ABTS 82.08% 및 hydroxyl 52.02%의 소거 활성이 확인되었고, 발효 0일과 비교하여 각각 63.92%, 60.13% 및 36.01% 더 높은 소거 활성을 보였으며, 발효 12일 발효물의 라디칼 소거능은 ABTS 〉 DPPH 〉 hydroxyl 순으로 높게 확인되었다.
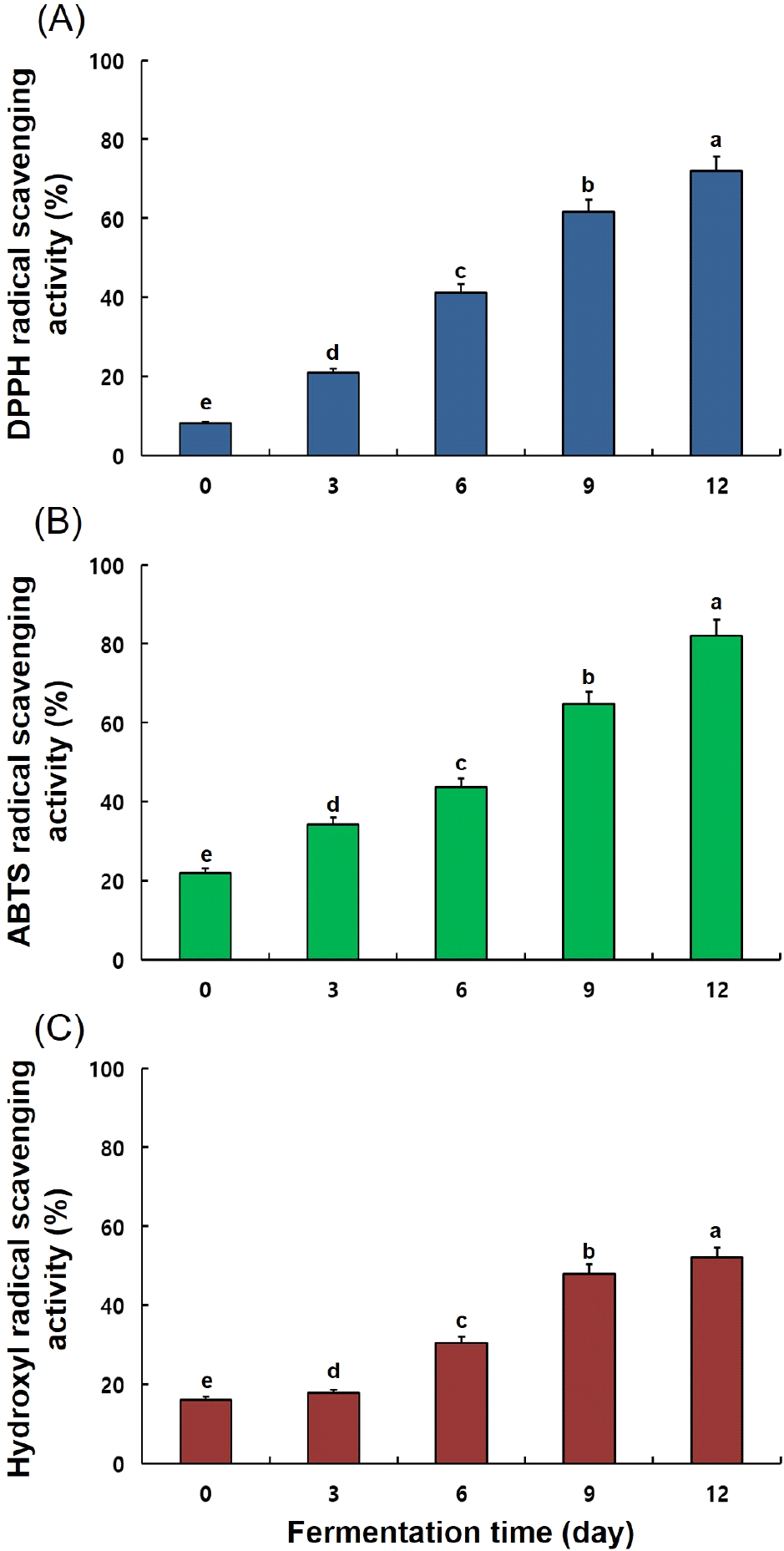
발효 과정 중 TP, TF 및 aglycones 함량이 증가하였으며, 이들은 항산화 활성에 기여하는 것으로 앞선 많은 연구를 통해 알려져 있다(Kim 등, 2022; Rózek 등, 2007). 눈꽃동충하초 균사체 배양, 영지버섯균 대두 발효물, 노랑느타리버섯균 대두발효물, 수실노루궁뎅이버섯균 대두발효물, 노루궁뎅이버섯균 대두발효물 등 다양한 버섯 균사체 발효물에서 폴리페놀, aglycones 증가 시 항산화 활성이 증가함을 보고하였다(Han, 2022b; Kim과 Kim, 2018; Suruga 등, 2020). 따라서 본 연구 또한 TP, TF 및 aglycones 함량의 증가가 항산화 활성에 기여하는 것으로 판단되었다.
발효 기간별 송이버섯 균사체 대두 발효물의 α-glucosidase 및 췌장 lipase 저해 활성을 측정한 결과는 Fig. 6과 같았다. 발효를 진행하지 않은 시료에서는 α-glucosidase 및 췌장 lipase 저해 활성이 10% 이하(6.69%와 1.22%)로 미미한 수준이었으나, 발효 3일 18.46%와 12.34%를 시작으로 발효 기간이 증가함에 따라 유의적으로 증가하여 발효 12일에는 83.49% 및 77.73%로 발효 0일과 비교해 70% 이상 증가를 보였다.
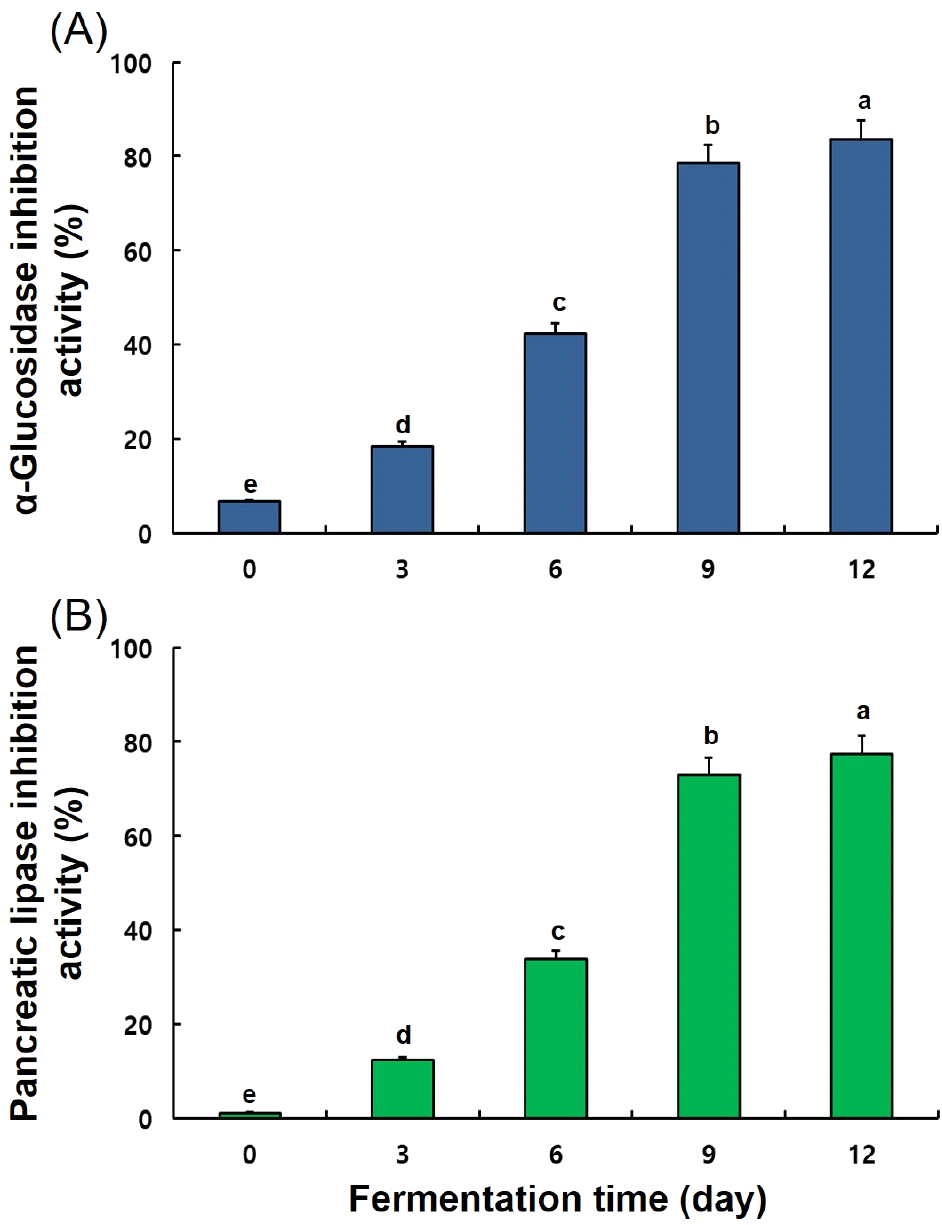
α-Glucosidase는 α(1-4) 결합에 작용하는 소장 점막의 융모에 위치하는 효소이며, 탄수화물 분해 과정의 마지막 단계를 촉매하는 효소로 작용하여 α-D-glucose를 혈액으로 방출한다. 한편 송이버섯 균사체 발효 시 α-glucosidase 억제능이 증가함을 확인하였고 특히, 발효 12일 발효물은 α-D-glucose의 방출을 지연시켜 식후 혈당 상승 억제에 기여할 것으로 판단된다(Lebovitz, 1997; Lee 등, 2014). 발효물의 α-glucosidase 저해 활성 상승은 allosteric site에 결합하여 α-glucosidase와 비경쟁적으로 α-glucosidase를 억제하는 genisetin과 daidzein의 증가에 의한 것으로 판단되며(Ha 등, 2019), 그 밖에 다양한 연구에서 보고되는 genistein과 daidzein의 α-glucosidase 저해 기작에 의한 것으로 판단된다(Kim 등, 2000; Park 등, 2009; Wang 등, 2004). 또한, 대두 잎의 폴리페놀 성분인 coumestrol은 α-glucosidase에 대한 강한 억제력 나타낸다고 보고되어 발효를 통해 증가한 페놀성분 또한 이에 작용하였을 것으로 판단된다(Yuk 등, 2011).
플라보노이드, 페놀산, 리그난, 스틸베노이드, 레스베라트롤 및 프로안토시아니딘을 포함한 다양한 폴리페놀 화합물이 췌장 lipase 저해 활성을 나타내는 것으로 보고되어 있으며, 본 연구 결과 발효 기간이 증가함에 따라 송이버섯 균사체 발효물의 TP 및 TF 증가를 확인하였다(Buchholz과 Melzig, 2015; Goncalves 등, 2010; Park, 2013; Sergent 등, 2012). 이에 따라 발효물의 췌장 lipase 저해 활성 증가를 확인하였으며, 이러한 결과는 폴리페놀 화합물은 소수성 및 수소결합을 통해 단백질과 결합이 가능하여 α-glucosidase뿐만 아니라, lipase와 같은 효소와 강한 복합체를 형성하여 효소 활성 저해가 가능하기 때문이다(Gam 등, 2021; Kim 등, 2012).
췌장 lipase는 중성지방 분해와 소화를 돕는 효소이며, 췌장 lipase 저해 활성이 증가된 송이버섯 균사체 발효물은 혈중 지방 흡수를 저하시킴에 따라 항비만 활성과 췌장을 보호하여 β세포에서 규칙적인 인슐린 생산을 회복하는데 기여할 것으로 판다된다(Tushuizen 등, 2007; Yang 등; 2014; You 등, 2012). 따라서 송이버섯 균사체 발효를 통해 daidzein, genistein, TP 및 TF 함량의 유의미한 증가를 보였고, 이에 상응하여 α-glucosidase 및 췌장 lipase 저해 활성이 발효 기간에 따라 증가하여 발효 12일에 가장 높게 나타난 것으로 판단된다.
이에 따라, 송이버섯 균사체를 이용한 대두 발효물은 발효가 진행됨에 따라 기능성 및 유리아미노산 증가, aglycones, TP 및 TF 함량의 증진이 확인되었다. 또한, 항산화 활성 및 소화효소 저해 활성의 증가를 확인하여 송이버섯 균사체 대두 발효물은 기호성이 증진된 기능성 식품 원료로서 및 가공 식품 원료로 활용될 가능성이 클 것으로 판단된다.
4. 요약
본 연구에서는 송이버섯 균사체를 이용한 대두의 고체 발효 기간 중 β-glucosidase 활성, 유리아미노산, 지방산, 이소플라본 함량 및 항산화 활성과 소화효소 저해 활성 변화에 대해서 확인하였다. 발효 기간 중 β-glucosidase 활성은 증가하여 발효 9일 38.89 unit/g으로 최대치를 보였으며, 이에 상응하여 aglycones 함량이 발효 9일 최대 함량을 보였다(0일: 163.03 μg/g → 9일: 1,074.28 μg/g). 특히 daidzein과 genistein 함량은 발효 9일 43.90배(511.49 mg/g)와 37.04배(460.86 mg/g) 증가를 보였다. 총지방산 함량과 총유리아미노산 함량은 발효 12일 130.85 mg/g 및 80.47 mg/g으로 가장 높았다. 특히 유리아미노산 중 필수아미노산인 발효 0일과 비교해 발효 12일 BCAA는 36.82배(0.34 → 12.52 mg/g) 증가하였으며, 감칠맛(aspartic acid 및 glutamic acid)과 단맛(serine, glycine, alanine, threonine, valine 및 lysine)과 관련된 성분의 합은 8.73배(4.23 → 36.91 mg/g) 증가하였다. TP 및 TF 함량은 발효 기간에 따라 증가하여 발효 12일 2.7배(15.09 GAE mg/g) 및 4.4배(1.58 RE mg/g) 증가를 보였다. 항산화 활성 성분의 경향과 마찬가지로 DPPH, ABTS 및 hydroxyl 라디칼 소거 활성 또한 발효 12일 가장 높은 함량을 보였으며, ABTS(82.08%) 〉 DPPH(71.98%) 〉 hydroxyl(52.02%) 순으로 높게 확인되었다. α-Glucosidase 및 췌장 lipase 저해 활성은 폴리페놀 화합물에 영향으로 발효 12일 83.49%와 77.73%로 발효 기간 중 가장 높은 저해 활성을 나타내었다. 본 연구 결과, 9일에서 12일 발효 시 발효물의 영양 성분, 항산화 물질, 항산화 활성 및 소화효소 저해 활성이 우수하였으며, 송이버섯 균사체를 이용한 대두 발효물이 기능성 식품 또는 기능성 식품 원료로 활용성이 높을 것으로 판단된다.
