1. 서론
알코올은 오랜기간 동안 섭취되어 온 음료로서, 알코올에 대한 내성과 의존성으로 인하여 그 소비량은 매년 증가할 것으로 전망되고 있다(Cargiulo, 2007). 알코올은 섭취 시 알코올성 간염, 간경화, 고혈압, 심혈관 질환, 신경 장애, 지방간 등과 같은 질환의 발병률을 높이며 관련 질환자 및 사망자 수 또한 증가하는 추세이다(Seo, 2008; WHO, 2010). 섭취된 에탄올은 위장관에서 대부분 흡수되며, 흡수된 에탄올은 간에서 주로 분해되어 다양한 대사 과정을 통해 제거된 다(Rajendram 등, 2013; Zakhari, 2006). 에탄올 대사를 담당하는 주요 효소는 알코올 탈수소효소(alcohol dehydrogenase, ADH)와 알데하이드 탈수소효소(aldehyde dehydrogenase, ALDH)이며, ADH에 의해 acetaldehyde로 분해되고, 분해된 acetaldehyde는 ALDH에 의해 무독성의 acetic acid로 분해된다(Klyosov, 1996). 특히, 이러한 과정 중 생성되는 acetaldehyde는 reactive oxygen species(ROS)의 생성을 초래하며, 간의 항산화 시스템의 균형을 무너뜨려 산화적 스트레스를 유발하고 그 결과 DNA 파괴, 지질과산화, 미토콘드리아 기능 저하 등과 같은 간 기능 장애를 일으킨다(Choi 등, 2014; Kim 등, 2008). Zhao 등(2018)의 연구에서는 알코올을 섭취시킨 마우스의 간에서 malondialdehyde(MDA) 수준은 크게 증가하였고 heme oxygenase-1(HO-1), superoxide dismutase (SOD), catalase(CAT), glutathione(GSH) 등과 같은 체내 항산화제의 수준은 유의적으로 감소하여 생체 내 항산화 체계의 불균형 초래와 nuclear factor-κB(NF-κB), cyclooxygenase-2(COX-2), tumor necrosis factor-α(TNF-α) 및 interleukin-6(IL-6)와 같은 염증 및 세포사멸과 관련된 인자의 발현을 증가시켰다(Zhao 등, 2018). 또한, Liu 등(2014)은 에탄올을 섭취시킨 마우스의 혈청에서 alanine aminotransferase(ALT)와 aspartate transaminase (AST)의 수준을 유의적으로 증가시키고, 국소적인 간 손상, 괴사 및 액포 변성을 일으키는 것으로 보고하였다(Liu 등, 2014). 이와 같이 알코올은 체내 섭취 시, 간 조직에 손상을 주어 간경변, 간염 등과 같은 알코올성 간 질환을 일으키거나 두통, 메스꺼움과 같은 숙취를 유발하기 때문에, 숙취 해소와 간 보호 효과 및 산화방지제 역할을 하는 소재 섭취의 필요성이 대두되고 있으며, 이와 관련된 천연 식품 소재의 연구가 필요한 실정이다.
산마늘(Allium ochotense Prokh.)은 백합과에 속하는 다년생 식물로서 8-20°C의 서늘한 조건에서 해발 800 m 이상의 지리산, 오대산, 설악산, 고산지대와 울릉도의 서늘한 지역에 주로 자생한다(Kim 등, 2010). 산마늘의 잎에는 kaempferol, quercetin, astragalin 등과 같은 플라보노이드와 ferulic acid와 같은 페놀성 화합물이 풍부하게 함유되어 있는 것으로 보고되고 있다(Lee 등, 2007; Woo 등, 2012). 특히, Lee(2014)의 연구에서, lipopolysaccharide (LPS)에 노출된 랫트와 raw 264.7 세포에서 산마늘 추출물은 염증성 사이토카인과 TNF-α의 수준을 낮추는 등 항염증 효과를 보고하였고, Ku와 Kim(2010)에 따르면, 산마늘 메탄올 추출물은 고지방식이를 섭취한 마우스에서 간과 신장의 손상을 유의적으로 감소시켰으며, 생체 내 항산화 방어체계를 보호한다고 보고하였다(Ku와 Kim, 2010; Lee, 2014). 하지만, 산마늘 추출물의 항산화 활성과 알코올 대사 관련 효소 및 간 세포 보호 효과에 대한 연구는 상대적으로 미비한 실정이다. 따라서 본 실험에서는 산마늘 추출물의 항산화 활성, ADH, ALDH 활성 및 알코올로 유도된 스트레스에 의한 간 세포 보호 효과를 확인하여, 산마늘의 기능성 식품 소재로서의 활용 가능성을 확인하고자 하였다.
2. 재료 및 방법
본 실험에 사용된 시약인 Folin & Ciocalteu’s phenol reagent, Na2CO3, gallic acid, NaOH, diethylene glycol, rutin, sodium phosphate buffer, 2,2’-azinobis(3-ethyl benzothiazoline-6-sulfonic acid(ABTS), potassium persulfate, 1,1-diphenyl 2-picrylhydrazyl(DPPH), sodium acetate buffer, HCl, 2,4,6-tri(2-pyridyl)-1,3,5-triazine(TPTZ), FeCl3, ascorbic acid, trichloroacetic acid, thiobarbituric acid, ascorbic acid, catechin, tris HCl buffer, ethyl ethanol, acetaldehyde, 2-mercaptoethanol, nicotinamide adenine dinucleotide (NAD) 2’,7’-dichlorofluorescin diacetate(DCF-DA), 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT), mininmum essential medium(MEM), dimethyl sulfoxide(DMSO)는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였으며, 그 외 사용된 용매 및 시약은 모두 1급 이상의 등급을 사용하였다.
산마늘(A. ochotense Prokh.)은 5년산 울릉산마늘 종묘로 구매한 것을 경상남도 산청군 재배 농가(경상남도 산청군 차황면 철수리 산 54, 위경도 35°25′45″N 127°57′26″E)에서 식재 10년 차로 재배된 것을 경상남도 산림환경연구원(Jinju, Korea)으로부터 제공받아 사용하였다. 동결건조된 산마늘을 분쇄한 뒤 추출 용매와 혼합한 후 물, 20%, 40%, 60%, 80%, 및 95% 에탄올로 40°C에서 2시간 동안 환류 냉각장치를 이용하여 추출하였다. 이 추출물을 여과지를 통해 여과한 다음 진공 농축기(N-N series, Eyela Co., Tokyo, Japan)로 농축한 후, 동결건조(FDU-8612, Operon, Gimpo, Korea)하여 실험에 사용하였으며, 사전 연구를 통한 추출 수율, 항산화 활성, 알코올 대사 관련 효소 활성 및 세포 생존율 등을 종합적으로 고려하여 물과 60% 에탄올 추출물을 실험에 사용하였다(Data not shown).
총페놀성 화합물 함량은 시료와 3차 증류수를 혼합하고 Folin-Ciocalteu’s phenol reagent를 혼합하여 실온에서 5분 동안 반응시켰다. 반응용액은 7% Na2CO3 용액과 혼합한 후 3차 증류수를 이용하여 25 mL로 정용하였다. 이후, 상온에서 2시간 동안 혼합용액을 반응시키고 분광광도계(UV-1800, Shimadzu, Kyoto, Japan)를 이용하여 760 nm에서 흡광도를 측정하였다. 측정된 흡광도는 갈산을 사용하여 시료와 같은 방법으로 작성된 보정선으로 총폴리페놀 함량을 계산하고, 이를 갈산 당량(mg of GAE/g)으로 나타내었다(Abeysinghe 등, 2007).
총플라보노이드 함량 측정은 시료에 diethylene glycol과 NaOH를 혼합한 후, 30°C에서 60분 동안 반응시키고 420 nm에서 흡광도를 측정하였다(UV-1800, Shimadzu). 측정된 흡광도는 루틴을 사용하여 시료와 같은 방법으로 작성된 보정선으로 총플라보노이드 함량을 계산하여, 이를 루틴 당량(mg of RE/g)으로 나타내었다(Abeysinghe 등, 2007).
ABTS 용액은 150 mM NaCl을 포함한 100 mM sodium phosphate buffer(pH 7.4)에 2.45 mM ABTS와 1.0 mM[2,2’-azobis-(2-amidinopropane)-HCl](AAPH)를 혼합하여 68°C의 항온수조에서 30분간 가열한 뒤, 실온에서 10분 동안 냉각한 후 만들어진 ABTS 용액을 734 nm에서 흡광도값이 0.70±0.02가 나오도록 3차 증류수를 이용하여 조정하였다. 시료에 ABTS 용액을 혼합하여 37°C에서 10분 동안 반응시키고, 734 nm에서 흡광도를 측정하여 라디칼 제거 활성을 측정하였다(UV-1800, Shimadzu) (Blois, 1958).
DPPH 라디칼 소거 활성은 80% 메탄올에 0.1 mM DPPH를 용해하여 517 nm에서 흡광도값이 1.00±0.02가 되도록 희석하였다. 시료 용액에 흡광도값을 맞춘 DPPH 용액 1.45 mL를 가하여 30분간 암실에서 반응시킨 후 517 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다(Blois, 1958).
FRAP 용액은 300 mM sodium acetate buffer(pH 3.6)와 40 mM HCl이 포함된 10 mM TPTZ 혼합용액과 20 mM FeCl3을 일정한 비율로 배합하여 37°C에서 15분간 반응시켜 제조하였다. 시료 50 μL에 만들어진 FRAP 혼합용액 1.5 mL를 가하여 실온에서 30분간 반응시킨 다음 593 nm에서 흡광도(UV-1800, Shmadzu)를 측정하였다(Benzie와 Strain, 1996).
마우스 뇌 조직을 이용한 지질과산화물 생성 억제 활성을 측정하기 위해 1주간 사육한 4주령의 수컷 Institute of Cancer Research(ICR) 마우스를 실험동물 공급업체(Samtako, Osan, Korea)로부터 구입하여 항온(22±2°C), 항습(50-55%)을 유지하며, 12시간 간격으로 낮과 밤을 교대시키는 환경에서 충분한 식수와 사료를 공급하여 사육하였다. 상기 환경에서 사육한 ICR 마우스를 CO2를 이용하여 희생시킨 후, 뇌를 적출하여 조직무게의 10배에 해당하는 20 mM tris HCl buffer(pH 7.4)를 첨가하여 균질화시켜 원심분리(12,000 ×g, 15분, 4°C)하여 얻어진 상층액을 시험에 사용하였다. 뇌 조직 상층액 0.1 mL, 10 μM FeSO4 0.1 mL, 0.1 mM ascorbic acid 0.1 mL 및 시료 0.2 mL를 혼합하여 37°C에서 1시간 동안 반응시켰다. 이후 반응용액에 30% trichloroacetic acid 0.1 mL와 1% thiobarbituric acid 0.3 mL를 첨가하여 80°C 항온수조에서 20분 동안 가열한 후, 원심분리를 이용하여 얻은 상등액을 532 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다(Chang 등, 2001). 본 동물실험은 경상국립대학교 동물윤리심의위원회 승인을 거쳐 진행하였다(경상국립대학교 동물실험 인가번호: GNU-220429-M0042, 승인일: 2022.04.29).
시료 50 μL를 20 mM NAD 20 μL, 증류수 400 mL, 1 M tris buffer(pH 8.8) 300 μL, 0.2 M ethanol 100 μL와 혼합한 뒤 25°C에서 10분간 반응시키고, 반응액을 5 units/mL ADH 50 μL와 반응한 뒤 microplate reader (Epoch 2, BioTek Instruments Inc., Winooski, VT, USA)를 이용하여 340 nm에서 흡광도를 측정하였다(Bergmeyer, 1974).
시료 30 μL를 20 mM NAD 20 μL, 증류수 400 mL, 1 M tris buffer(pH 8.0) 80 μL, 0.1 M acetaldehyde 20 μL, 3 M KCl 20 μL, 0.33 M 2-mercaptoethanol 20 μL와 혼합한 뒤 25°C에서 10분간 반응시키고, 반응액을 1 units/mL ALDH 10 μL와 반응한 뒤 microplate reader(Epoch 2, BioTek Instruments Inc.)를 이용하여 340 nm에서 흡광도를 측정하였다(Son 등, 2019).
HepG2 세포주(한국세포주은행, Seoul, Korea)는 10% fetal bovine serum(FBS), 50 units/mL penicillin 및 100 μg/mL streptomycin이 포함된 MEM 배지에 배양하여 37°C, 5% CO2 조건에서 배양하여 실험에 사용하였다.
HepG2 세포를 1×104 cells/well 농도로 분주하고 24시간 동안 배양한 뒤 시료와 양성대조군을 처리한다. 3시간 후 500 mM의 에탄올을 처리하고 24시간 동안 추가 배양한다. 이후 MTT 시약(5 mg/mL)을 처리하여 37°C에서 3시간 배양시킨 다음 배양액을 제거한 뒤, DMSO를 첨가한 후 microplate reader(Epoch 2, BioTek Instruments Inc.)를 이용하여 570 nm (determination wave)와 655 nm(reference wave)에서 측정하였다(Heo 등, 2001).
HepG2 세포를 1×104 cells/well 농도로 black 96-well plate에 분주하고 24시간 동안 배양한 뒤 시료와 양성대조군을 처리하였다. 3시간 후 500 mM의 에탄올을 처리하고 24시간 동안 추가 배양하였다. 이후 DCF-DA 시약(24.36 μg/mL)을 처리하여 50분간 배양시킨 다음, fluorometer (Infinite F200, TECAN, Mannedorf, Switzerland)를 이용하여 485 nm 들뜸 파장 및 535 nm 방출 파장의 형광을 측정하였다(Heo 등, 2001).
알코올을 처리한 HepG2 세포를 이용하여 세포사멸에 관여하는 단백질의 발현을 측정하였다. HepG2 세포는 시료 및 알코올을 처리한 후 1% protease inhibitor가 함유된 RIPA buffer에 넣어 homogenization한 뒤, 13,000 ×g에서 원심분리하여 상등액을 얻고, 동일한 단백질 함량이 되도록 맞춘 후 이를 sodium dodecyl sulfate-polyacrylamide gel(SDS-PAGE)을 통해 단백질을 분리하여, polyvinylidene difluoridemembrane(Milipore, Billerica, MA, USA)으로 이동시킨 후 5% skim milk를 이용하여 blocking 하였다. 이후, 4°C에서 12 h 동안 1:2,000으로 희석한 1차 항체와 반응시킨 후, 1:2,500으로 희석한 2차 항체(Santa Cruz Biotechnology Inc., CA, USA)와 1시간 동안 반응시킨 membrane을 ProNA™ ECL Ottimo(TransLab, Daejeon, Korea) 용액과 반응시켜 iBrightTM CL1000 Imaging System(iBright Imager, Thermo Fisher, Waltham, MA, USA)을 이용하여 세포사멸 관련 인자인 B-cell lymphoma(BCl-2)와 BCl-2 associated X(BAX)의 발현을 측정하였다.
3. 결과 및 고찰
산마늘의 물과 60% 에탄올 추출물의 항산화 활성 결과는 Table 1과 같다. 산마늘 추출물의 총페놀성 화합물 함량은 물과 60% 에탄올 추출물에서 각각 22.22 mg of GAE/g, 18.98 mg GAE/g의 함량을 나타내었고 물과 60% 추출물의 총플라보노이드 화합물 함량은 각각 12.31 mg RE/g, 24.49 mg of RE/g의 함량을 나타내었다. 산마늘 추출물의 ABTS 라디칼 소거활성을 측정한 결과 5,000 μg/mL에서 물 추출물에서는 67.85%, 60% 에탄올 추출물에서 60.43%를 나타내었고, DPPH 라디칼 소거활성을 측정한 결과, 10,000 μg/mL에서 물 추출물에서는 23.74%, 60% 에탄올 추출물에서는 39.85%의 DPPH 라디칼 소거 활성을 나타내었다. 양성대조군으로는 ascorbic acid를 사용하였으며, ABTS, DPPH 라디칼 소거활성에서 ascorbic acid는 200 μg/mL 농도에서 각각 86.75%, 78.69%이었다(Data not shown). 각각 산마늘 추출물의 철의 환원능력을 측정한 결과, 10,000 μg/mL에서 물 추출물에서는 0.69의 철 환원력을, 60% 에탄올 추출물의 철 환원력은 0.82를 나타내었다. 양성대조군으로는 ascorbic acid를 사용하였으며, 철의 환원능력은 100 μg/mL에서 1.03이었다(Data not shown). 산마늘 추출물의 지질과산화물 생성억제 능력을 측정한 결과, 10,000 μg/mL에서 물과 60% 에탄올 추출물이 각각 63.92%, 59.56%의 지질과산화물 생성억제 활성을 나타내었다. 양성대조군으로는 catechin을 사용하였으며, 50 μg/mL 농도에서 70.97%의 억제활성을 나타내었다(Data not shown).
산마늘에는 ferulic acid와 같은 페놀성 화합물과 quercetin, kaempferol 및 astragalin 등과 같은 플라보노이드 화합물이 존재하며, 이들은 항산화, 전 염증성 사이토카인의 감소, 및 항염증과 같은 다양한 생리활성을 지닌 것으로 알려져 있다(Lee 등, 2007; Plumb 등, 1999). 또한, 이들 생리활성물질은 자유라디칼 소거, 킬레이트 반응, 산화효소 활성화 및 산화효소 억제를 통해 산화적 스트레스를 억제하는 것으로 보고되고 있으며, Shokoohinia 등(2015)의 연구에서는 quercetin 배당체가 H2O2로부터 유발된 산화적 스트레스로부터 PC12 세포를 보호하는 것을 밝혔다(Heim 등, 2002; Shokoohinia 등, 2015). 더불어, Liao 등(2016)의 연구에서는 2,2’-azobis(2-amidinopropane) dihydrochloride(AAPH)를 처리한 적혈구에서 kaempferol을 처리하였을 때, 적혈구의 지질과산화 및 용혈작용을 효과적으로 억제시키고, HepG2 세포에서 ROS의 함량을 유의적으로 감소시켰다(Liao 등, 2016). 위와 같은 항산화 능력은 산마늘에 함유된 다양한 페놀성 화합물 및 플라보노이드 화합물에 의한 것으로 판단되며, 산마늘 추출물은 포함된 생리활성물질들에 의한 항산화 능력을 바탕으로 향후 고부가가치 식품의 소재로서 이용될 수 있을 것이다.
산마늘의 물 및 60% 에탄올 추출물이 가지는 알코올 대사 관련 효소인 ADH와 ALDH의 활성을 측정한 결과는 Fig. 1(A), 1(B)와 같다. 산마늘 추출물을 처리하였을 때, ADH의 활성은 농도 의존적으로 증가하는 경향을 보였으며, 500 μg/mL 농도에서 물 추출물과 60% 에탄올 추출물은 각각 대조군(100%) 대비 205.83%, 192.34%로 ADH의 활성을 증가시켰다. 물 추출물, 60% 에탄올 추출물의 EC50은 각각 95.90 μg/mL, 106.23 μg/mL로 우수한 생리활성을 나타내었으며, 산마늘 물 추출물이 60% 에탄올 추출물에 비해 다소 우수한 활성을 보였다(Fig. 1(A)). 반면, ALDH의 활성은 농도에 따른 차이를 크게 나타내지 않았다(Fig. 1(B)).
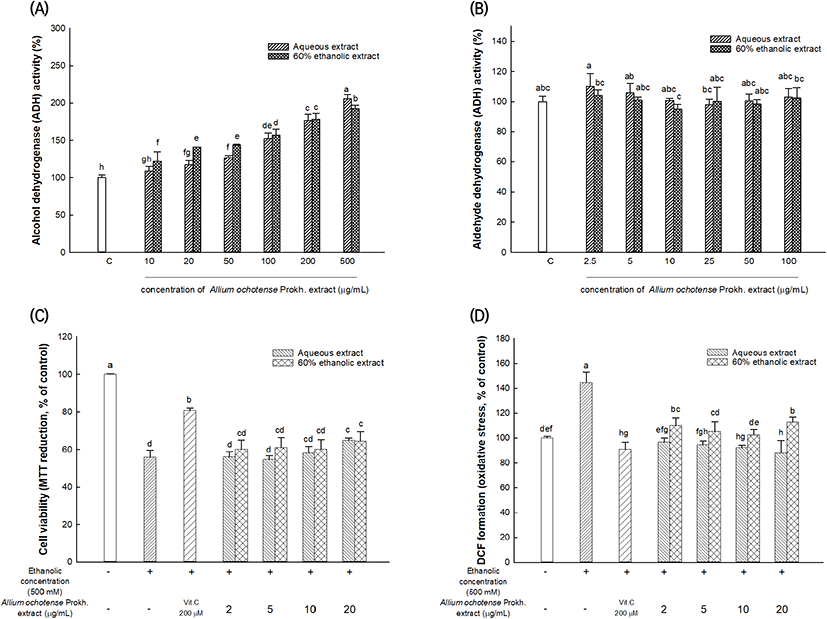
섭취된 알코올은 ADH와 ALDH의 효소작용에 의해 알코올은 acetaldehyde로, acetaldehyde는 무독성의 acetic acid로 분해된다(Zakhari, 2006). 알코올 대사 과정 중 생성된 aldehyde는 두통, 구토 등과 같은 숙취 증상과 미토콘드리아 기능 저해로 인한 간 기능 저하가 보고되었다(Helander와 Tottmar, 1988). 따라서 숙취 해소 및 간 기능 개선을 위한 인체 내 알코올 및 acetaldehyde의 빠른 분해는 필수적이다. 사전 연구를 통해 산마늘의 구성 아미노산 중 arginine이 풍부하게 함유되어있는 것을 확인하였고(Data not shown), Cha 등(2009)의 연구에서 arginine, methionine 및 threonine 같은 아미노산은 ADH의 활성을 증가시켰으며, arginine의 섭취는 에탄올을 투여한 랫트에서 간 섬유화와 지질과산화를 억제시켰으며, TNF-α, COX-2, NF-κB 등의 염증성 인자의 발현을 감소시켰다(Cha 등, 2009; Nanji 등, 2001). 본 실험 결과에서, 산마늘 추출물에 풍부하게 함유되어있는 아미노산은 알코올 대사 관련 효소의 활성에 도움을 준 것으로 판단된다.
알코올로 유도된 세포독성에서 간 세포(HepG2 cells)에 대한 산마늘 추출물 세포 생존율을 측정한 결과는 Fig. 1(C)와 같다. 에탄올을 처리한 그룹에서는 대조군(100%) 대비 55.75%의 세포 생존율을 보여주었으며, 20 μg/mL 농도로 산마늘 추출물을 처리하였을 때, 산마늘의 물과 60% 에탄올 추출물에서 각각 64.81%와 64.36%로 유의적으로 높은 세포 생존율을 보였으며, 양성대조군으로 사용된 비타민 C는 대조군(100%) 대비 80.67%의 세포 생존율을 나타내었다.
알코올로 유도된 스트레스에 대한 간 세포(HepG2 cells)에서의 산마늘의 물과 60% 에탄올 추출물의 활성산소종 소거활성을 측정한 결과는 Fig. 1(D)와 같다. 에탄올을 처리하였을 때, 대조군(100%) 대비 144.31% 증가한 활성산소종 함량을 보였으며, 양성대조군은 비타민 C에서는 대조군 대비 65.40%의 활성산소종 감소 효과를 나타내었다. 산마늘의 물 추출물과 60% 에탄올 추출물은 유의적으로 활성산소종의 함량을 감소시키는 것으로 나타내었으며 20 μg/mL 농도에서 대조군 대비 각각 88.00%와 112.89%의 활성산소종 함량을 나타냄으로써 알코올로 유도된 세포독성에 대한 산화적 스트레스를 효과적으로 억제하였다. 두 추출물 모두 음성대조군 대비, 유의적으로 세포 생존율과 산화적 스트레스를 개선시켰으며, 특히 산마늘의 물 추출물은 상대적으로 우수한 산화적 스트레스 억제 활성을 가지는 것을 확인하였다.
알코올로 유도된 세포독성에서 간 세포(HepG2 cells)에 대한 산마늘의 물과 60% 에탄올 추출물의 세포사멸 관련 단백질 발현량을 측정한 결과는 Fig. 2와 같다. 물 추출물의 결과에서는(Fig. 2(A)-(E)), 에탄올을 처리한 그룹에서 대조군(100%) 대비 BCl-2는 44.09%, BAX는 127.97%의 발현량을 나타내었다. 반면, 20 μg/mL의 농도로 산마늘의 물 추출물을 처리하였을 때, 대조군 대비 BCl-2는 83.43%, BAX는 90.16%의 단백질 발현량을 나타내었다. 60% 에탄올 추출물 결과에서는(Fig. 2(F)-(J)), 에탄올을 처리한 그룹에서 대조군(100%) 대비 BCl-2는 84.26%, BAX는 121.93%의 발현량을 나타내었으며 5 μg/mL의 농도로 60% 산마늘 에탄올 추출물을 처리하였을 때, 대조군(100%) 대비 BCl-2는 94.87%로 가장 높은 단백질 발현량을 나타내었다. 반면, 20 μg/mL의 농도로 처리하였을 때의 BCl-2의 발현량은 에탄올만을 처리한 그룹과 유의적인 차이를 나타내지 않았다. 산마늘의 60% 에탄올 추출물을 처리한 그룹에서, 5 μg/mL의 농도로 처리하였을 때, BAX는 91.09%의 감소한 단백질 발현량을 나타내며 유의적으로 단백질 발현을 개선하였다. BAX/BCl-2 비율 또한, 산마늘 물 추출물을 처리한 그룹에서 20 μg/mL 농도로 처리하였을 때, 에탄올만 처리한 그룹(3.03) 대비 1.09의 비율을 나타내었으며 산마늘 60% 에탄올 추출물을 5 μg/mL 농도로 처리한 그룹에서는 에탄올만 처리한 그룹(1.44) 대비 0.96의 비율을 나타내며 개선된 단백질 발현량을 확인하였다. 더불어, pro-caspase-3의 발현량을 측정하였을 때, 산마늘 물 추출물을 처리하였을 때, 알코올만 처리한 그룹은 대조군(100%) 대비 55.21%의 발현량을 나타내었으며, 20 μg/mL의 농도로 처리하였을 때, 대조군(100%) 대비 93.56%의 발현을 증가시킴으로써 간 세포 보호효과를 나타내었다. 60% 에탄올 추출물을 처리하였을 때는, 알코올만을 처리한 그룹에서는 62.01%의 발현량을 나타내었으며, 10 μg/mL를 처리한 그룹에서 87.19%로 가장 높은 단백질 발현량을 나타내었으며, 농도가 올라갈수록 발현량이 감소하는 경향을 보였다.
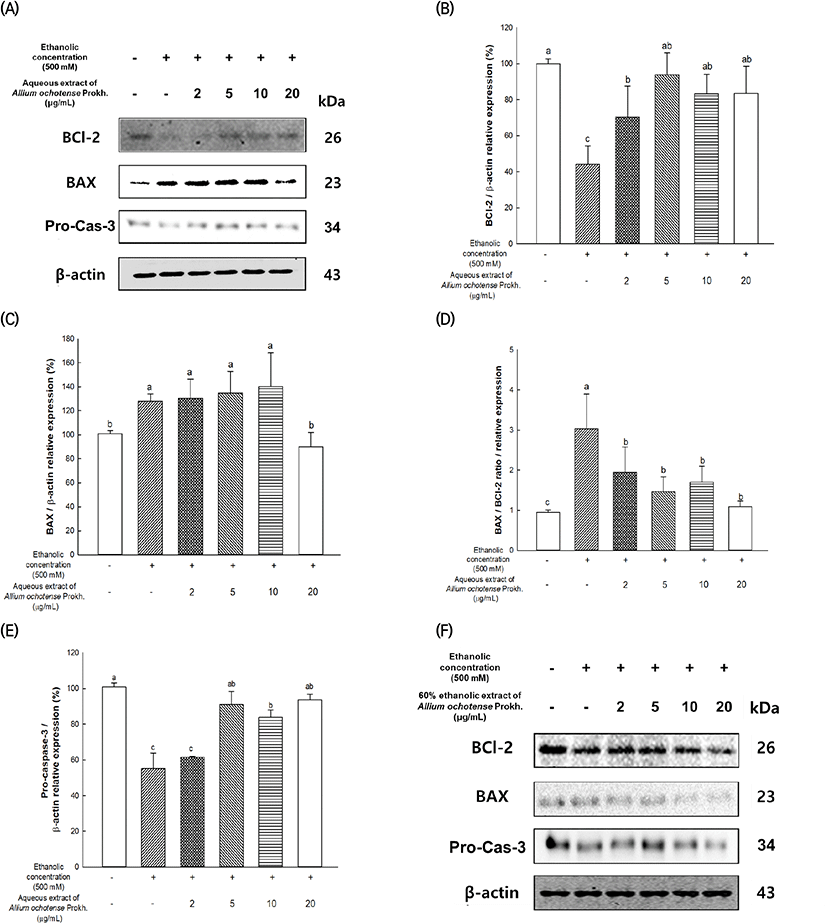
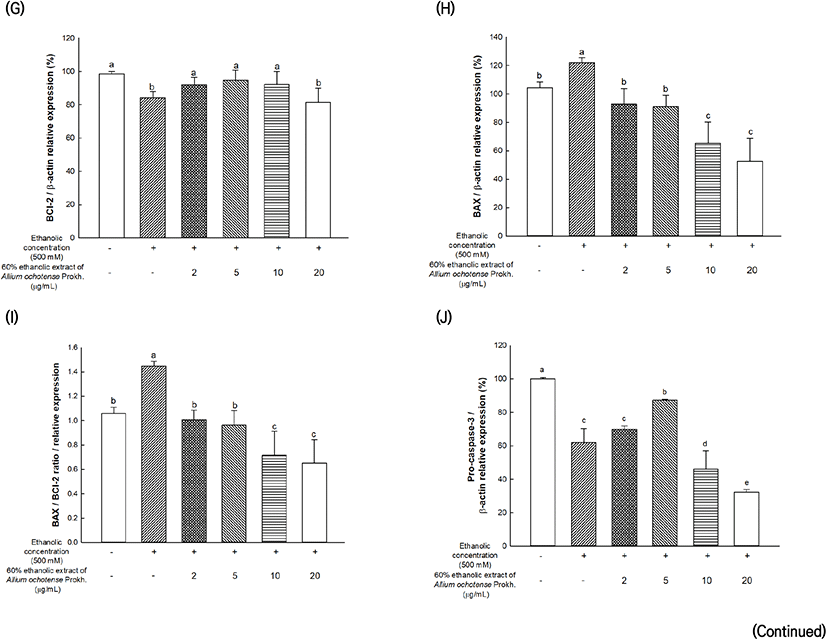
알코올은 간 대사 과정에서 여러 가지 영향을 미치는 것으로 알려져 있으며, 알코올 그 자체뿐만 아니라 산화 과정에 생성된 ROS는 하이드록실 라디칼 형성, 지질 라디칼 형성 및 GSH를 감소시켜 간 손상을 유발시키며 또한, 대사과정에서 생성된 독성물질인 acetaldehyde가 간세포의 손상을 가져오게 된다(Dey와 Cederbaum, 2006; Lieber, 1988). Yin 등(1999)의 연구에서는 알코올을 섭취한 마우스에서는 대조군에 비하여 종양 괴사 인자 수치가 증가하는 것을 확인하였으며, Setshedi 등(2010)은 염증성 사이토카인과 간 손상의 증가로 간 관련 질환을 일으킬 수 있다고 보고하였다(Setshedi 등, 2010; Yin 등, 1999). 이러한 세포의 손상에 의한 자극은 BAX를 미토콘드리아로 이동시키고 미토콘드리아의 막 전위 감소로 인한 미토콘드리아의 막 투과성을 향상시켜 미토콘드리아 막간 공간의 세포사멸 인자가 세포질로 방출되어 세포사멸을 유도하고 BCl-2는 미토콘드리아 막을 안정화하여 세포사멸 인자가 유출되는 것을 억제하는 것으로 알려져 있다(Wang 등, 2016). 더불어, 알코올과 같은 스트레스로 인한 세포의 손상은 미토콘드리아 막의 BCl-2/BAX 균형의 붕괴를 일으키고, 이는 세포질로의 cytochrome C의 방출을 촉진하여 비활성화 상태인 pro-caspase-3를 활성화 형태인 caspase-3로 변환시켜 세포사멸을 유발한다(Elblehi 등, 2021). 따라서, pro-caspase-3의 발현의 감소는 caspase-3의 발현의 증가로 인한 세포사멸의 증가로 판단할 수 있다. 본 실험에서, 산마늘 물 추출물을 처리하였을 때, 농도 의존적으로 BCl-2, pro-caspase-3의 발현량은 증가하고, BAX의 발현량은 감소하여 상대적으로 우수한 세포 보호효과를 보였다. 반면, 산마늘 60% 에탄올 추출물을 처리한 경우, 20 μg/mL에서 BCl-2, BAX 및 pro-caspase-3와 같은 단백질의 발현량이 다소 감소하는 경향을 나타내었는데, 이는 일정 농도 이상의 산마늘 60% 추출물을 처리하였을 때, 세포사멸에 의한 단백질 발현량의 조절로 판단되며, 향후 동물실험을 통한 추가적인 관련 기작 연구가 필요할 것으로 판단된다. 본 실험에서, 산마늘 추출물을 처리한 그룹은 세포사멸 관련 단백질인 BCl-2, BAX 및 pro-caspase-3의 발현량을 유의적으로 개선시켜 세포사멸을 억제하는 것을 확인하였다. 산마늘에 포함되어 있는 quercetin과 같은 플라보노이드가 알코올을 섭취한 마우스에서 산화적 스트레스를 억제한다고 보고되었으며, 산마늘과 알코올을 함께 섭취한 마우스에서 간 재생 및 염증 조절과 관련된 farnesoid X receptor (FXR) 및 에너지 대사를 조절하는 amp-activated protein kinase(AMPK)의 발현을 향상시키고, NLR family pyrin domain containing 3(NLRP3), EGF-like module-contaning mucin-like hormone receoptor-like 1(F4/80)와 같은 염증 인자의 발현은 억제시키는 것을 확인되었다(Cui 등, 2021; Molina 등, 2003). 산마늘 추출물은 우수한 ADH 활성 및 함유되어 있는 풍부한 플라보노이드 화합물에 의해 산화적 스트레스 감소 및 간 세포 보호 효과를 가지며 이로 인해 세포사멸과 관련된 인자들이 조절되어 세포 사멸이 억제되었을 것으로 판단된다. 위의 연구결과를 통해 산마늘 물 추출물이 에탄올 60% 추출물보다 전반적으로 높은 알코올 대사 관련 효소 활성 및 세포 보호 효과를 가지고 있는 것을 확인하였고, 위와 같은 연구 결과를 바탕으로, 간 기능 개선 및 알코올 관련 간 질환을 예방할 수 있는 건강기능식품 소재로써 이용될 수 있는 산업적 가능성을 확인하였다.
4. 요약
본 실험에서는 산마늘 추출물의 in vitro 항산화 및 in vitro 생리활성 효능평가를 진행하였다. 산마늘 추출물은 페놀성 화합물과 플라보노이드 화합물을 함유하고 있으며, ABTS, DPPH 라디칼 소거 활성 등을 나타내었다, 특히, 산마늘 추출물은 우수한 알코올 대사 관련 효소 활성을 나타내었으며 더불어, HepG2 세포에서 에탄올로 유도된 스트레스에 대해 세포 생존율을 유의적으로 증가시켰으며, 활성산소종의 생성을 효과적으로 감소시켰다. 그리고 산마늘 물 및 60% 에탄올 추출물은 에탄올로 세포독성이 유도된 간 세포에서 BCl-2, BAX 및 pro-caspase-3의 발현량을 개선함으로써 세포사멸을 억제하는 것으로 확인되었다.
