1. 서론
비만은 단순히 체중이 증가하는 것을 의미하는 것이 아니라 체내 지방이 비정상적으로 증가하여 축적된 상태를 의미하며, 한국뿐만 아니라 세계적으로 비만 인구는 꾸준히 증가하는 추세이다. 비만 자체로도 심각한 질환으로 여겨질 뿐만 아니라, 고혈압, 제2형 당뇨, 고지혈증, 관절염, 죽상동맥경화증과 심혈관계 질환, 관절염, 암 등의 원인이 되는 것으로 알려지면서 비만 예방과 관리의 중요성이 강조되고 있다(Bastard 등, 2006; Dilworth 등, 2021; Haslam과 James, 2005; Mohamed, 등, 2018).
지방세포 분화에 관여하는 PPARγ, C/EBPα 등과 같은 전사인자들의 발현 증가는 fatty acid synthase(Fas), resistin, leptin, adiponectin과 같은 지방세포 특이 유전자 발현을 활성화시켜 지방세포 분화 및 지방세포의 형태학적 특징이 나타나도록 하며 세포 내 지방 축적을 유도한다(Choi 등, 2022; Hu 등, 1995; Rosen과 Spiegelman, 2000). 지방조직 내 과도한 지방 축적은 TNF-α, IL-6와 같은 전염증성 사이토카인 및 아디포카인의 분비가 증가하며, 낮은 등급의 만성적인 염증 상태가 계속 일어나게 되고, 이는 인슐린 저항성을 증가시켜 당뇨병 발생을 증가시킬 뿐만 아니라 그 외에도 다양한 대사성 질환의 발생을 증가시킨다(Anusree 등, 2018; Guzik 등, 2017; Landecho 등, 2019). 비만과 염증 사이의 연관성이 여러 연구를 통해서 입증됨으로써 비만뿐만 아니라 비만과 관련된 다양한 대사성 질환에서 염증 조절의 중요성이 대두되고 있다(Engin, 2017).
꾸지뽕나무(Maclura tricuspidata)는 뽕나무과에 속하는 낙엽성 소교목으로 꾸지뽕나무 가지에는 kaempferol, quercetin, dihydroquercetin7-O-β-D-glucopyranoside, dihydrokaempfer7-O-β-D-glucopyranoside, taxifolin, orobol, eriodictyol, dihydrokaempferol, steppogenin 등을 함유하고 있으며, 항산화, 미백, 간염 치료 및 간 보호, 항염증, 항비만 등 다양한 약리효과에 대해 보고된 바 있다(Choi 등, 2015; Han 등, 2016; Lee 등, 1994; Lee 등, 2022; Kim 등, 2012).
버섯은 예로부터 식품뿐만 아니라 약재로도 사용되었으며, 다양한 연구들을 통해 항산화, 항균, 항암, 항염증, 면역증강 등의 기능성이 있는 것으로 알려지면서 식품, 의약품, 화장품 등 여러 분야에서 이용되고 있다(Kim 등, 2004; Kim 등, 2010). 대표적인 약용버섯인 영지버섯(Ganoderma lucidum)은 항암, 항산화, 면역증대, 항염증 등의 다양한 생리활성을 가진 것으로 알려져 있다. 최근에는 버섯 균사체를 이용한 발효를 통해 천연물의 기능성 성분 및 생리활성 증진을 위한 연구 결과들이 보고되고 있다(Kim 등, 2010; Lee 등, 2000, Yang 등, 2014). 영지버섯, 노루궁뎅이버섯, 장수상황버섯 등의 균사체를 이용한 발효를 통해 기능성 성분의 함량이 증가하고 항산화, 면역증강, 혈중 중성지방 개선 효과 등이 증가하는 것으로 보고되어 있다(Hong 등, 2014; Joung 등, 2009: Kim 등, 2014; Koh 등, 2021; Shin 등, 2008; Shon, 2010).
본 연구에서는 약용버섯으로 알려진 영지버섯 균사체를 이용하여 꾸지뽕나무 잔가지 발효물을 제조하고 발효물을 70% 에탄올로 추출하여, 그 추출물의 3T3-L1 지방전구세포 분화 억제 및 항염증 효과를 확인하고자 하였다.
2. 재료 및 방법
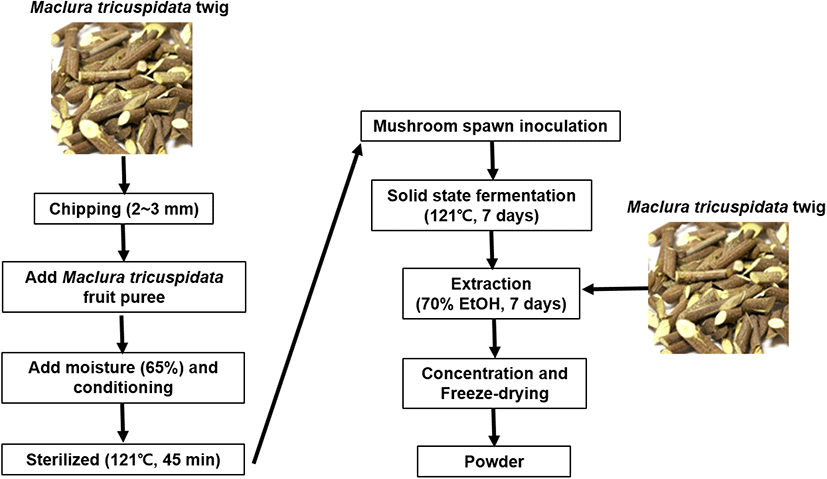
건조된 꾸지뽕 잔가지는 배양용 배지 제조를 위해 나무파쇄기를 이용하여 2-3 mm의 크기로 분쇄하였다. 분쇄된 꾸지뽕 잔가지의 수분함량 조절을 위해 냉동 꾸지뽕 열매에 4배의 온수를 가하여 믹서기로 균질화한 퓨레를 첨가하고 수분함량이 65% 정도 되게 조정한 후 영지버섯 균사체 배양을 위한 배지로 사용하였다. 버섯배양용 봉지에 꾸지뽕 잔가지를 넣고 121°C에서 45분간 살균 후 영지버섯 균사체와 꾸지뽕나무 톱밥 종균을 5% 정도로 혼합접종하였다. 25°C에서 1주일간 영지버섯 균사체 배양 후 건조하였다. 추출물 제조를 위해 영지버섯 균사체가 배양된 건조 배지 100 g과 꾸지뽕 잔가지 100 g에 각각 300 mL의 70% 에탄올을 가하고 실온에서 일주일간 침지 추출을 하였다. Filter paper (Advantec, Tokyo, Japan)를 이용하여 추출액을 여과한 후 회전 감압농축기(Tokyo Rikakikai, Tokyo, Japan)로 농축하고 동결건조하여 제조한 분말을 시료로 사용하였다(Fig. 1).
실험에 사용된 마우스 유래 3T3-L1 지방전구세포는 American Type Culture Collection(Manassas, VA, USA)으로부터 분양받아 사용하였으며, 10% bovine serum, 1% antibiotic-antimycotic을 첨가한 Dulbecco’s modified Eagle’s medium(DMEM) 배지를 사용하여 5% CO2, 37°C 배양기에서 배양하며 실험에 사용하였다.
100% Confluence에 도달한 지방전구세포를 분화 유도 인자(DMI, 2 mM dexamethsone+0.5 mM 3-isobutyl-methylxanthine+1 μg/mL insulin)와 10% fetal bovine serum(FBS)이 포함된 DMEM 배지에서 이틀 동안 배양한 후, 1 μg/mL insulin과 10% FBS가 포함된 DMEM으로 교체하여 이틀 동안 배양하였다. 분화 유도 중인 세포는 2일 간격으로 10% FBS가 포함된 DMEM으로 교체하며 8일 동안 지방세포로 분화시켰다. 지방세포 분화 억제 효과를 확인하기 위해 분화 유도 기간(8일) 동안 배지에 추출물을 농도별로 함께 처리하였다. 분화된 세포에 염증반응을 유도하기 위해 분화가 완료된 세포에 추출물을 3시간 처리한 후, 100 ng/mL LPS from Escherichia coli(055:B5)를 18시간 처리하였다.
3T3-L1 지방전구세포를 96 well plate의 각 well에 4×103으로 분주하여 24시간 동안 배양하였다. 이후 추출물을 농도별로 처리하여 48시간 동안 배양하였다. 배양 후, 각 well의 배지를 제거하고 DMEM으로 5 mg/mL의 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 용액을 0.5 μg/mL로 희석하여 100 μL씩 각 well에 분주하고 37°C 배양기에서 4시간 동안 배양하였다. 그 후, MTT 용액을 완전히 제거하고 각 well에 100 μL의 dimethyl sulfoxide(DMSO)를 첨가하여 실온에서 10분간 반응시켰다. 완전히 용해된 formazan은 540 nm에서 microplate reader(Versamax, Molecular Devices, San Jose, CA, USA)를 이용하여 흡광도를 측정하였다.
3T3-L1 지방전구세포를 24-well plate에 배양하여 분화 유도와 추출물 처리가 완료된 후 배지를 제거하고 phosphate-buffered saline(PBS)으로 2회 세척한 다음, 3% formaldehyde으로 상온에서 30분 동안 고정하였다. 고정된 세포는 증류수로 3회 세척 후 추가로 60% isopropyl alcohol을 이용하여 세척하였다. 세포를 완전히 건조한 다음, 0.5% Oil Red O 용액을 이용하여 30분간 실온에서 염색하고, 증류수로 3회 세척하였다. 염색된 세포에 100% isopropyl alcohol 150 μL를 첨가하여 세포 내 염색된 Oil Red O 용액을 시키고 microplate reader(Versamax, Molecular Devices)를 이용하여 520 nm에서 흡광도를 측정하였다.
3T3-L1 지방전구세포의 분화 유도와 시료 처리가 완료된 후 수집한 DMEM을 이용하여 배지 내 adiponectin 및 leptin 농도를 분석하였다. Enzyme-linked immunosorbent assay(ELISA) kit(Enzo Life Sciences, Farmingdale, NY, USA)를 이용하여 측정하였고, 각각의 standard 농도별 표준 곡선을 이용하여 adiponectin 및 leptin 농도값을 산출하였다.
분화 유도가 완료된 3T3-L1 지방세포에 추출물과 LPS를 처리한 후 수집한 DMEM을 이용하여 배지 내 TNF-α, IL-6, MCP-1 농도를 분석하였다. 각각의 ELISA kit(Enzo Life Sciences)를 이용하여 측정하였고, 각각의 standard 농도별 표준 곡선을 이용하여 inflammatory cytokine 농도값을 산출하였다.
처리가 끝난 지방세포를 PBS로 세척한 다음, cell scraper로 회수하고, radioimmunoprecipitation assay(RIPA) buffer(Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하여 20분간 4°C에서 용해하였다. 12,000 rpm에서 20분간 원심분리하여 상등액을 회수하고 bicinchoninic acid(BCA) protein assay kit(Thermofisher, Waltham, MA, USA)를 이용하여 단백질을 정량하였다. 동량의 단백질을 sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)를 이용하여 전기영동한 후 polyvinylidene fluoride(PVDF) membrane(Sigma-Aldrich Co.)에 transfer하였다. Everyblot blocking buffer(Bio-Rad, Hercules, CA, USA)로 membrane을 상온에서 10분 동안 blocking하고 희석된 1차 antibody(1:1000-1:5000)를 4°C에서 하룻밤 동안 반응시켰다. Membrane을 tris-buffered saline with 0.1% Tween-20(TBS-T)으로 15분씩 3회 세척한 후, 희석된 2차 antibody(1:1000-1:2500)를 상온에서 2시간 반응시켰다. TBS-T로 membrane을 15분씩 3회 세척한 후, enhanced chemiluminescent substrate(Thermofisher, Waltham, MA, USA)와 반응시킨 후 image reader(Microchemi 4.2, DNR bioimaging systems Ltd., Neve Yamin, IS)를 이용하여 단백질 발현을 분석하였다.
3. 결과 및 고찰
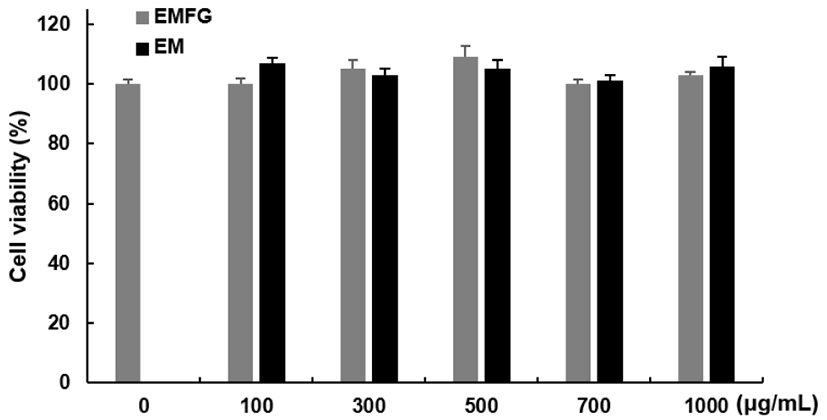
3T3-L1 지방전구세포에 대한 발효 꾸지뽕 잔가지 추출물의 세포독성을 확인하기 위해 추출물을 농도별로 48시간 동안 처리하고 MTT assay를 통해 세포독성을 평가하였다. 추출물을 0, 100, 300, 500, 700, 1,000 μg/mL의 농도로 48시간 동안 처리한 결과, Fig. 2에서 보여주는 바와 같이 농도별로 발효 꾸지뽕 잔가지 추출물은 100, 105, 109, 100, 103%, 꾸지뽕 잔가지 추출물은 107, 103, 105, 101, 106%의 생존율을 나타냈으며 1,000 μg/mL까지 세포독성이 나타나지 않았다.
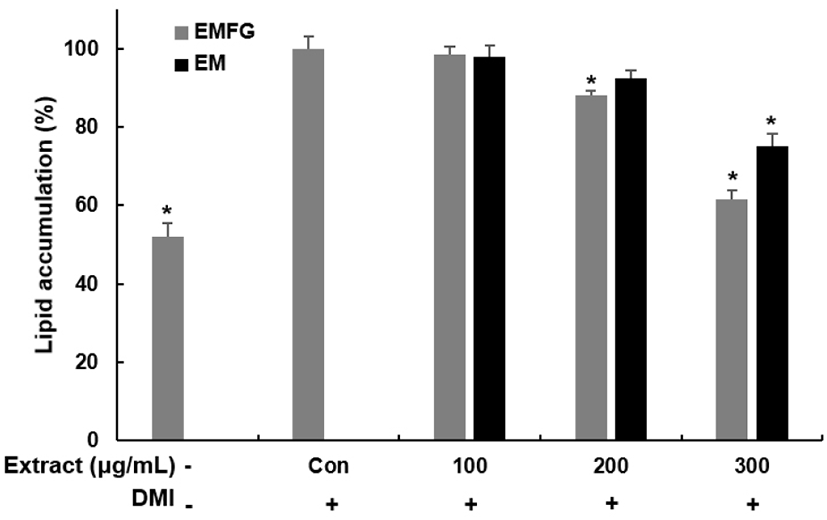
3T3-L1 지방전구세포는 dexamethsone, 3-isobutyl-methylxanthine, insulin과 같은 분화 유도 인자의 처리를 통해 C/EBP family, PPARγ와 같은 지방세포 분화에 관여하는 전사인자들의 발현이 증가하며 세포 분화를 유도하여 지방세포로 전환되고 세포 내 지방을 축적하게 된다(Rosen과 Spiegelman, 2000; Tzeng과 Liu, 2013). 영지버섯 균사체 발효 꾸지뽕 잔가지 추출물의 3T3-L1 지방전구세포 분화 억제 효과를 알아보고자 분화 유도 인자를 처리하여 지방세포 분화를 유도하는 동안 추출물을 처리하고 Oil Red O 염색을 수행하여 지방 축적 정도를 확인하였다(Fig. 3). 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리하였을 때, 분화 유도 인자 단독 처리한 군에 비해 지방구 생성이 약 2, 12, 39% 감소하였다. 꾸지뽕 잔가지 추출물에서는 100, 200, 300 μg/mL 농도로 처리했을 때, 분화 유도 인자만 처리된 군에 비해 지방구 생성이 약 2, 8, 25% 감소하여, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 1, 4, 19% 높은 지방구 생성 억제 효과를 나타냈다. 이러한 결과를 통해 꾸지뽕 잔가지 발효 추출물이 3T3-L1 지방전구세포에서 지방세포로의 분화를 억제함을 확인할 수 있으며 발효를 통해 지방세포 분화 억제 효능 증가에 영향을 준 것으로 생각된다. Kim 등(2015)이 3종류의 버섯 균사체로 발효한 천년초 추출물을 처리하였을 때 지방구 축적이 감소하였고, 이는 발효 전 천년초보다 발효한 천년초의 지방 축적 억제 효과가 높은 것으로 나타났다. 또한, Moon 등(2019)은 천년초 열매를 Lactobacillus plantarum으로 발효하였을 때, 지방 축적이 억제되었으며 이는 발효 전보다 지방 축적 억제 효과가 더 높은 것으로 나타났다.
Adipokine은 지방세포에서 분비되는 cytokine을 칭하며, 그중 adiponectin은 근육조직 내 지방산의 산화 증가와 당 생성 감소와 같은 에너지 대사를 조절하는 호르몬으로 주로 비만 환자보다는 정상인에게서 더 높게 나타나며 adiponectin 감소는 고지혈증, 제2형 당뇨와 같은 대사증후군을 일으키는 것으로 알려져 있다(Dilworth 등, 2021). Leptin은 지방조직에서 분비되며 음식 섭취량 증가에 비례하여 지방 생성이 증가하면 leptin의 생성도 증가하며 고지방식이에 의한 대사이상으로 인해 leptin과 인슐린에 대한 저항성이 증가하여 간 조직 내 염증뿐만 아니라 제2형 당뇨를 유발하는 것으로 알려져 있다(Dilworth 등, 2021; Ekmen 등, 2016; Rosenbaum과 Leibel, 1999). 또한, adiponectin과 leptin은 생성은 지방의 축적량에 따라 상반된 결과를 나타낸다고 보고되어 있다(Seo, 2015).
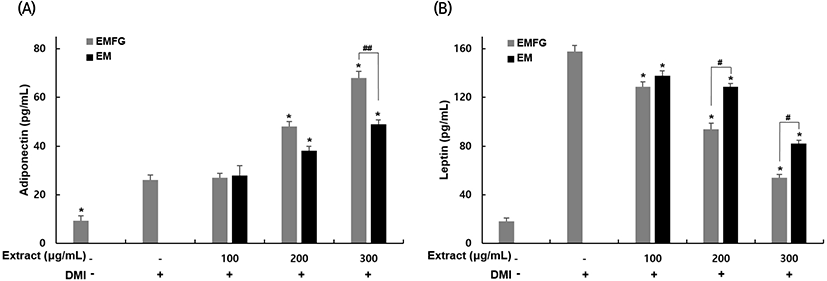
본 연구에서는 발효 꾸지뽕 잔가지 추출물 처리가 3T3-L1 세포를 지방세포로 분화시키는 과정 동안 adiponectin과 leptin 생성에 미치는 영향을 확인하였다(Fig. 4). Adiponectin의 농도의 경우, 분화 유도 인자 단독 처리한 군에서 26 pg/mL를 나타냈다. 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 27, 48, 68 pg/mL로 생성이 증가하였고 각각 3, 84, 161%의 증가율을 나타냈으며 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 28, 38, 49 ng/mL로 생성이 증가하였고 약 7, 46, 88% 증가율을 나타냈으며, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 4, 26, 39% 높은 adiponectin 생성 효과를 나타냄을 확인했다. 한편, leptin 농도의 경우, 분화 유도 인자 단독 처리한 군에서는 158 pg/mL를 나타냈다. 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리한 군에서는 129, 94, 54 pg/mL로 생성이 감소하였고 각각 15, 41, 66%의 감소율을 나타냈으며, 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 138, 129, 82 ng/mL로 생성이 감소하였고 약 13, 18, 48% 감소율을 나타냈으며, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 7, 27, 34% 높은 leptin 생성 억제 효과를 나타냄을 확인했다. 본 연구 결과를 통해 발효 꾸지뽕 잔가지 추출물의 adiponectin 증가 및 leptin 감소 효과뿐만 아니라, 꾸지뽕 잔가지 추출물보다 발효 꾸지뽕 잔가지 추출물이 더 높은 효과를 나타냄을 확인하였으며, 이는 지방 축적 정도를 측정한 결과와 유사한 양상을 나타냈다. Kwak과 Kim(2012)은 분화과정 동안 3T3-L1 세포에 resveratrol과 epigallocatechin gallate를 혼합 처리했을 때 지방세포 분화 및 지방 축적을 감소시켰으며 분화 유도 인자만 처리한 군에 비해서 처리 농도에 따라 adiponectin은 49%, 78% 증가, leptin은 48%, 75% 감소시킴을 보고하였으며, 본 연구 결과와 유사한 결과를 나타내었다. 따라서, 발효 꾸지뽕 잔가지 추출물은 3T3-L1 세포 분화 및 지방 축적 과정 동안 지방 대사 및 당 대사에 관여하는 중요한 adipokine인 adiponectin과 leptin의 생성을 조절함으로써 지방세포 분화를 억제하여 비만뿐만 아니라 비만성 대사증후군 조절에 효과가 있을 것으로 생각된다.
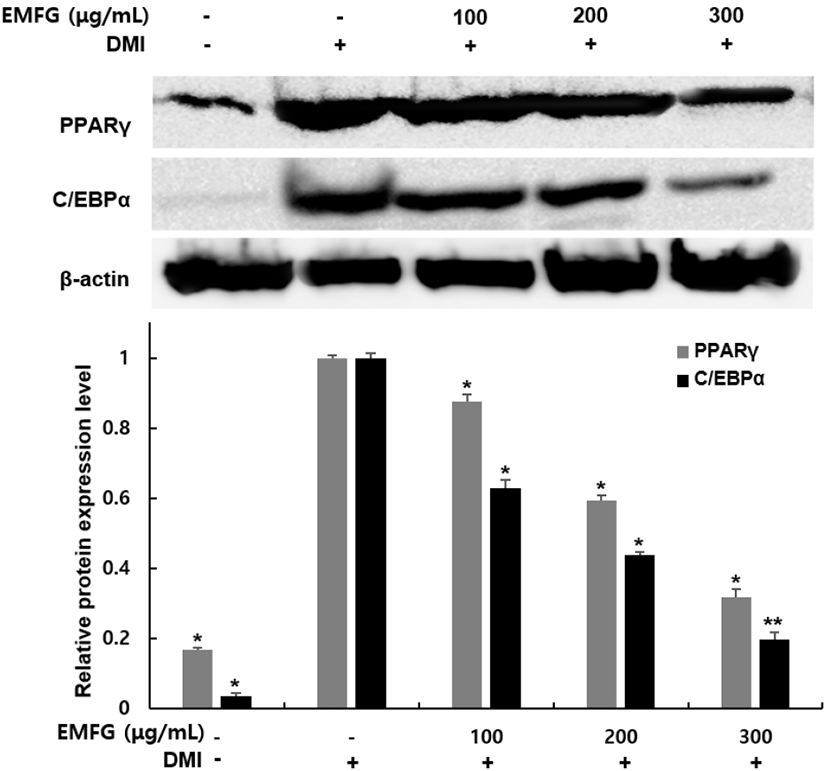
지방전구세포가 지방세포로 분화되는 과정에는 다양한 전사인자들이 관여하며 각각의 단계를 조절하는 것으로 알려져 있다(Kallen과 Lazar, 1996). 특히, PPARγ와 C/EBPα는 지방세포 분화를 조절하는 핵심 전사인자로, 분화된 세포에서 지방산 합성 및 지방구 생성 증가에 의한 지방세포 비대와 같은 형태학적 특징뿐만 아니라 지방세포 특이적 유전자들의 발현을 유발하여 지방세포로서의 특징이 나타나게 한다(Hu 등, 1995). 따라서 지방세포 분화를 조절하는 전사인자들의 발현 조절에 의한 지방세포 분화 억제는 비만은 예방하기 위한 중요한 지표로 여겨지고 있다(Ali 등, 2013; Choi 등, 2022; Hu 등, 1995). 본 연구에서는 발효 꾸지뽕 잔가지 추출물이 전사인자들의 발현에 어떠한 영향을 미치는지 확인하기 위해 western blot을 실시하여 PPARγ과 C/EBPα 발현 변화를 확인하였다. 그 결과, 분화 유도 인자의 처리를 통해 지방전구세포에서 지방세포로 분화된 군에서는 PPARγ과 C/EBPα 발현이 현저하게 증가하였지만, 분화 유도 과정 중 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리한 군에서는 분화 유도 인자 단독 처리한 군에 비해서 PPARγ는 12, 41, 68%, C/EBPα는 37, 56, 80% 발현이 감소함을 확인하였다(Fig. 5). Kwon 등(2021)은 홍맥 추출물에 의해 C/EBPα, SREBP-1, PPARγ의 발현을 감소시켜 지방세포 분화 억제 및 지방 축적 저해 효과가 있는 것으로 보고하였다. 또한, Lim 등(2014)의 연구에서도 발효하지 않은 에티오피아 모카 시다모 커피보다 홍국균을 이용하여 발효한 에티오피아 모카 시다모 커피가 더 높은 지방세포 분화 억제뿐만 아니라 PPARγ와 C/EBPα 발현 억제능을 가져 발효 커피가 효과적인 항비만 효능이 있으며, 발효를 통해 항비만 효능이 증가하였다고 보고하였다. 이러한 결과를 통해 발효 꾸지뽕 잔가지 추출물의 지방세포 분화 억제 효과는 지방세포 분화과정을 유도하는 전사인자인 PPARγ와 C/EBPα의 발현 저해를 통해 나타나는 것임을 보여주고 있으며 항비만 효능을 가지는 기능성 소재로서의 가지를 확인할 수 있었다.
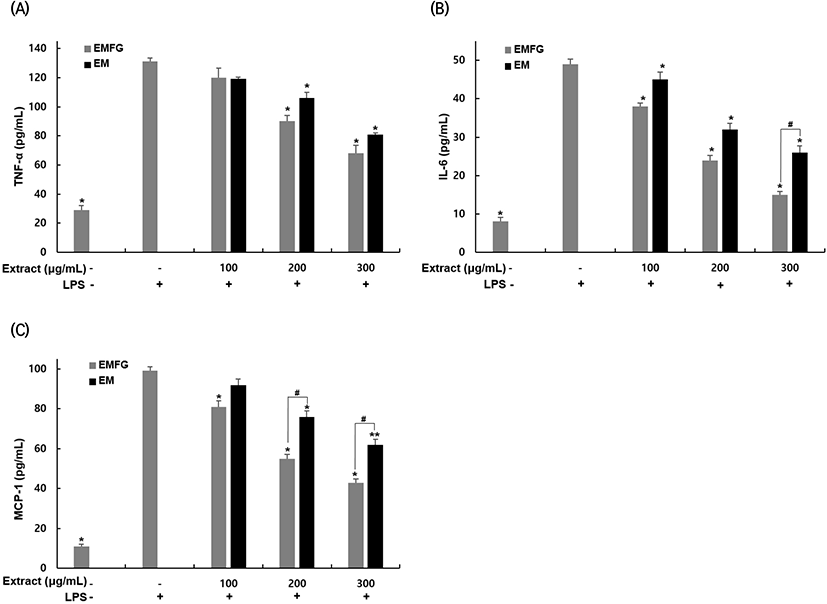
지방조직 내 과도한 지방 축적은 염증성 사이토카인(TNF-α, MCP-1, IL-6) 분비를 증가시키며 지방조직뿐만 아니라 신체 전반에 만성적인 낮은 수준의 염증반응이 계속 유도된다(Anusree 등, 2018; Park과 Mun, 2014). TNF-α는 염증과 관련된 다양한 세포 신호전달 경로를 활성화하며 염증성 효소인 iNOS, COX-2와 염증성 사이토카인 IL-6, IL-1β 등의 생성을 증가시키고 항염증성 사이토카인 IL-4, IL-10을 감소시켜 염증반응을 유발한다(Cheng 등, 2019). MCP-1과 IL-6은 지방조직 내 대식세포의 침투를 조절하여 지방조직 내 염증을 일으키고 인슐린 저항성을 유발한다(Kern 등, 2001; Unamuno 등, 2018). 지방조직의 만성적인 염증반응에 의한 인슐린 저항성 증가는 제2형 당뇨병뿐만 아니라 고혈압, 심혈관계 질환을 포함한 다양한 대사성 질환 발생 기전에서 중요한 요소로 여겨지고 있다(Hsieh 등, 2017). 분화된 지방세포에서 발효 꾸지뽕 잔가지 추출물의 염증성 사이토카인 생성에 미치는 영향을 확인하기 위해 추출물과 LPS 처리 후 TNF-α, IL-6, MCP-1 생성량을 ELISA를 이용하여 확인하였다(Fig. 6). TNF-α 농도는 LPS 단독 처리한 군에서 131 pg/mL를 나타냈다. 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 120, 90, 68 pg/mL로 생성이 감소하였고 각각 8, 31, 84% 감소시켰으며 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 119, 106, 81 pg/mL로 생성이 감소하였고 각각 9, 19, 38% 감소시켰으며, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 0.84, 15, 16% 높은 TNF-α 생성 억제 효과를 나타냄을 확인했다. IL-6 농도는 LPS 단독 처리한 군에서 49 pg/mL를 나타냈다. 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 38, 24, 15 ng/mL로 생성이 감소하였고 각각 22, 51, 69% 감소시켰으며 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 45, 32, 26 pg/mL로 생성이 감소하였고 각각 8, 35, 47% 감소시켰으며, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 15, 25, 42% 높은 IL-6 생성 억제 효과를 나타냄을 확인했다. MCP-1 농도는 LPS 단독 처리한 군에서 99 pg/mL를 나타냈다. 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 81, 55, 43 pg/mL로 생성이 감소하였고 각각 18, 44, 57% 감소시켰으며, 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리했을 때, 92, 76, 62 pg/mL로 생성이 감소하였고 각각 7, 23, 37% 감소시켰으며, 발효 꾸지뽕 잔가지 추출물이 발효 전보다 농도별로 12, 28, 31% 높은 MCP-1 생성 억제 효과를 나타냄을 확인했다. Park(2018)은 분화된 3T3-L1 세포 내 LPS로 유도된 염증반응에서 발아 현미 처리를 통해 TNF-α, MCP-1, IL-6을 감소시킴으로써 염증반응이 억제됨을 보고하였으며, Wang 등(2015) 또한 osthloe를 처리하였을 때 LPS에 의해 증가된 TNF-α, IL-6을 감소시켜 염증반응이 억제됨을 보고한 바 있다. 이러한 결과들을 통해서 발효 꾸지뽕 잔가지 추출물이 LPS에 의해 유도된 IL-6, MCP-1, TNF-α의 생성을 억제하여 지방세포의 염증반응을 억제하는 효과가 있으며 항염증 소재로서의 가능성이 있는 것으로 판단된다.
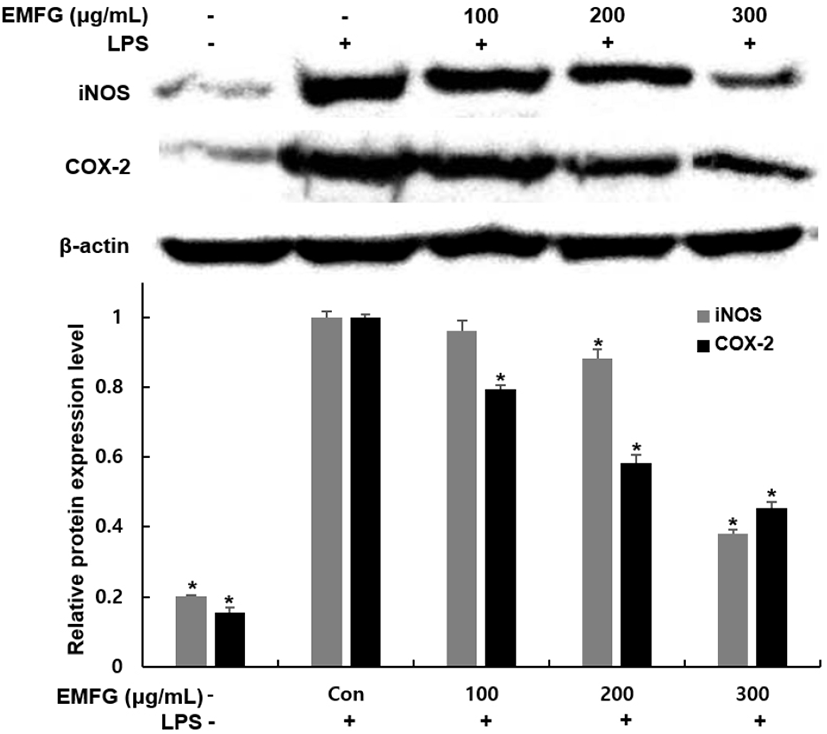
지방세포 내 iNOS와 COX-2의 과도한 발현은 염증반응을 촉진하며 당 대사의 손상과 인슐린 저항성이 증가한다. 본 연구에서는 발효 꾸지뽕 잔가지의 iNOS와 COX-2 발현에 어떠한 영향을 미치는지 확인하기 위해 분화된 지방세포에 LPS 처리 후 western blot을 실시하여 발현 변화를 확인하였다. 그 결과, 분화 유도 인자의 처리를 통해 지방전구세포에서 지방세포로 분화된 군에서는 iNOS와 COX-2 발현이 현저하게 증가하였지만, 분화 유도 과정 중 발효 꾸지뽕 잔가지 추출물을 100, 200, 300 μg/mL 농도로 처리한 군에서는 LPS 단독 처리한 군에 비해서 iNOS는 3, 30, 70%, COX-2는 15, 59, 81% 발현이 감소함을 확인하였다(Fig. 7). Kim 등(2020)의 연구에서도 LPS를 처리하여 염증반응을 유도한 분화된 3T3-L1 세포에서 saccharin 처리를 통해 염증 관련 인자의 생성을 조절하는 iNOS와 COX-2의 발현이 감소하였고, 이를 통해서 NO, IL-1β, IL-6, MCP-1, TNF-α의 발현이 감소하여 항염증 반응 효과를 나타냄을 보고하였다.
본 연구를 통해서 영지버섯 균사체 발효 꾸지뽕 잔가지 추출물은 지방구 축적 및 leptin 생성 억제와 adiponectin 생성 증가, PPARγ와 C/EBPα 발현 억제를 통해서 지방세포의 분화를 억제하며, LPS에 의해 염증반응이 유도된 지방세포의 염증성 사이토카인 생성 및 iNOS와 COX-2 발현 억제를 통해서 지방세포 내 염증반응을 억제하는 것을 확인하였다. 이상의 결과들은, 영지버섯 균사체 발효 꾸지뽕 잔가지 추출물의 지방세포 분화 및 염증반응 억제 효과를 통해서 비만뿐만 아니라 비만에 의한 대사성 질환 개선을 위한 기능성 소재로서의 가능성이 있는 것으로 판단된다.
4. 요약
본 연구에서는 영지버섯 균사체 발효 꾸지뽕 잔가지 추출물의 지방세포 분화 억제 및 염증 억제 효과를 확인하고자 하였다. 세포독성을 확인한 결과, 최대 1,000 μg/mL 농도까지 세포에 처리하여도 세포 생존율이 감소하지 않음을 확인되었다. 분화과정 동안 발효 꾸지뽕 잔가지 추출물을 처리하였을 때, 세포 내 지방 축적이 감소되었다. 분화과정에 관여하는 대표적인 adipokine인 leptin과 adiponectin의 생성량을 확인한 결과, 발효 꾸지뽕나무 잔가지 추출물에 의해 adiponectin의 생성 증가와 leptin의 생성 감소를 확인하였다. 지방세포 분화 관련 유전자의 발현은 분화 유도 인자만 처리한 군에 비해 발효 꾸지뽕나무 잔가지 추출물이 함께 처리된 군에서 추출물의 농도가 높아질수록 지방분화 전사인자인 PPARγ와 C/EBPα의 발현량이 감소하는 것을 확인하였다. 분화된 3T3-L1 세포에서 LPS에 의해 분비되는 염증성 사이토카인(TNF-α, IL-6, MCP-1)의 생성량 변화를 측정한 결과, LPS 처리로 증가된 염증성 사이토카인의 생성을 억제하였으며 염증 관련 유전자인 iNOS, COX-2의 발현도 감소되었다. 또한, 발효 꾸지뽕나무 잔가지 추출물과 발효되지 않은 꾸지뽕나무 잔가지 추출물을 비교하였을 때, 발효 꾸지뽕나무 잔가지 추출물이 지방세포 분화 및 염증 억제 효과에서 더 높은 활성을 보였으며, 이들 결과를 종합적으로 볼 때, 영지버섯 균사체를 이용한 발효가 꾸지뽕나무 잔가지의 활성 증가에 기여하는 것으로 보인다. 따라서 발효 꾸지뽕나무 잔가지 추출물은 항비만, 항염증 소재로서 비만뿐만 아니라 대사성 질환 개선을 위한 기능성 소재로서 활용이 가능할 것으로 판단되며, 향후 발효 꾸지뽕나무 추출물의 명확한 항비만, 항염증 효능을 확인하기 위해서는 유용 물질 분리 및 작용기전 등 추가적인 연구가 필요할 것으로 판단된다.
