1. 서론
산소는 호기성 생물로 알려진 동식물의 생명을 유지하기 위한 최소한의 조건이며 지구상에서 가장 흔한 원소 중 하나이지만 호흡과정에서 체내 산소 중 일부는 대사 과정 중 활성산소(reactive oxygen species, ROS)로 전환된다(Thanan 등, 2014). 활성산소는 세포 내 신호전달물질로 작용할 뿐만 아니라 체내 돌연변이 세포 및 노화된 세포를 제거하는 등 인체 면역관련 작용을 담당하고 있다(Kim 등, 2018). 전환된 활성산소 대부분은 체내 자기방어 제거 기전 에 의해 소멸되면서, 균형을 이루고 있지만 대사 과정의 불균형 혹은 자외선, 방사선 등의 원인으로 균형이 깨지게 되면 hydroxyl radical, hydrogen peroxide, superoxide anion과 같은 활성산소가 과다하게 생성된다(Lee 등, 2009; Park 등, 2016). 이러한 활성산소의 과도한 생성은 체내 강력한 산화적 스트레스를 일으키며 DNA 변성, 세포막 파괴, 단백질 변성 및 지질 산화 등과 같은 세포 손상을 유발하여 피부노화, 알츠하이머병, 고혈압, 파킨슨병 등을 비롯하여 암과 같은 각종 질병을 일으키는 것으로 보고된 바 있다(Rhim과 Choi, 2010; Valko 등, 2007). 인체 내에는 활성산소 생성 억제를 위해 catalase, superoxide dismutase, glutathione peroxidase, glutathione reductase 등과 같은 항산화 효소를 생산하고 있지만, 체내 산화적 손상을 완전하게 예방하기에 충분하지 않기 때문에 식이를 통하여 항산화 물질을 섭취하면 과생성된 활성산소를 제거하는 데 도움을 줄 수 있다(Lee 등, 2001). 항산화제는 α-tocopherol, ascorbic acid 및 carotenoid 등의 천연 항산화제와 butylated hydroxyanisole(BHA), butylated hydroxytoluene(BHT)과 같은 합성 항산화제로 나눌 수 있는데, 천연 항산화제는 독성이 적지만 상대적으로 비싸고 단독으로 사용하기에는 항산화 효능이 부족하다는 단점이 있다(Hwang 등, 2004). 또한, 합성 항산화제는 값싸고 효과가 뛰어나지만, 암과 장기 독성을 일으킨다는 연구결과가 있어 사용이 제한되고 있는 실정이다(Park 등, 2021). 따라서 부작용이 적으면서도 경제적이고 효과적인 천연물 유래 항산화제 개발의 필요성이 대두되고 있다.
암은 식이습관, 음주, 환경오염 등과 같은 매우 다양한 원인으로 발병한다. 암세포의 가장 기본적인 특징은 세포 성장 및 분열을 조절할 수 없다는 것으로, 비정상적인 증식으로 인간의 생명을 위협하며 국내 사망률 1위를 차지하고 있어 암의 치료와 예방을 위한 연구가 지속적으로 이루어져야 한다(Hanahan과 Weinberg, 2011). 기존 암 치료의 대표적인 방법은 수술적 치료, 방사선 치료, 화학요법, 면역 요법 등이 있으며, 특히 화학요법은 대부분의 암세포를 사멸할 수 있는 장점이 있지만, 독성이 강하여 암세포뿐만 아니라 정상세포에도 악영향을 미쳐 탈모, 오심, 유전자 손상 및 면역 기능 저하 등과 같은 부작용이 있다(Kim 등, 2003). 이런 부작용을 극복하기 위해 독성과 부작용이 상대적으로 적은 천연 물질을 이용한 항암제에 대한 연구 및 개발이 활발히 일어나고 있다(Gordaliza, 2007; Lee 등, 2015; Stavric, 1994).
화살나무[Euonymus alatus (Thunb.) Sieb.]는 노박덩굴과에 속하는 낙엽활엽관목으로 한국, 일본, 중국 등에 분포되어 있다. 높이는 1-3 m 정도이며 줄기에 2-4개의 코르크질이 날개처럼 붙어 있는 특징이 있어 귀신을 잡는 화살이라는 뜻의 귀전우(鬼剪羽)라고도 불린다(Kwon 등, 2007). 화살나무 내 주요 생리활성 물질로 flavonoids, steroids, terpenoids, cardenolides, lignans, phenolic acids, 및 alkaloids 등이 알려져 있고, 특히 화살나무의 날개에 다량 존재한다고 보고되어 있다(Fan 등, 2020; Zhai 등, 2016). 한방에서는 화살나무가 혈액순환을 돕고, 염증을 없애주어 불규칙한 월경, 산후 어혈, 자궁 출혈 및 피부병 등의 치료에 사용되었고(Oh 등, 2005), 현재는 항암(Cha 등, 2003), 항당뇨(Kim 등, 2022), 항산화(Kwon, 2007; Oh, 2005), 항염증(Kim 등, 2014), 항고혈당(Park 등, 2005) 작용 등의 효과가 연구되었다. 하지만 화살나무에 대한 연구는 줄기나 잎을 대상으로 이루어져 있으며, 화살나무 날개만을 이용한 연구는 거의 없는 것으로 나타났다.
따라서 본 연구에서는 화살나무 날개를 다양한 용매로 추출하여 각각의 항산화, α-glucosidase 억제, 항암 효과 및 총폴리페놀과 플라보노이드 함량에 대하여 확인하고, 이를 통해 기능성 원료로서의 연구를 위한 기초자료로 활용하고자 한다.
2. 재료 및 방법
화살나무 날개 추출물의 제조는 2019년 11월에 경기도 수원시 권선구에서 화살나무(Euonymus alatus (Thunb.) Sieb.)를 채취하여 화살나무 줄기에서 날개를 분리 후 마쇄하여 실험에 사용하였다. 물 추출물은 마쇄한 화살나무 날개 분말 15 g에 10배수(w/v)의 증류수를 가해 100°C에서 2시간씩 3번 추출하였고, 에탄올 추출물과 메탄올 추출물은 마쇄한 화살나무 날개 분말 15 g에 에탄올과 메탄올을 각각 10배수(w/v)로 혼합하여 실온에서 24 h 3회 추출하여 추출물을 얻었다. 제조한 추출물은 여과 후 감압농축기(N-1000, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 사용하여 건조하였으며, 물 추출물은 증류수, 에탄올 추출물과 메탄올 추출물은 dimethyl sulfoxide (DMSO, Sigma Chemical Co., St. Louis, MO, USA)를 이용하여 100 mg/mL의 농도로 만들어 희석하여 실험에 사용하였다.
화살나무 날개 추출물의 DPPH radical 제거 활성은 Kang 등(2010)의 방법에 따라 250, 500, 1,000 μg/mL로 희석한 화살나무 날개 추출물 및 positive control로 사용한 0.1% BHT(Sigma Chemical Co.)와 0.1% α-tocopherol(Sigma Chemical Co.) 40 μL에 0.4 mM DPPH 200 μL를 가하여 30분간 암소에서 반응시킨 후, UV/Vis-spectrometer(U-1800, Hitachi, Tokyo, Japan)를 이용하여 517 nm에서 흡광도를 측정하였다. Control은 시료 대신 에탄올을 사용하여 control에 대한 흡광도로 감소비율을 나타냈다.
화살나무 날개 추출물에 대한 ABTS•+ radical 제거 활성은 Biglari 등(2008)의 방법을 통하여 측정하였다. 7.4 mM 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS, Sigma Chemical Co.)와 2.6 mM potassium peroxodisulfate(Sigma Chemical Co.)를 혼합한 후 16시간 동안 암소에서 반응시켰다. 만들어진 ABTS 용액은 732 nm에서 0.70±0.03이 되도록 증류수를 이용해 조정 후 화살나무 날개 추출물을 각 농도별로 100 μL씩 첨가한 뒤, 3,900 μL의 ABTS용액을 넣어 실온에서 6분간 반응하였다. 반응이 끝난 후 732 nm에서 UV/Vis-spectrometer (U-1800, Hitachi)로 흡광도를 측정하였고, positive control은 0.1% BHT와 0.1% α-tocopherol을 이용하였다. Control은 시료 대신 증류수를 첨가하여 대조군에 대한 흡광도의 감소비율로 나타냈다.
화살나무 날개 추출물의 환원력은 Yildirim 등(2001)의 방법을 변형해서 측정하였다. 250, 500, 1,000 μg/mL로 희석한 화살나무 날개 추출물과 positive control 50 μL에 phosphate buffer(0.2 M, pH 6.6) 250 μL와 1% potassium ferricyanide(Junsei Chemical Co., Ltd., Tokyo, Japan) 250 μL를 섞은 후, 50°C에서 30분간 반응시켰다. 이후 250 μL의 10% trichloroacetic acid(TCA, Daejung Chemical Co., Ltd, Gyeonggi-do, Korea)를 첨가하여 3,000 rpm, 10분간 원심분리하였다. 상층액 250 μL를 따서 250 μL의 증류수와 50 μL 0.1% FeCl3(Sigma Chemical Co.)를 첨가하여 UV/Vis-spectrometer(U-1800, Hitachi)로 700 nm에서 흡광도를 측정하였다.
Hydrogen peroxide(H2O2) 제거 활성은 Kim 등(2019)의 방법을 통하여 측정하였다. 화살나무 날개 추출물 100 μL와 hydrogen peroxide(Junsei Chemical Co., Ltd) 20 μL를 혼합하여 37°C에서 5분 반응시켰다. 이후 1.25 mM ABTS(Sigma Chemical Co.)와 peroxidase(1 unit/mL, Sigma Chemical Co.)를 30 μL씩 넣어주고 37°C에서 10분간 반응시키고 405 nm에서 흡광도를 측정하였다.
α-Glucosidase 억제 활성은 Kim 등(2008)의 방법을 통하여 측정하였다. 250, 500 및 1,000 μg/mL로 희석한 화살나무 날개 추출물 50 μL α-glucosidase(0.2 unit/mL, Sigma Chemical Co.) 50 μL, 200 mM potassium phosphate buffer(pH 7.0) 50 μL를 각각 혼합하여 10분 동안 37°C에서 반응시켰다. 이후 100 μL의 3 mM p-NPG(p-nitrophenyl-α-D-glucopyranoside)(Sigma Chemical Co.)를 넣고 37°C, 10분간 반응하고, 0.1 M Na2CO3(Junsei Chemical Co., Ltd.) 750 μL를 첨가하여 반응을 정지시키고 405 nm로 흡광도를 측정하였다. Positive control로 1% acarbose를 사용하였으며 저해활성은 control과 비교한 흡광도의 감소비율로 표시하였다.
총폴리페놀 함량은 Folin-Ciocalten 방법(Slinkard과 Singleton, 1997)을 변형해서 측정하였으며 gallic acid (Sigma Chemical Co.)를 이용해서 표준곡선을 만들어 양을 환산하였다. 100 μg/mL로 희석한 화살나무 날개 추출물 5 μL와 증류수 45 μL를 혼합한 뒤, 2 N Folin-Ciocalteu 시약(Sigma Chemical Co.) 5 μL를 넣고 100 μL의 7% Na2CO3(Junsei Chemical Co., Ltd.)를 혼합하여 암소에서 1시간 반응하였다. 흡광도는 UV/Vis-spectrometer (U-1800, Hitachi)를 이용하여 760 nm에서 측정하였다.
총플라보노이드 함량은 Gragaham(1992)의 방법을 변형하여 측정하였으며 100 μg/mL 농도의 화살나무 날개 추출물 20 μL에 10%로 제조한 diethylene glycol(Sigma Chemical Co.) 200 μL와 20 μL의 1 N NaOH(Daejung Chemical Co., Ltd.)를 넣고 37°C에서 1시간 동안 반응시켰다. 이후 420 nm로 흡광도를 측정하였고, quercetin (Sigma Chemical Co.)을 이용해서 표준곡선을 작성하여 총플라보노이드 함량을 정량하였다.
본 실험에 사용한 LNCaP-FGC(human prostate cancer cell), HT-29(human colon cancer cell), B16(mouse melanoma cell), MDA-MB-231(human breast cancer cell), RWPE-1(human prostate epithelial cells)은 American Type Culture Collection(ATCC, Rockville, ND, USA)로부터 분양받아 10% fetal bovine serum (FBS, GIBCO®/InvitrogenTM, Gran Island, NY, USA)과 antibiotic antimycotic(100 unit/mL, GIBCO®/ InvitrogenTM, Gran Island, NY, USA)을 첨가한 DMEM, RPMI1640 및 Keratinocyte-SFM(GIBCO®/InvitrogenTM, Gran Island, NY, USA)을 사용하여 37°C로 맞춘 5% CO2 incubator(SCA-165DS, ASTEC, Fukuoka, Japan)에서 계대배양을 진행하여 실험에 사용하였다.
화살나무 날개 추출물의 암세포 증식 억제능은 sulforhodamine B(SRB, Sigma Chemical Co.) assay를 이용하여 측정하였다. 살아있는 세포 내 단백질의 총량을 흡광도로 측정하여 세포 증식 억제 정도를 확인하는 방법으로, TCA(Sigma Chemical Co.)로 생존 세포를 고정 후 세포 단백질 내 염기성 아미노산 잔기와 SRB를 결합시켜 Tris(Sigma Chemical Co.)를 처리하여 흡광도를 확인한다(Lee 등, 2003). LNCaP, RWPE-1, HT-29, B16 및 MDA-MB-231 세포를 3×104 cells/mL로 48 well plate에 부착시킨 다음 24시간 동안 배양하고 희석한 시료를 넣어 24시간 동안 처리하였다. 이후 12% TCA(Sigma Chemical Co.)를 각 well당 300 μL씩 넣어주고 4°C에서 1시간 동안 고정한 뒤 0.4% SRB(Sigma Chemical Co.) 용액을 넣어 실온에서 30분간 세포 단백질을 염색하였다. 염색이 끝난 뒤 1% acetic acid(Kanto Chemical Co., Inc., Tokyo, Japan)를 이용하여 각 well을 세척하고 10 mM Tris buffer(Sigma Chemical Co.)를 첨가하여 SRB를 녹인 다음 상등액을 96 well plate에 옮겨 담아 540 nm에서 흡광도를 측정하였다.
실험 결과는 3반복에 의한 평균 및 표준편차로 표시하였으며, 각 시료군 간의 유의적인 변화에 대한 통계분석은 GraphPad Prism 5.0(GraphPad Software, San Diego, CA, USA)을 이용하여 one-way ANOVA로 검정하였다. 항산화 활성 및 α-glucosidase 억제 활성의 각 군 간의 통계적 유의성에 대한 검증은 Statistic Analysis System (8.01, SAS Institute Inc., Cary, NC, USA)을 이용하여 Duncan’s multiple range test를 통해 나타내었고(p<0.05), 암세포 증식 억제 활성에 대한 각 군 간의 통계적 유의성에 대한 검증은 Dunnett’s test를 이용하여 판정하였다(*p<0.05, **p<0.01 및 ***p<0.001).
3. 결과 및 고찰
인체 내 산화적 스트레스를 유발시켜 생물학적 손상을 일으키는 free radical에 수소 원자나 전자를 공여하여 안정적인 상태로 전환시키는 것을 항산화능이라고 한다(Kang 등, 2009). DPPH radical은 짙은 보라색을 띠는 비교적 안정한 free radical로서 수소공여능이 뛰어난 시료와 결합할 때 옅은 노란색으로 변화하는 것으로 알려져 있다(Molyneux, 2004). 화살나무 날개 추출물의 전자 공여능을 측정한 결과는 Fig. 1(A)에 나타내었다. Positive control인 0.1% BHT와 0.1% α-tocopherol에서 각각 92.23%, 91.62%로 가장 높은 DPPH radical 소거능을 보였고, 물 추출물 250 μg/mL의 농도에서는 56.12%로 가장 낮은 항산화능을 나타내었다. 하지만 1,000 μg/mL의 농도에서 65.40%의 소거능을 보이며 농도의존적으로 증가하는 경향을 나타냈다. 에탄올과 메탄올 추출물에서 각각 250 μg/mL의 농도에서도 85.0%, 87.06%의 높은 활성을 보였으며, 특히 에탄올 추출물은 1,000 μg/mL의 농도에서 92.10%의 소거능을 보이며 추출물 중 가장 뛰어난 활성을 나타냈다.
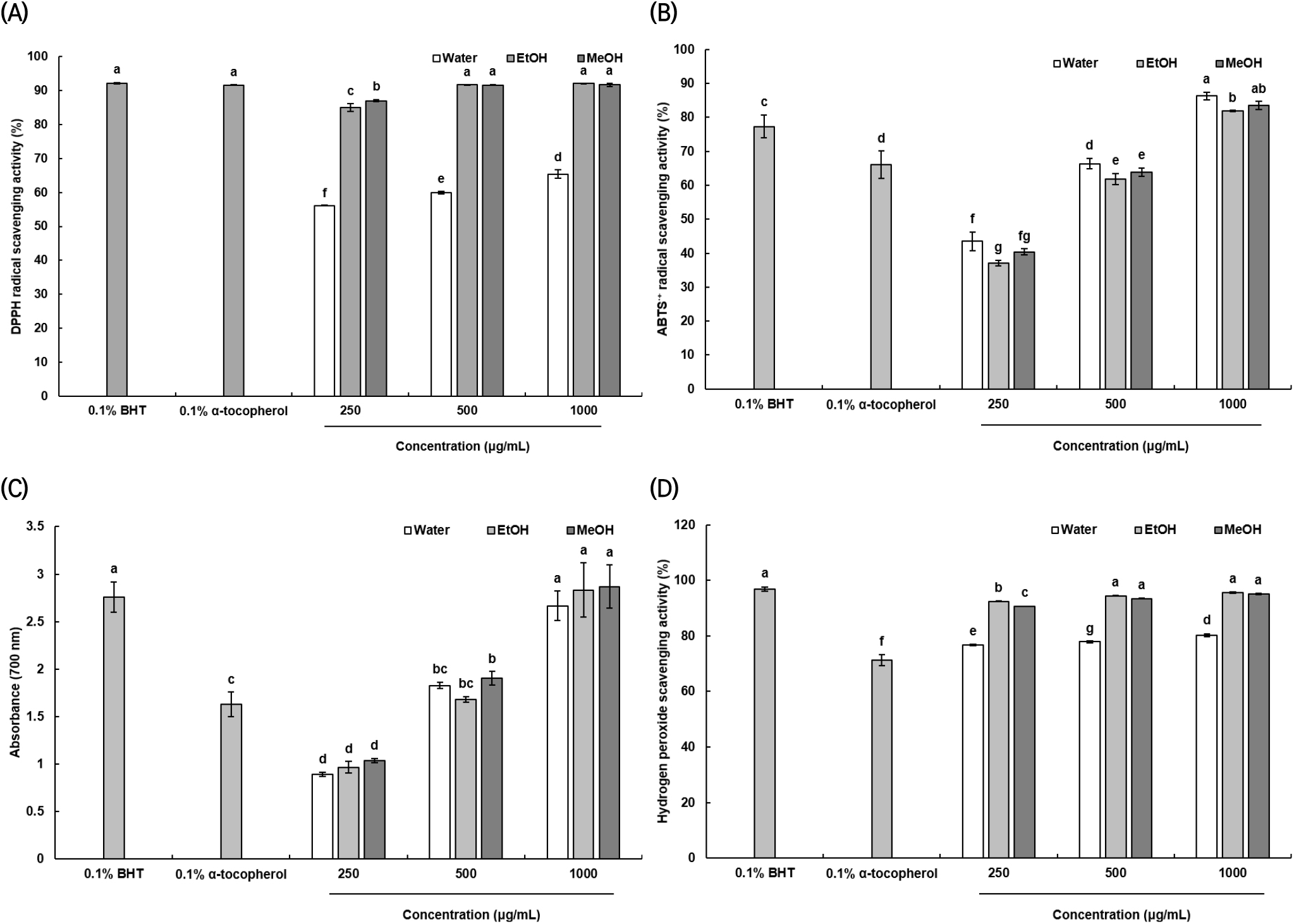
ABTS free radical은 항산화 활성이 있는 시료와 반응하면 특유의 짙은 청록색을 잃고 옅은 푸른색으로 변화하며 이를 이용해 흡광도를 측정하여 항산화 활성을 확인할 수 있다(Re 등, 1999). 물, 에탄올 및 메탄올 추출물의 ABTS radical 소거 활성은 Fig. 1(B)에 나타내었다. 모든 시료가 농도 의존적으로 활성이 증가하는 경향을 보였고, 앞선 DPPH radical 소거 활성 결과와 달리 물 추출물의 효과가 1,000 μg/mL에서 86.27%로 가장 높게 나타났다. 에탄올과 메탄올 추출물은 1,000 μg/mL의 농도에서 각각 81.90%, 83.52%를 나타내었는데, 이는 positive control인 0.1% BHT군(77.32%) 및 0.1% α-tocopherol군(66.04%)보다 높은 활성이 있는 것으로 확인되었다. DPPH radical scavenging 활성이 ABTS•+ radical scavenging 활성과 경향성이 다른 것은 DPPH는 음이온 radical을 생성하고, ABTS는 양이온 radical을 생성하여 결합하는 기질의 특성이 서로 다르고, DPPH는 유기용매에만 가용화되어 친수성 물질의 항산화 효과를 측정할 수 없지만 ABTS는 유기용매 및 수성용매에도 용해되어 시료 내 친유성 및 친수성 추출물의 항산화 활성을 모두 측정할 수 있다는 차이가 있다 (Arnao, 2002; Kwak과 Choi, 2015). 따라서 물 추출물이 에탄올과 메탄올 추출물보다 효과가 좋은 것으로 생각된다.
Reducing power는 금속이온인자인 Fe3+가 항산화능을 가지고 있는 물질과 반응하여 Fe2+로 전환되는 환원력을 측정하는 방법으로 화살나무 날개 추출물의 환원력을 알아본 결과는 Fig. 1(C)와 같다(Meir 등, 1995). 앞의 ABTS•+ radical scavenging 활성과 비슷하게 농도의존적으로 환원력이 증가하는 것으로 나타났으며, 메탄올 추출물의 경우 250, 500 및 1,000 μg/mL의 농도에서 1.04, 1.90 및 2.84로 가장 높은 환원력을 나타내었다. 하지만 1,000 μg/mL의 농도에서 물과 에탄올 추출물 각각 2.67, 2.83으로 메탄올 추출물과 비교하였을 때 환원력의 차이가 크게 나타나지 않았다.
Hydrogen peroxide은 free radical이 아니기 때문에 체내 독성은 낮지만 효소에 의해 활성산소를 생성하여 금속이온과 반응하게 만들어 강한 독성을 가지는 hydroxyl radical을 생성하고 DNA 및 단백질 등을 손상시키는 것으로 알려져 있다(Kang 등, 2002). 화살나무 날개의 hydrogen peroxide 소거 활성 결과는 Fig. 1(D)와 같다. 각 positive control인 0.1% BHT와 0.1% α-tocopherol에서 96.92%, 71.26%의 소거 활성을 확인할 수 있었고, 가장 활성이 높은 에탄올 추출물군에서 250, 500 및 1,000 μg/mL 농도에서 92.44%, 94.45% 및 95.53%를 나타냈으며 메탄올 추출물군에서도 농도별로 90.64%, 93.51%, 95.08%를 기록하여 positive controL와 비슷한 활성을 나타냈다. 또한, 물 추출물군에서는 1,000 μg/mL의 농도에서 80.20%의 소거 활성을 보이면서 전반적으로 뛰어난 hydrogen peroxide 소거 효과가 확인되었다.
Hong 등(2007)은 산겨릅나무 줄기를 유기용매로 추출하였을 때 항산화, 항지질과산화 및 항미생물 활성이 우수하다고 보고하였고, 이는 화살나무 날개 에탄올, 메탄올 추출물의 항산화 활성이 우수한 본 연구의 결과와 유사하였다. Oh 등(2005)은 유기 용매를 이용한 식물체 추출물이 페놀 화합물, alkaloids 및 terpenoids 등의 저분자 화합물에 의하여 항산화능을 가지고 있으며, 열수 추출물로 처리하였을 때에도 주요 구성성분인 단백질 고분자의 다당체에 의하여 항산화능을 띠는 것이라고 보고하였다. 그러므로 화살나무 날개 추출물의 뛰어난 항산화 활성은 페놀화합물, alkaloids 및 terpenoids 등 저분자 화합물 및 단백질 등 고분자의 다당체와 같은 물질과 연관이 있을 것으로 판단된다. 또한, Kim 등(2021)은 항산화 활성을 가지는 선인장 줄기와 열매 추출물이 미백기능, 항당뇨, 주름개선 등의 기능성을 나타낸다고 보고하였다. 따라서 화살나무 날개 추출물의 뛰어난 항산화 활성은 다양한 생리활성과 연관이 있을 것으로 사료된다.
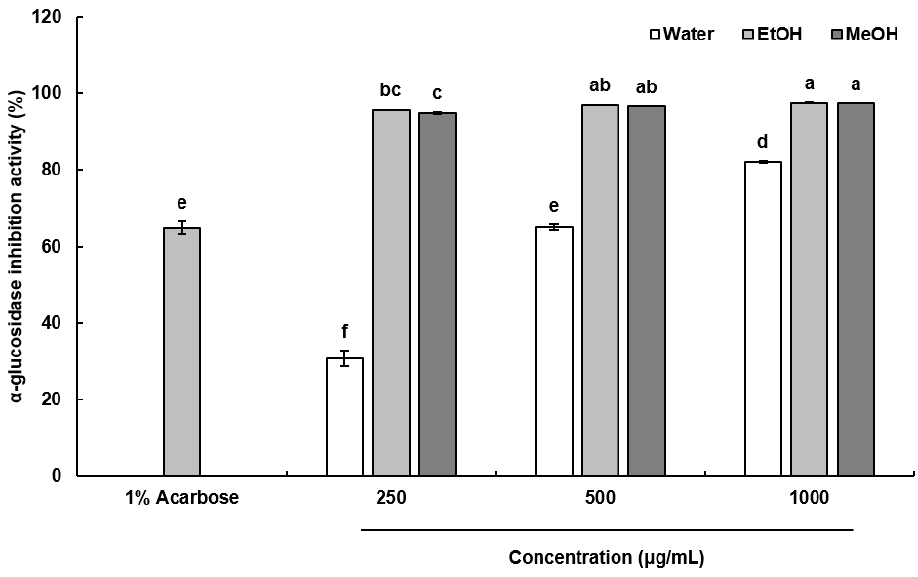
α-Glucosidase가 억제되면 소장 내에 존재하는 당류의 가수분해가 억제되고, 식후 급격한 혈당 상승이 줄어듦으로써 당뇨병을 예방할 수 있다(Kim 등, 2008). 이에 따라 α-glucosidase 억제 활성을 측정하였으며, 결과는 Fig. 2에 나타내었다. Positive control로 사용한 1% acarbose는 64.8%의 억제 활성을 보였고, 물 추출물은 250, 500 및 1,000 μg/mL의 농도에서 30.84, 64.97, 82.17%의 억제 활성을 나타내며 농도 의존적으로 활성이 증가하는 경향을 나타냈다. 특히 에탄올과 메탄올 추출물은 모든 농도에서 90% 이상의 활성을 보이며 매우 높은 α-glucosidase 억제 활성을 나타낸다는 것을 확인할 수 있었다. Kim 등(2022)은 제2형 당뇨 마우스 모델에서 화살나무 추출물이 혈장 내 중성지방 농도를 유의적으로 감소시켰으며, 췌장 내 인슐린 함량을 유의적으로 증가시켰다고 보고하였다. 이는 본 연구결과의 α-glucosidase 억제 활성과 관련이 있는 것으로 생각된다.
페놀성 화합물은 다양한 구조와 분자량을 가지는 2차 대사산물의 하나로서 직 ․ 간접적으로 자유라디칼을 제거하여 항산화, 항균, 항암, 간보호작용 등의 생리활성기능을 가지는 것으로 알려져 있다(Lee 등, 2012). 화살나무 날개 추출물의 총폴리페놀 및 플라보노이드 함량은 Table 1에 나타냈다. 물, 에탄올 및 메탄올 추출물의 총폴리페놀 함량은 613.9, 867.8 및 851.7 mg%이고 총플라보노이드 함량은 547.4, 551.7 및 521.7 mg%로 나타났다. 따라서 에탄올 추출물의 총폴리페놀 및 플라보노이드 함량이 가장 높은 것으로 확인되었다. Oh 등(2005)에 따르면 화살나무 잎 열수추출물의 폴리페놀 함량은 10.6 mg TAE/g으로 화살나무 날개를 이용하여 추출한 본 실험과 비교하여 보았을 때 상당히 많은 폴리페놀 함량을 가지고 있는 것으로 판단되며, 화살나무 날개 추출물의 높은 폴리페놀 및 플라보노이드 함량에 대하여 뛰어난 항산화 활성 및 α-glucosidase 억제 효능을 갖는 것으로 사료된다.
| Sample | Contents (mg%) | |
|---|---|---|
| Total polyphenol(GAE1)) | Total flavonoid(QE2)) | |
| Water | 613.9±17.2 | 547.4±110.6 |
| EtOH | 867.8±25.5 | 551.7±52.8 |
| MeOH | 851.7±16.8 | 521.7±33.0 |
활성산소종의 과도한 생성은 정상조직 및 DNA의 손상을 유도하고 노화나 유전자 돌연변이 등을 일으켜 세포 사멸이 억제되어 암세포로 변이되는 것으로 알려져 있다(Khandrika 등, 2009; Park 등, 2012). 항산화능이 뛰어난 폴리페놀성 화합물이 항암작용을 한다는 내용의 연구가 보고되어 본 연구에서 화살나무 날개 추출물의 여러 가지 암세포 성장 억제 효과에 대하여 알아보았다(Lin, 1995). MDA-MB-231, B16, HT-29, LNCaP 세포를 이용한 SRB assay 결과는 Fig. 3에 나타내었다. 마우스 흑색종 세포인 B16의 경우 각 화살나무 날개 추출물의 모든 농도에서 90% 이상의 세포 생존율을 보여 유의적인 세포 증식 억제 효과를 나타내지 않았다. 반면에 MDA-MB-231 인간 유방암 세포의 경우 물 추출물에서 50 μg/mL의 농도로 처리하였을 때 81.59%의 세포 생존율을 보였고, 같은 농도에서 에탄올 및 메탄올 추출물 각각의 세포 생존율은 51.66%, 59.67%로 비교적 높은 세포 성장 억제능을 나타내었다. 인체 대장암 세포 HT-29에서 에탄올 추출물은 25, 50 μg/mL의 농도에서 각각 84.1%, 19.94%로 낮은 세포 생존율을 나타내었고 다른 용매군인 메탄올 추출물에서도 농도의존적으로 세포 생존율이 감소하는 경향을 보였다. 인간 전립선암 세포인 LNCaP에서는 물, 에탄올 및 메탄올 추출물 각각 50 μg/mL의 농도에서 76.7%, 19.1% 및 31.6%의 세포 생존율을 나타내어 에탄올 추출물의 전립선 암세포 증식 억제능이 가장 뛰어난 것으로 확인되었다. 또한, 화살나무 날개 추출물의 세포 증식 억제능이 암세포에 특이적으로 나타나는지 알아보기 위하여 인간 전립선 상피세포 RWPE-1을 이용하여 세포 생존율을 확인해보았다. 화살나무 날개 추출물 모든 농도에서 90% 이상의 세포 생존율을 보이며 세포 증식에 영향을 미치지 않는 것으로 나타났으므로 화살나무 날개 추출물은 암세포 특이적으로 세포 증식 억제능을 보이는 것으로 사료된다.
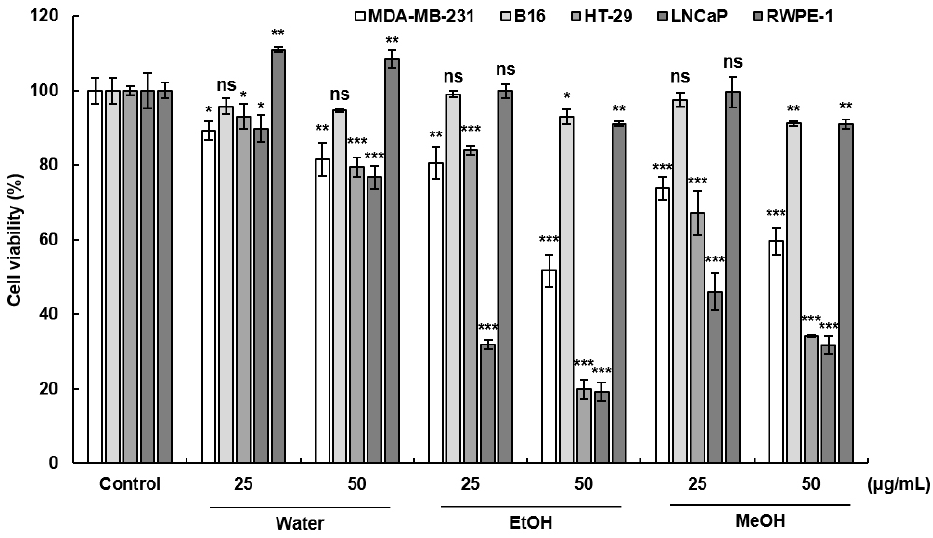
Roleia 등(2015)에 따르면 일반적으로 페놀 화합물의 함량이 높은 추출물은 더 높은 항산화 및 항암활성을 나타내며, Singh 등(2016)에 따르면 식물 유래 phytochemical인 커큐민, 로즈마린산, 퀘르세틴, 루틴 및 쿠마린 등은 항산화 작용을 통해 동물 및 암세포 모델에서 항암효과를 확인했다는 연구결과가 있다. Fan 등(2020)에 따르면 화살나무는 트리테르페노이드, 플라보노이드, 리그난, 스테로이드 및 알칼로이드 등의 기타 화합물을 포함하고 있으며, 이는 항종양, 항염증, 항산화 등의 효과와 같은 약리학적 효과를 발휘한다고 보고하였다. 따라서 본 연구는 화살나무 날개 추출물의 높은 항산화 활성 및 폴리페놀, 플라보노이드 함량이 암세포 증식 억제를 유도한 것으로 생각된다.
