1. 서론
에멀젼(emulsion)은 서로 섞이지 않는 유지와 물이 계면활성제로 인해 연속상(continuous phase)에서 입자의 형태로 분산된 상태를 뜻하며, 에멀젼의 종류는 연속상이 물인 수중유적형 (oil-in-water, O/W)과 유지가 연속상인 유중수적형(water-in-oil, W/O)이 있다(Solans 등, 2005). 대표적인 O/W 에멀젼은 마요네즈, 우유가 있으며, W/O 에멀젼에는 버터, bulk oil 등이 있다(Clark, 2013). 그러나 최근 O/W 에멀전이 W/O 에멀전보다 유지산화에 취약하다는 연구가 보고된 바 있으며(Laguerre 등, 2015), 이는 유지산화가 발생하는 표면적에 기인한 것으로 사료된다(Yi 등, 2018).
실제로 Yi 등(2018)에 따르면 유지산화는 연속상과 입자 표면 사이에서 발생하게 되는데, W/O 에멀젼은 소량의 수분이 함유되어 상대적으로 유지산화가 발생하는 표면적이 적어지는 반면에 O/W 에멀젼의 경우 이들의 표면적이 상대적으로 많아서 유지산화가 잘 일어난다. Lee와 Surh(2021)는 식품산업에 자주 사용하는 콩기름에 수분이 0.002% 함유되어 있음을 보고하였으며, 2016년 농촌진흥청에 의하면 마요네즈는 수분을 1.6% 함유하고 있는 것으로 알렸다. 그렇기 때문에 O/W는 유지산화에 다소 취약하며, 지방식품에서의 산화는 인체에 심혈관, 관상동맥 질환 등을 야기하는 산화물을 발생시킬 뿐 아니라 이취를 생성하여 식품의 전체적인 품질 특성과 저장성을 저하시킨다(Zaghi 등, 2019). 이러한 이유로 유지산화를 억제하고자 유지산화에 취약한 O/W 에멀전에 천연 항산화제를 첨가를 시도하는 다양한 연구가 이루어지고 있다(Al-Maqtari 등, 2021; Cuomo 등, 2020).
육두구 종자(Myristica fragrans, nutmeg)는 육두구나무(Myristica fragrans Houttuyn)의 성숙한 과실의 가종피 및 씨껍질을 벗겨 석회유에 하루 동안 담근 후 자연건조하여 얻은 생약이며, 육류, 도너츠, 과자류, 파운드케익에 첨가하는 향신료로 사용되고 있다(Fleming, 1998). 육두구 종자는 에센셜 오일을 5-15% 함유하며, 강력한 항산화 작용이 관찰된다(Horison 등, 2019; Tan 등, 2013). 하지만 에센셜 오일은 성분이 휘발성이므로 항산화 효능이 합성 화합물에 비해 덜 효과적이며, 육두구 종자의 강력한 항산화 효과를 보이는 항균 화합물은 비극성으로 용해도가 낮으므로 식품 matrix 내에 용해도와 생체이용성을 높이고 안정성을 유지하기 위해 다양한 유화 시스템을 통한 안정성 연구의 필요성이 요구되고 있다(Aisyah 등, 2018; Mohd Narawi 등, 2020). 육두구 종자를 6개월 숙성 시 휘발성 풍미 성분 중 미리스티신과 미리스트산 함량이 현저히 증가한다고 보고되었다(Kim 등, 1989). 한편, 육두구 종자를 아세톤, 에탄올, 메탄올, 부탄올 및 물로 추출한 추출물은 모두 미생물에 대해 상당한 항산화 및 항균 활성을 나타내었으며, 그중 아세톤 추출물이 가장 높은 항산화 활성을 보였다(Gupta 등, 2013). 더욱이 육두구 종자를 7일간 메탄올에 냉침하여 추출한 추출물은 5종의 인체유래 암세포주에 처리한 결과, 항암 효능을 관찰할 수 있었다(Lee 등, 2005). 또한, 딸기의 부패 및 변질을 억제하고, 유통기한과 품질을 유지하기 위해 육두구 종자유를 유화액으로 만들어 딸기의 겉면에 도포한 후 5일간 보관하여 저장성을 평가한 결과, 유화액으로 도포된 딸기가 미생물, 곰팡이, 효모의 증식이 대조군보다 저장 후기에 감소하는 것을 관찰한 바 있다(Horison 등, 2019). 뿐만 아니라 육두구 종자 클로로포름 추출물을 카라게난 유도 마우스에게 경구투여한 결과, 항염증, 진통 및 항혈전 활성이 있었다(Olajide 등, 1999). 따라서 본 연구는 육두구 종자 에탄올 추출물의 항산화 활성을 확인하여, 식물성 유지 및 수중유적형 에멀젼에 육두구 종자 에탄올 추출물의 첨가가 유지산화 안정성을 가지는지를 평가함으로써 유지 식품제조 시 천연 항산화제로서 사용 가능성을 알아보고자 하였다.
2. 재료 및 방법
본 연구는 육두구 종자(육두구, 인도네시아산, 100%)를 시중에서 구매하여 분쇄 후 육두구 종자 원료 20 g과 80% 에탄올 300 mL를 혼합하여 실온에서 6시간 추출하였다. 진탕기(RS-1, JEIO TECH, Daejeon, Korea)로 추출한 육두구 종자 에탄올 추출물(NM80)은 Whatman No. 2 filter paper(Whatman Ltd., Maidstone, Kent, UK)로 여과시킨 후 40°C에서 감압농축하였다. 용매를 제거하여 얻은 추출물은 동결건조(BFD85-F8, Ilshin Biobase, Seoul, Korea)한 후 분말화하여 항산화 활성검정, 유지산화 및 유화액의 안정성 평가의 시료로 사용하였다.
본 연구는 메탄올로 용해한 0.1 mM DPPH(Sigma-Aldrich Co., St. Louis, MO, USA)와 농도별로 희석한 NM80을 각각 0.75 mL, 0.25 mL를 넣고 혼합한 후 암실에서 30분간 반응시켰다(Blois, 1958). 이후 흡광도를 517 nm에서 UV/VIS spectrophotometer(Mega-U6000, Scinco, Seoul, Korea)로 측정하였다. 이를 DPPH 라디칼 저해율(inhibition rate, %)로 나타내어 계산하였다.
DPPHc: 대조군의 흡광도
DPPHs: 시료의 흡광도
ABTS 양이온 라디칼 소거 활성은 7 mM ABTS(Sigma-Aldrich Co.) 수용액과 2.45 mM potassium persulfate (Sigma-Aldrich Co.)를 동량으로 혼합하여 상온 암실에서 16시간 동안 양이온을 형성한 후 흡광도가 734 nm에서 0.700(±0.050)이 되도록 에탄올로 희석시켜 사용하였다(Fellegrini 등, 1999). ABTS 양이온 용액과 농도별로 희석한 NM80을 각각 950 μL, 50 μL 혼합하였다. 흡광도는 혼합물을 10분간 상온 암실에서 방치한 후 734 nm에서 UV/VIS spectrophotometer(Mega-U6000, Scinco)로 측정하였다. 이를 다음의 식과 같이 ABTS 양이온 저해율(inhibition rate, %)로 나타내어 계산하였다.
ABTSc: 대조군의 흡광도
ABTSs: 시료의 흡광도
ORAC법은 시료와 시약의 제조에 75 mM phosphate buffer(pH 7.0)를 사용하였다. 96-well plate에 희석한 NM80, 0.1 mM fluorescein 용액, 300 mM 2,2’azo-bis (2-amidino-propane) dihydrochloride(AAPH)(Fujifilm Wako Pure Chemical Co., Osaka, Japan)를 순서대로 각각 50 μL, 150 μL, 50 μL를 분주하였다(Zulueta 등, 2009). 40분간 fluorescence microplate reader (GeminiXPS, Moleculardevice, San Jose, CA, USA)로 측정하였으며, 양성대조군은 trolox(Sigma-Aldrich Co.)를 사용하였다.
NM80의 TPC는 추출 시료 용액, 증류수, 증류수와 동량으로 희석한 Folin-Denis 시약(Sigma-Aldrich Co.)를 각각 순서대로 50 μL, 800 μL, 50 μL 혼합하여 5분간 정치하였다(Folin과 Denis, 1912). 혼합용액에 sodium carbonate (Sigma-Aldrich Co.) 100 μL 첨가하여 균질화한 후, 상온 암실에서 30분 동안 반응시켜 725 nm로 맞춘 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 사용하여 측정하였다. 총페놀 함량은 tannic acid(Sigma-Aldrich Co.)를 표준물질로 μmol tannic acid equivalent/g extract로 나타내었다.
NM80의 TFC 측정에 사용한 10% aluminum chloride hexahydrate(Sigma-Aldrich Co.)와 1M potassium acetate(Sigma-Aldrich Co.)는 증류수로 제조하였으며, NM80, 에탄올, 10% aluminum chloride hexahydrate, 증류수를 각각 100 μL, 300 μL, 200 μL, 560 μL 혼합한 후 1M potassium acetate 20 μL 첨가하여 30분간 암실에서 반응하였다(Sava와 Sibru, 2010). 이후 흡광도는 415 nm에서 UV-VIS spectrophotometer(Mega-U600, Scinco)로 측정하였으며, TFC는 quercetin(Sigma-Aldrich Co.)을 표준물질로 μmol quercetin equivalent/g extract로 나타내었다.
FRAP assay는 300 mM sodium acetate buffer (Sigma-Aldrich Co.) 100 mL, 10 mM 2,4,6-tripyridyl-S-triazine 용액 1 mL, 20 mM FeCl3(Sigma-Aldrich Co.)를 1 mL를 혼합하여 FRAP 수용액을 제조하였으며, FRAP 수용액은 37°C 수조에서 평형시켜 사용하였다(Benzie과 Strain, 1996). FRAP 수용액 900 μL에 추출 시료 용액을 30 μL 혼합한 후 30분간 반응시켜 593 nm의 UV/VIS spectrophotometer(Mega-U6000, Scinco)로 흡광도를 측정하였다. FRAP 환원력은 표준물질로 ascorbic acid(Sigma-Aldrich Co.)를 사용하여 μmol ascorbic acid equivalent/g extract로 나타내었다.
유지 시료는 교질화를 위해 옥수수기름(Ottogi, Anyang, Korea)에 NM80을 dimethyl sulfoxide(DMSO)(Sigma-Aldrich Co.)에 녹여 200, 1,000 ppm이 되도록 첨가하여 사용하였고, 대조군은 DMSO를 첨가하여 산화에 미치는 영향을 관찰하고자 하였다. 제조된 시료의 보관은 유지의 산화를 방지하기 위하여 냉장상태를 유지하였다.
CDA는 15 mL isooctane(Sigma-Aldrich Co.)에 유지 시료가 4,000 ppm이 되도록 분산시킨 후, AOCS법(1980)에 의해 233 nm에서 UV/VIS spectrophotometer (Mega-U6000, Scinco)로 측정하고, 다음의 식으로 계산하였다.
As: 시료군의 흡광도
b: Cuvette의 길이(cm)
c: L당 시료의 무게(g)
ρ-AV는 AOCS법(1990)에 따라 15 mL isooctane (Sigma-Aldrich Co.)에 유지 시료가 4,000 ppm이 되도록 분산시킨 후, 혼합물과 0.25% ρ-anisidine(Sigma-Aldrich Co.) 용액을 각각 1.5 mL, 0.3 mL 혼합하여 15분간 암실에서 반응시켰다. 흡광도는 350 nm에서 UV/VIS spectrophotometer(Mega-U6000, Scinco)로 측정하였으며, 아래의 식으로 ρ-AV를 계산하였다.
Ab: Anisidine 시약과 시료군이 반응하기 전의 흡광도
As: Anisidine 시약과 시료군이 반응한 후의 흡광도
W: 취한 시료의 무게(g)
TBA는 유지 시료 1.5 g에 benzene 5 mL를 가하여 용해시킨 후 10분간 방치하였다. 이후 TBA 시약 5 mL를 과산화 지질의 대사물질인 MDA와 반응시켰다(Buege와 Aust, 1978). 대조군은 유지 시료를 증류수로 대체하였으며, 상층액이 제거된 반응물을 시험관으로 이동시켜 30분간 100°C water bath에서 중탕한 후 냉각시켰다. 흡광도는 532 nm에서 냉각시킨 반응액을 측정하였으며, 아래의 식을 사용하여 TBA로 환산하였다.
Ac: 대조군의 흡광도
As: 시료군의 흡광도
수중유적형 유화액은 블렌더(HB501, Tefal, Haute-Savioe, France)를 이용하여 Tween 20(Sigma-Aldrich Co.), 옥수수유, 증류수를 각각 0.25 : 2.5 : 97.25 비율로 혼합하여 3분간 균질하였다(Kim 등, 2017). 유화액의 균질화는 NLM 100 Nano Disperser(Young-Jin Co., Gunpo, Korea)를 이용하였다. 이후 DMSO에 녹인 시료들을 유화액에 200 ppm 농도로 분주하여 혼합해 주었다. 제조한 유화액 2 mL를 10 mL vial(19 mm×56 mm ID; SL. Vi1211, Scilab, Seoul, Korea)에 분주하여 60°C 오븐에서 산화되도록 1, 2, 3, 4일 동안 방치하였다. 대조군은 시료를 첨가하지 않은 DMSO를 같은 양을 분주하여 제조하였다.
헤드스페이스 산소 함량은 분석에 GC-TCD(Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하였으며, air-tight syringe를 이용하여 시료의 헤드스페이스 가스 50 μL를 60/80 packed column(3.0 m×2 mm ID; Restek Ltd., Bellefonte, PA, USA)과 thermal conductivity detector가 장착된 Hewlett-Packard 7080 GC로 주입하고 이동상으로는 헬륨 가스를 10 mL/min 속도로 주입하였다(Kim 등, 2010). 오븐, 인젝터, 검출기의 온도는 180°C로 설정하였다.
CDA 측정은 유지시료와 methanol/1-butanol(2:1, v/v)를 각각 120 μL, 2.7 mL 혼합하여 233 nm에서 UV-VIS spectrophotometer(Mega-U600, Scinco)로 흡광도를 측정하였다(Mei 등, 1998).
고체상 미량 추출(SPME)법으로 휘발성 물질을 분리하였으며, 불꽃 이온화 검출기(flame ionization ditector, FID)가 설치된 GC(Hewlett-Packard 6890, Agilent Technology, Palo Alto, CA, USA)를 이용하여 휘발성 물질을 분리하였다(Kiralan, 2012). SPME fiber는 65 μm polydimethylsiloxane/divinylbenzene(Supelco, Bellefonte, PA, USA)을 사용하였으며, HP-5(30 m×0.32 mm ID, 0.25 mm film, Agilent Technology) 칼럼을 고정상으로 이용하였다. 기기의 온도 조건은 2분 동안 50°C에서 방치한 후 120°C로 상승시켰으며, 주입기의 온도는 220°C, 검출기의 온도는 300°C로 고정하였다. GC-mass spectrometry(5971A, Agilent Technology)를 이용하여 휘발성물질을 동정하였으며, 0.8 mL/min 속도로 헬륨가스를 이동상으로 사용하였다. 추출 조건은 GC-FID와 동일하게 사용하였으며 MS분석 조건은 70 ev, 220 ion source 온도를 사용하였다. 질량 스펙트럼 라이브러리(mass spectra library)와 머무름 시간(retention time)을 사용하여 휘발성 물질을 분석하였다.
3. 결과 및 고찰
육두구 종자 에탄올 추출물의 라디칼 소거 활성의 결과는 Fig. 1에 나타내었다. NM80을 12.5, 25, 50, 100, 200, 400, 800, 1,000 μg/mL 농도로 제조하여 DPPH 라디칼 소거 활성을 관찰한 결과, 각각 8.1, 12.5, 20.9, 35.1, 62.8, 92.2, 92.5, 92.8%로 측정되었으며, ABTS 양이온 라디칼 소거 활성은 각각 0.7, 2.7, 6.5, 30.5, 29.8, 49.4, 81.3, 97.5%의 라디칼 소거 활성을 나타내어 농도 의존적으로 증가하는 것으로 관찰되었다(p<0.05). 특히 육두구 종자를 에탄올로 추출하여 DPPH 라디칼 소거 활성을 측정한 연구에서 육두구 종자 에탄올 추출물의 DPPH 라디칼 소거 활성이 농도 의존적인 증가를 보고하였다(Gupta 등, 2013). 또한, 육두구 종자를 껍질, 과육, 메이스, 종자로 분리하여 메탄올로 추출하고, ABTS 양이온 라디칼 소거 활성을 측정한 연구에서 육두구 종자는 다른 부위에 비해 가장 우수하였음을 보고하였다(Tan 등, 2013).
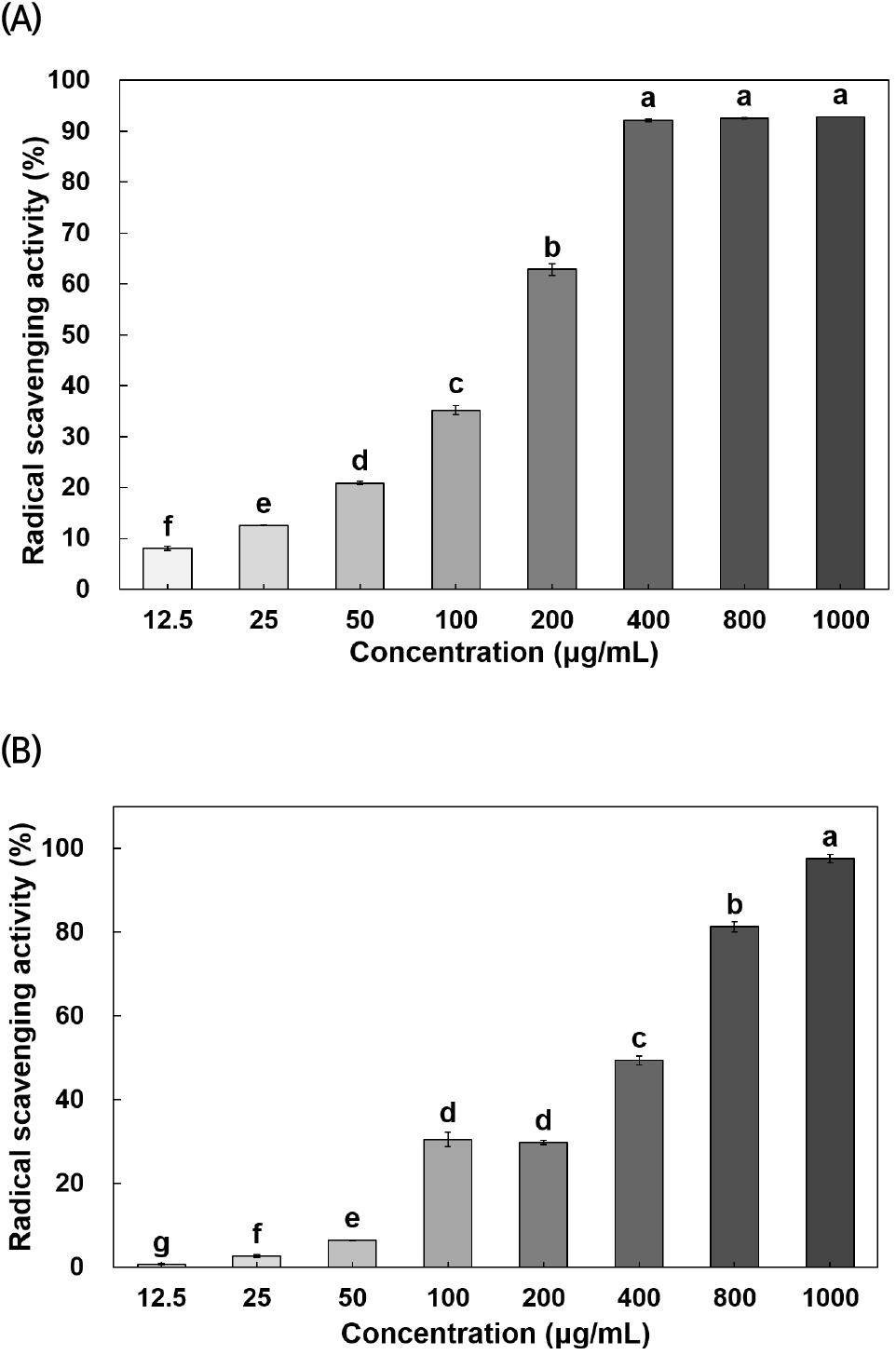
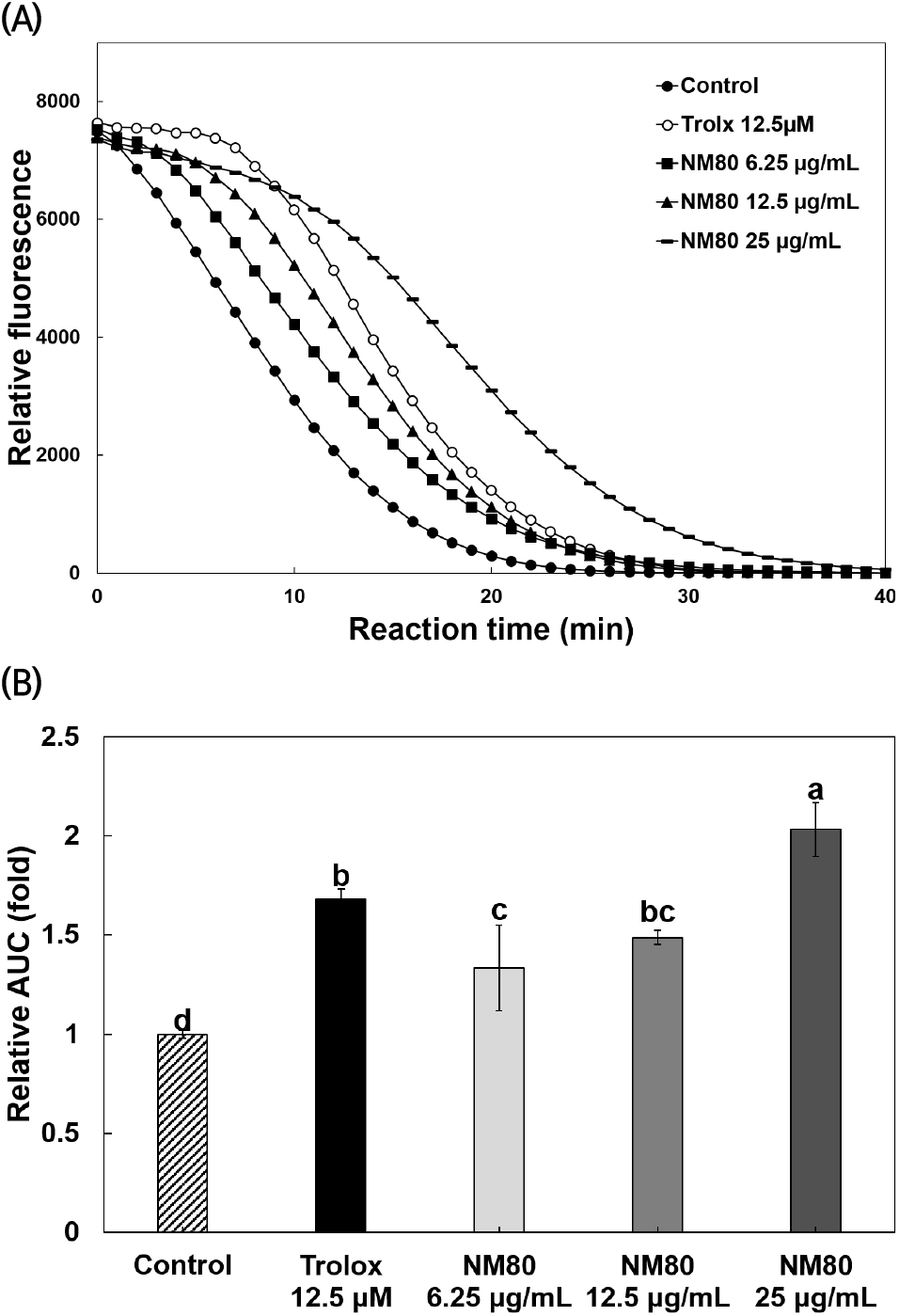
Fig. 2(A)는 육두구 종자 에탄올 추출물을 6.25, 12.5, 25 μg/mL 농도로 희석하여 나타낸 것으로 농도 의존적인 경향을 보였다. Fig. 2(B)는 대조군에 비해 trolox 12.5 μM 처리군에서 1.7배, 육두구 종자 에탄올 추출물 25 μg/mL 농도에서 대조군에 비해 약 2.0배 높게 나타났다(p<0.05). Su 등(2007)은 육두구 종자를 80% 메탄올로 추출하여 ORAC을 측정한 결과, 육두구 종자가 흑후추, 로즈힙, 계피보다 가장 높은 항산화 활성을 나타내었다고 보고하였다. 또한, Khatun 등(2006)은 100°C로 6시간 열처리한 16가지 향신료의 퍼옥시 라디칼 소거 활성을 측정한 결과, 육두구 종자가 생강, 펜넬(fennel), 훼누그릭(fenugreek), 카르다몸(cardamom)보다 퍼옥시 라디칼 소거 활성이 가장 우수하였다고 보고하여, 이는 본 연구결과가 선행연구와 일치함을 알 수 있었다.
육두구 종자 에탄올 추출물의 TPC, TFC 및 FRAP 환원력의 결과는 Table 1에 나타내었다. TPC, TFC, FRAP 환원력은 각각 33.74 μmol tannic acid equivalent/g extract, 0.13 μmol quercetin equivalent/g extract, 295.27 μmol ascorbic acid equivalent/g extract로 나타났다. Kong 등(2010)은 육두구 종자를 에탄올 추출하여 TPC를 측정한 결과 로즈마리와 유사하였으며 펜넬, 오레가노보다 우수한 활성을 나타내었다고 보고하였다. 더욱이 Gupta 등(2013)은 육두구 종자를 에탄올, 메탄올, 부탄올 및 물로 추출하여 TPC를 측정한 결과, 메탄올, 부탄올, 물 추출물보다 에탄올 추출물이 TPC가 높았으며, TPC와 항산화 활성은 유의하게 양의 상관관계가 있는 것으로 보고하였다. 또한, Su 등(2007)은 육두구 종자와 흑후추를 80% 메탄올로 추출하여 TPC를 측정한 결과, 육두구 종자가 흑후추보다 가장 우수한 것으로 보고하였다. 따라서 선행연구와 같이 본 연구에서도 육두구 종자 에탄올 추출물의 TPC와 TFC가 FRAP 환원력에 영향을 미쳤을 것으로 판단된다.
| TPC1) (μmol tannic acid equivalent/g extract) | TFC2) (μmol quercetin equivalent/g extract) | FRAP3) (μmol ascorbic acid equivalent/g extract) |
|---|---|---|
| 33.74± 2.06 | 0.13± 0.01 | 295.27±5.94 |
유지가 산화되는 과정 중 초기 산화 지표인 공액 이중결합을 측정하는 CDA의 결과는 Fig. 3(A)에 나타내었다. 시료를 첨가하지 않은 대조군을 180°C에서 0, 30, 60, 90분 동안 산화시킨 후 CDA 측정 결과, 각각 0.23, 0.36, 0.53, 0.71%로 가열이 길어질수록 유의적으로 증가하였다. 유지시료에 NM80 200, 1,000 ppm을 각각 첨가하여 180°C에서 0, 30, 60, 90분 동안 산화시킨 CDA가 결과 NM80 200 ppm에서 각각 0.23, 0.38, 0.55, 0.69%로 관찰되었고, NM80 1,000 ppm에서는 각각 0.24, 0.38, 0.56, 0.69%로 나타났다. 유지에 NM80 200, 1,000 ppm 처리한 후 30분 가열할 경우, 대조군에 비해 각각 6.00%씩 증가하는 것을 관찰할 수 있었으며, 60분 가열할 경우 대조군에 비해 각각 2.51, 5.58% 증가하는 것으로 관찰되었다. 또한, NM80 200, 1,000 ppm 처리한 유지는 90분 가열할 경우 대조군에 비해 각각 3.26, 3.26% 유의적으로 감소하는 것으로 나타났다(p<0.05). 따라서 30, 60분에서 모든 농도의 NM80은 대조군보다 CDA가가 증가한 것을 확인할 수 있었으며, 90분에서 모든 농도의 NM80은 대조군보다 유의적으로 감소되어 일차 산화 생성물을 억제하는 것으로 관찰되었다. Yang 등(2020)은 열처리 동안 5종의 허브 및 향신료 오일을 팜 오일에 첨가하여 5일간 팜 오일의 안정성을 조사한 결과, 육두구 종자 오일이 다른 첨가물에 비해 가장 높은 산화 안정성을 나타내었으며, 육두구 종자 오일의 농도가 높을수록 열처리 중 오일 산화 방지가 우수하였다고 보고하였다. 또한, Wang 등(2020)은 해바라기유에 육두구 종자 에센셜 오일을 첨가하여 180°C에서 30시간 가열하여 일차 산화물을 측정하여, 육두구 종자 에센셜 오일을 첨가하지 않은 대조군에 비해 CDA가가 감소하였으며, 합성 항산화제인 BHA와 BHT보다 낮은 CDA가를 관찰하였다고 보고하였다. 이와 유사하게 Muzolf-Panek 등(2019)은 올스파이스, 베이 리프, 블랙씨드, 캐러웨이, 카다멈, 정향, 육두구 종자를 에탄올로 추출하여 추출물들을 다진 생 돼지고기에 첨가하여 냉장 보관하여 산화 지표물의 변화를 조사한 결과, 모든 추출물 중 육두구 종자 추출물이 다진 생돼지고기에서 CDA의 형성을 가장 효과적으로 감소시켰다고 보고하였다. 따라서 본 연구는 선행 연구와 유사하게 유지산화 시 발생되는 일차 산화물인 CDA가 생성이 육두구 종자 에탄올 추출물 처리에 따라 억제되는 것을 관찰할 수 있었다.
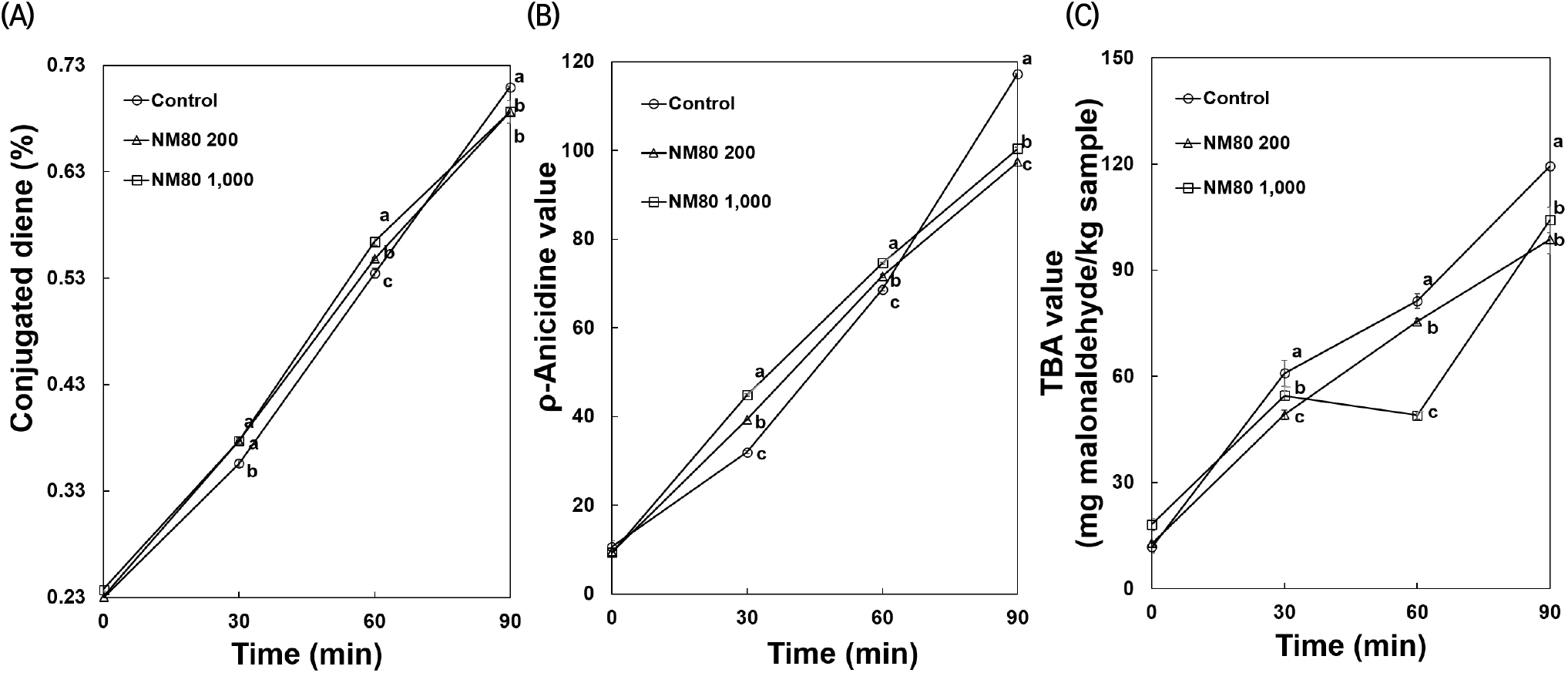
유지가 산화되는 과정 중 이차 산화물의 함량을 측정하는 ρ-AV, TBA의 결과는 Fig. 3(B)와 Fig. 3(C)에 나타내었다. CDA와 동일한 방법으로 180°C에서 0, 30, 60, 90분 동안 산화시킨 결과, NM80을 첨가하지 않은 대조군의 ρ-AV는 각각 10.62, 31.97, 68.65, 117.28로 가열 시간이 길어질수록 유의적으로 증가하였다. NM80 200 ppm에서 각각 9.45, 39.28, 71.65, 97.42로 관찰되었고, NM80 1,000 ppm에서는 각각 9.35, 44.87, 74.62, 100.42로 측정되었다. 유지에 NM80 200, 1,000 ppm 처리하여 30, 60분 가열한 경우 대조군에 비해 증가하는 경향을 보였으며, 90분 가열한 경우 대조군에 비해 각각 16.94, 14.38% 유의적으로 감소하는 것으로 관찰되었다(p<0.05). 또한, 180°C에서 0, 30, 60, 90분 동안 산화시킨 결과, NM80을 첨가하지 않은 대조군의 TBA는 각각 11.80, 60.90, 81.30, 119.40으로 가열 시간이 길어질수록 유의적으로 증가하였다. NM80 200 ppm에서 각각 12.80, 49.20, 75.50, 98.70으로 관찰되었고, NM80 1,000 ppm에서는 각각 18.20, 54.60, 49.00, 104.20으로 측정되었다. 유지에 NM80 200, 1,000 ppm 처리하여 30, 60, 90분 가열한 경우 대조군에 비해 감소하는 경향을 보였으며, 특히 90분 가열한 경우 대조군에 비해 각각 17.34, 12.73% 유의적으로 감소하는 것으로 관찰되었다(p<0.05). 따라서 90분에서 모든 농도의 NM80은 대조군보다 ρ-AV, TBA가 유의적으로 감소한 것을 확인할 수 있었으며, 특히 200 ppm에서 대조군보다 각각 16.94, 17.34% 감소되어 이차 산화 생성물을 억제하는 것으로 나타났다. Muzolf-Panek 등(2019)은 육두구 종자를 에탄올로 추출하여 추출물들을 생돼지고기에 첨가하여 냉장 온도에서 저장 중 이차 산화물의 변화를 조사한 결과, 저장 기간이 증가될수록 육두구 종자 추출물은 대조군에 비해 생돼지고기의 이차 산화물의 형성이 억제되었다고 보고하였다. 유사하게 Tanabe 등(2002)은 22가지의 허브와 향신료를 돼지고기 균질액에 첨가하여 이차 산화물의 양을 TBA값으로 나타낸 결과, 육두구 종자 추출물을 처리한 돼지고기 균질물의 TBA값이 캐러웨이, 딜, 회향 추출물보다 유의하게 낮았다고 보고하였다. 또한, Šojić 등(2015)은 소시지에 0.01% 및 0.02%의 농도로 육두구 종자 에센셜 오일을 첨가하여 산화 지표물을 조사하여 TBA에서 육두구 종자 에센셜 오일을 0.01% 및 0.02%의 농도로 첨가한 군이 육두구 종자 에센셜 오일을 첨가하지 않은 대조군에 비해 유의하게 감소하였다고 보고하였다. 따라서 본 연구에서 대조군보다 육두구 종자 에탄올 추출물 처리가 유지의 이차 산화물인 알데하이드와 말론 알데하이드 생성을 억제하는 것을 관찰할 수 있었다.
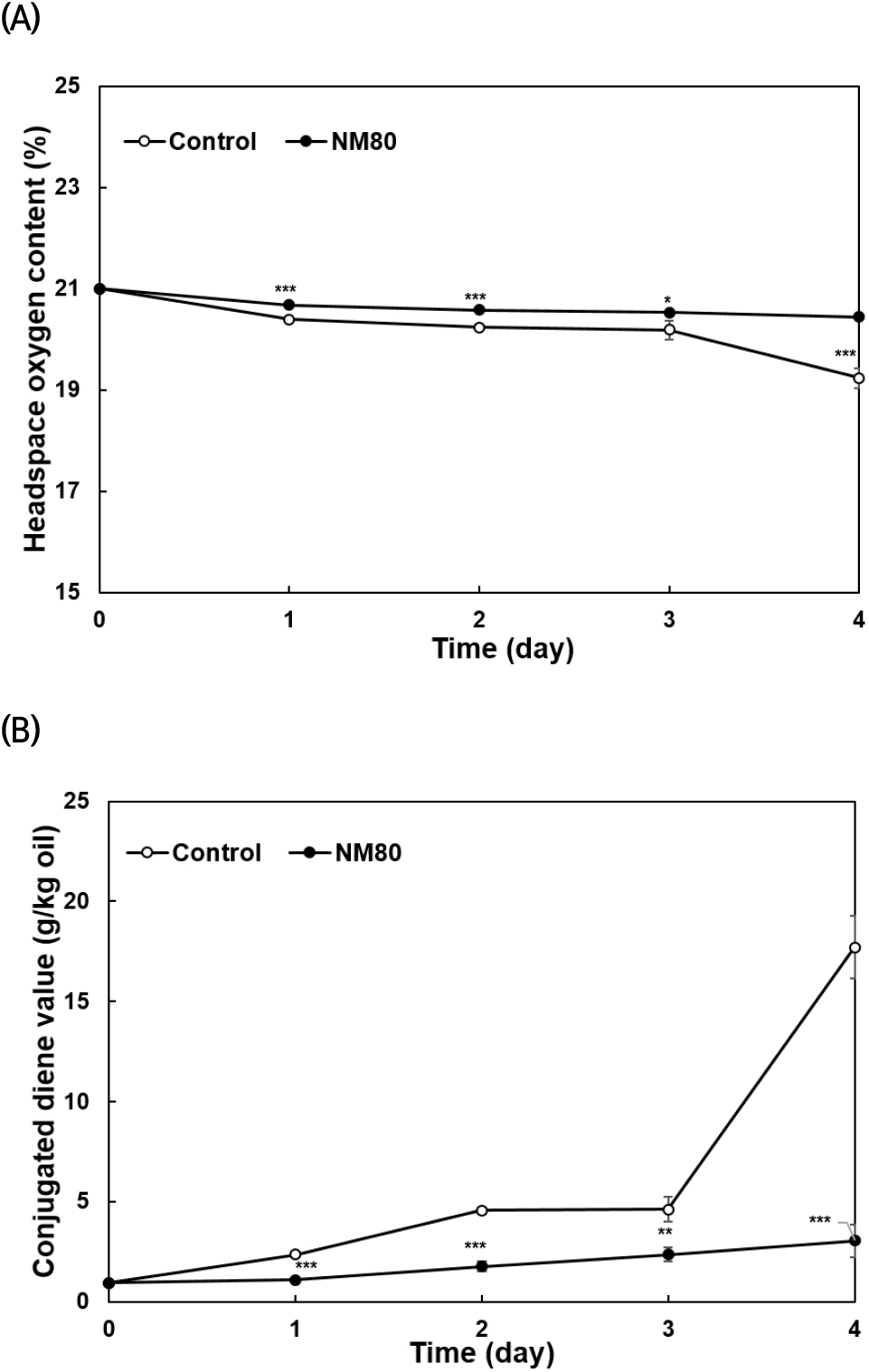
육두구 종자 에탄올 추출물 처리가 유화액 저장 기간 중에 함유되어 있는 헤드스페이스의 산소 함량과 초기 산화 지표인 CDA가에 미치는 영향은 Fig. 4에 나타내었다. 제조한 유화액을 60°C에서 0, 1, 2, 3, 4일 동안 산화시킨 후 NM80을 첨가하지 않은 대조군의 헤드스페이스는 각각 21.00, 20.40, 20.24, 19.23%로 측정되어, 저장 기간이 증가될수록 헤드스페이스의 산소 함량이 감소되는 것을 관찰할 수 있었으며, NM80을 넣은 에멀션은 각각 21.00, 20.68, 20.58, 20.53, 20.44%로 관찰되었다(Fig. 4(A)). 시료가 첨가되지 않은 대조군을 0, 1, 2, 3, 4일간 산화시킨 결과 대조군의 CDA가는 각각 0.94, 2.36, 4.56, 4.62, 17.71 g/kg oil로 측정되었으며, NM80 첨가군에서는 각각 0.94, 1.08, 1.76, 2.35, 3.04 g/kg oil로 관찰되었다(Fig. 4(B)). 0, 1, 2, 3, 4일에서 헤드스페이스는 NM80이 대조군보다 각각 1.39, 1.67, 1.72, 6.29% 유의적인 감소가 관찰되었으며, CDA가의 경우 대조군보다 각각 53.98, 61.37, 49.07, 82.85% 유의적으로 감소되었다(p<0.05). 특히 저장 기간이 증가될수록 NM80을 첨가한 에멀션은 대조군보다 유의적으로 산소 소비율이 감소하였으며, 헤드스페이스의 산소 함량과 마찬가지로 저장 기간이 증대됨에 따라 NM80을 첨가한 에멀션은 대조군보다 감소되는 것을 관찰할 수 있었다. Mohd Narawi 등(2020)은 육두구 종자 오일이 첨가된 나노에멀션을 제조하여 24시간 후 상 분리를 관찰한 결과, 안정하고 균일한 에멀젼을 관찰하였다고 보고하였다. 더욱이 육두구 종자유 나노에멀션을 이용하여 식용필름을 제조한 후 두 가지 유형의 박테리아에 처리한 결과, 박테리아의 성장을 억제한다고 보고된 바가 있다(Aisyah 등, 2018). 저장 기간이 증가함에 따라 유지가 산화되어 지속적으로 산소가 증가하며 과산화물가가 증가한다고 알려져 있다(Chung 등, 2004). 하지만 본 연구에서 에멀션 상태로 저장 기간이 증가될수록 헤드스페이스의 산소 함량이 유지되는 결과와 초기 산화 지표인 공액 이중결합이 대조군보다 감소하는 것에 기인하여 유지의 산화가 대조군보다 감소하는 것을 관찰하였다. 하지만 이는 NM80이 유지의 산화를 억제시킨 것으로 사료된다. 따라서 본 연구는 육두구 종자 에탄올 추출물을 첨가한 유화액의 안정성과 지질에서의 산화를 방지하는 것을 관찰하여 천연 항산화제로서의 가능성을 확인하였다.
GC-MS를 이용하여 NM80의 휘발 성분을 분석한 결과는 Table 2에 나타내었다. NM80은 알릴 페녹시아세테이트(allyl phenoxyacetate), 유제놀 아세테이트(eugenol acetate), 유제놀(eugenol) 등 성분이 분석되었다. 육두구 종자의 전체 휘발 성분 중 알릴 페녹시아세테이트, 유제놀 아세테이트, 유제놀이 각각 59.11, 12.06, 5.24%로 주요 휘발성 성분으로 관찰되었다. 알릴 페녹시아세테이트는 알릴 에스테르로 향수와 화장품 산업에서 자주 사용되며, 알릴 에스테르는 종종 특정 비율의 유리 알릴 알코올을 함유하여 피부 자극을 감소시키는 것으로 알려져 있다(Politano 등, 2006). 또한, 유제놀 아세테이트와 유제놀은 정향의 성분이며, 향균 활성과 항산화 능력이 우수하다고 보고되었다(Gökalp, 2016; Nassar 등, 2007). 특히 유제놀은 정향, 바질, 계피, 레몬 밤, 육두구 종자와 같은 특정 식물에서 발견되는 화합물로, GC-MS를 이용한 연구에서 육두구 종자 에센셜 오일 중 유제놀이 검출되었으며, 더욱이 육두구 종자 에센셜 오일에서 미리스트산, 유제놀, 이소유제놀, 피넨, 캄펜, 리날로올, 게라니올 및 사프롤이 검출되었다고 보고하였다(Janssens 등, 1990; Pavithra, 2014; Power와 Salway, 1907). 또한, Kim 등(1989)은 숙성에 따른 육두구 종자의 향기성분을 분석하였는데, 저장기간이 증가될수록 유제놀은 유의적으로 증가되었다고 보고하였다. 더욱이 Rasheed 등(1984)은 육두구 종자 오일의 많은 구성성분의 약리학적 활성을 시험관 내에서 조사한 결과, 유제놀과 이소유제놀이 가장 강력한 화합물임을 관찰하였다. Kabuto 등(2007)은 유제놀을 마우스에게 투여하고 마우스의 선조체에서 6-하이드록시도파민으로 유도된 도파민 감소에 미치는 영향을 조사하여 유제놀의 투여가 철이온에 의해 유도된 지질 과산화의 지표를 감소시켰고, 선조체에서 글루타티온 및 L-아스코르브산염을 증가시켜 지질의 산화를 간접적으로 방지하였다고 보고하였다. Perez-Roses 등(2016)은 순수 화합물인 티몰, 카바크롤, 유제놀의 항산화 활성에 대해 조사한 결과, 순수 화합물 중 유제놀이 강력한 DPPH 라디칼 소거 활성을 나타내었고, 인간의 활성 산소 종 생성을 강력하게 억제하였다고 보고하였다. 따라서 선행연구에 따르면 육두구 종자 에탄올 추출물의 휘발성분이 에센셜 오일과 정향에서 검출되는 휘발성분으로서 이러한 성분이 항산화 활성과 유지 및 유화액의 산화 안정성에 영향을 미친 것으로 판단된다.
