1. 서론
Bacillus subtilis로 발효시킨 청국장은 간장, 된장 등 장류 식품들과 달리 발효 기간이 짧다(Ryu 등, 2007). 발효 과정 중 B. subtilis는 펩톤, 펩타이드, 아미노산, 당 및 유기산과 같은 대사산물을 생성하며 대두의 활성을 증가시키고, 이러한 작용으로 새로운 기능적 대사산물의 생산과 최종 생성물의 관능 특성을 향상시키는 것이 보고되었다(Chen 등, 2022; Jeon 등 2018). 또한, 무염 발효이기 때문에, 발효 시 암모니아 취와 생체아민이 발생한다. 그 고유의 향은 단백질 함량이 높은 식품이 발효될 때 미생물에 의해 생성되는 휘발성 아민에 의해 발생하며 생체아민은 염기성 질소 화합물로 일반적으로 아미노산을 전구체로 하여 탈카르복실화되어 형성된다(Moon 등, 2015).
Surfactant는 물-기름 간의 표면장력을 감소시키는 양친매성 화합물 종류 중 하나로(Singh 등, 2019) 식음료, 첨가물, 약품 산업 등 넓은 분야에서 사용된다(Rang, 2009). Surfactant는 chemical-surfactant와 bio-surfactant로 구분할 수 있는데, chemical-surfactant는 석유를 원료로 하여 화학적으로 합성하였기 때문에 응용범위가 넓지만(Makkar 등, 2011), 폐기할 시 독성과 생분해가 불가능해 토양오염이 발생한다(Lee와 Park, 2011; Yang, 2001). 이에 반해, bio-surfactant는 박테리아, 효모 등 생물학적 시스템을 기원으로 생성되었으며(Rahman 등, 2021), 생분해성(Joshi 등, 2008), 낮은 독성(Chen 등, 2015), 생체 적합성, 소화성을 띤다(Makkar와 Cameotra, 1997; Md, 2012). 생리학적 기능으로는 미생물에 대한 항바이러스, 항진균, 혈전 용해, 항마이코플라즈마와 같은 특성이 있으며, 임계 미셸 농도 미만에서 강력한 막 불안정화 작용을 나타낸다(Carrillo 등, 2003). Surfactin은 1968년 Bacillus 속 균주가 생산하는 다양한 생리활성 펩타이드 중 B. subtilis 배양액에서 처음 발견되었다(Chen 등, 2012). 아미노산 7개(Glu-Leu-Leu-Val-Asp-Leu-Leu)와 13-15개의 탄소 원자로 구성된 소수성 부분이 β-하이드록시 지방산에 연결된 헵타 펩타이드로 고리형 락톤 구조를 형성하고 있으며(Alvarez 등, 2012; Datta 등, 2022), 청국장 제조 과정 중 B. subtilis의 효소작용으로 콩 단백질이 분해되어(Ahn, 2009), 생성된 polypeptide와 fructan의 혼합물로 이루어진 점질물에 함유되어 있다(Yang, 2013). 또한, 10 μM 농도의 surfactin은 물의 표면장력을 72 mN/m에서 30 mM/m으로 감소시킬 수 있어(Heerkoltz와 Seelig, 2001), 지금까지 알려진 bio-surfactant 중 가장 효과적인 것으로 알려져 있다(Maget-Dana와 Ptak, 1992; Md, 2012; Shin과 Kim, 2003).
B. subtilis 액상 배지를 활용한 surfactin 분리, 회수와 연관된 연구들은 확인되었지만(Abdel-Mawgoud 등, 2008; Cooper 등, 1981), 고체배지를 활용한 surfactin 생산능력에 대한 연구는 진행되지 않은 것으로 조사되었다. 특히, 청국장 발효 중 유용 성분인 surfactin 물질을 신속하게 검출할 수 있는 품질지표를 위한 연구는 아직 없는 실정이다. 따라서 본 연구에서는 상업적으로 surfactin을 생산할 때 공정상 품질관리에 활용할 수 있는 기초자료 제시하기 위해, 청국장의 발효 시 생성되는 점질물로부터 생산 가능한 surfactin 함량을 신속하게 평가할 수 있는 발효 시간별 surfactin 생산량을 확인한 후 이를 신속하게 확인할 수 있는 품질지표를 분석하여 품질관리 인자로 제시하고자 한다.
2. 재료 및 방법
본 실험에 사용한 대두(Glycine max, 1,000립당 299 g)는 경상북도 의성군에서 2021년에 재배한 것을 ‘힘찬농부 오달봉(Chilgokgun, Korea)’에서 구매하여 사용하였다.
B. subtilis KCCM 10480(CH-1)은 청국장에서 분리한 균주로 한국미생물보존센터에 기탁한 것을 동결 건조된 형태로 공급받았다. 활성화를 위해 nutrient broth(BD Difco, Franklin Lakes, NJ, USA)에 배양했으며, 여러 실험을 통해 tryptic soy broth(Merck, Darmstadt, Germany) 배지가 CH-1 배양에 적합한 것으로 판단되었으며, 배양은 shaking incubator(HST-201SL, Hanbaek ST Co., Bucheon, Korea)에서 35°C, 24시간, 100 RPM 조건으로 진행하였다.
대두(300 g)를 세척하여 12시간 불린 후 autoclave (HB-506-6, Hanbaek ST Co., Bucheon, Korea)로 15분 가열하였다. 물기 제거 후 40-45°C로 냉각하였고, CH-1 배양액 10%를 접종한 다음 발효기(CSW-5521, Cuckoo, Yangsan, Korea)로 12시간마다 시료를 채취하였다. 이때, 발효 시 평균 온도와 습도는 각각 42.1°C와 83%로 확인되었다.
청국장과 대두의 일반성분은 식품공전(MFDS, 2022)에 준하여 수분은 상압 가열 건조법, 조회분은 직접회화법, 조지방은 Soxhlet법, 조단백 Kjeldahl법을 사용하여 분석하였고, 탄수화물은 그 차이값으로 결정하였다.
청국장 10 g을 0.9% NaCl(Duksan Pure Chemical Co., Ltd., Yougin, Korea)로 10배 희석하여 균질화(BAGMIXER® 400, Interscience, Saint-Nom-la-Bretèche, France)하였다. 연속 희석 후 시료를 tryptic soy agar(BD Difco, Franklin Lakes, NJ, USA)배지에 분주, 도말하여 35°C, 12-24시간 배양한 다음 나타난 colony를 계수하여 log CFU/g으로 표기하였다.
발효한 청국장 2배에 해당하는 증류수를 첨가하여 실리콘 주걱으로 점질물을 분리하였고, 150 μm 체로 여과 후 10,000 ×g, 20분, 10°C 조건으로 원심분리(SUPRA22K, Hanil, Daegjeon, Korea)하여 상등액을 회수하였다.
pH는 시료를 pH meter(ST3100, Ohaus Co., Parsippany, NJ, USA)로 측정하였으며, 색도는 여과한 청국장 점질물 용액을 색도계(CT-310, Minolta, Tokyo, Japan)로 8회 측정하여 L*(lightness, 명도), a*(redness, 적색도), b*(yellowness, 황색도) 각각의 평균을 구하였고, 0시간을 기준으로 색차(color difference)를 계산하였다.
청국장 점질물 용액에 함유되어 있는 수용성 물질의 측정을 위해 실온 상태의 시료를 굴절당도계(PAL-α, Atago Co., Ltd., Tokyo, Japan)로 측정하여 °Brix로 나타내었다. 흡광도는 희석한 시료를 분광광도계(UV-1800, Shimadzu, Kyoto, Japan)를 사용하여 280 nm에서 측정 후 흡광도 값으로 나타내었다.
청국장 점질물 용액의 표면장력은 Ring method법(Gudina 등, 2010)으로 진행하였다. DuNouy Tensiometer (514-A, Itoh Seisakusho Ltd., Japan)를 사용하였으며, 증류수로 순수한 물의 표면장력인 72 dyne/cm까지 보정한 후, 실온상태의 시료에 백금링을 표면까지 조정하였다. 액체 표면이 깨질 때까지 일정한 힘을 가하여 백금링을 들어올린 값을 사용하였다.
Bicinchoninic acid(BCA) 분석은 Pierce− BCA Protein Assay Kit(Thermo Fisher Scientific, Waltham, MA, USA)와 함께 제공된 protocol로 진행하였다. 시료 0.1 mL에 reagent(A)와 reagent(B)를 50 : 1로 혼합한 시약 2 mL를 첨가하였다. 이를 항온수조(SB-1100, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)로 37°C, 30분 반응 후 실온에서 10분 냉각하여 562 nm 파장에서 측정하였다. 측정값은 BSA(MP Biomedicals, Irvine, CA, USA)로 검정 곡선을 작성하여 단백질 함량을 구하였다.
Kim(2011)의 방법을 응용하여 시료를 2.0 N HCl (Duksan Pure Chemical Co., Ltd., Yougin, Korea)로 pH 2.5까지 산 침전하여 원심분리 후(10,000 ×g, 20분, 10°C, SUPRA22K, Hanil) 회수한 침전물에 pH 2.5로 조정한 증류수를 첨가한 후, 수기 안의 침전물을 섞어주었다. 이를 한 번 더 원심분리하여 회수한 침전물은 동결건조(FDU-1200, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)한 후, 실온에서 보관하며 분석 시 사용하였다.
Surfactin 함량은 HPLC(Agilent 1100 Series, Agilent, Santa Clara, CA, USA)로 분석하였다. 동결건조한 시료를 methyl alcohol(Duksan Pure Chemical Co., Ltd., Yougin, Korea)로 1% 용액으로 용해한 후 원심분리한 상등액을 filter(0.45 μm, PTFE, DISMIC®, Advantech, Taipei, Taiwan)로 여과하여 사용하였다. 이때 이동상은 80% acetonitrile(Duksan Pure Chemical Co., Ltd), 20% 3.8 mM trifluoroacetic acid(Thermo Fisher Scientific lnc., Waltham, MA, USA)이었고, 유속은 1.0 mL/min, 주입량은 20 μL였다. 분석 시 C18 column (Luna®, 250×4.6 mm, 5 μm, Phenomenex, Torrance, CA, USA)을 사용하여 25°C에서 40분간 분석하여 210 nm 파장으로 검출하였으며(Lee 등, 2012; Wei와 Chu, 1998; Wei와 Chu, 2002) surfactin(Sigma-Aldrich, St. Louis, MO, USA)으로 검정곡선을 작성하였다.
3. 결과 및 고찰
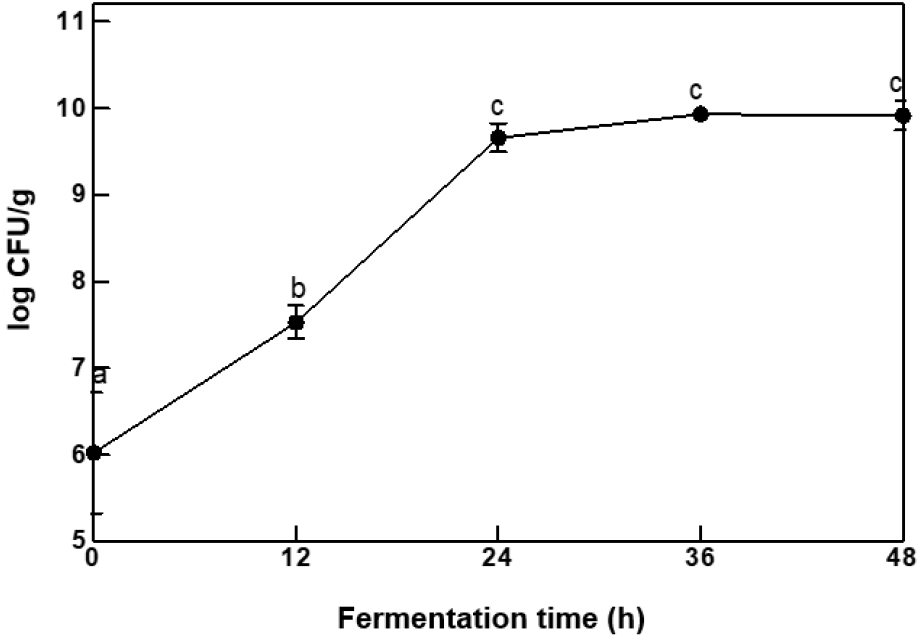
청국장의 발효 시간별 총균수의 변화는 Fig. 1과 같다. 총균수는 0시간 6.02±0.70 log CFU/g에서 24시간 9.66±0.16 log CFU/g으로 증가하였지만, 24시간 이후부터 유의적인 증가를 나타나지 않았다. 이는 24시간이 CH-1 균의 최대 성장 시간대로 생각된다.
점질물의 발효 시간별 pH 변화는 0시간에서 pH 6.25±0.37로 발효 시간의 증가에 따라 발효 종점인 48시간에서 pH 6.86±0.08을 보였다. 무염 발효는 알칼리성 발효로 발효 과정 중 대두 단백질이 아미노산으로 분해되어 암모니아가 생성된다(Kim, 2009). Lee 등(2018)과 Kim 등(1982)은 각각 0시간에서 pH 6.31, 6.46을 보였으며, 48시간에서 pH 7.04, 6.84로 증가하였다고 보고했다. 이를 본 결과와 비교하였을 때, 같은 양상을 나타내는 것이 확인되었다.
색도의 경우는 Table 1과 같다. L*값과 a*값은 36시간까지 감소하여 각각 20.83±0.24, 1.40±0.21을 보였지만, 48시간에서 유의적인 차이를 나타내지 않았다. b*값은 파랑(-)과 노랑(+)을 나타내는 값으로 24시간(8.48±0.19)을 제외하곤 비슷한 결과를 보였다. 색차(color difference)는 발효 시간에 따라 증가하였지만, 36시간(33.10±3.15) 이후 유의적인 증가를 나타내지 않았다. 발효 시간이 길어질수록 색이 짙어지는 것은 발효 시 온도, 대두의 당과 아미노산의 마이야르 반응, 수분 증발의 영향 또한 있는 것이라 말할 수 있다(Choi 등, 2007).
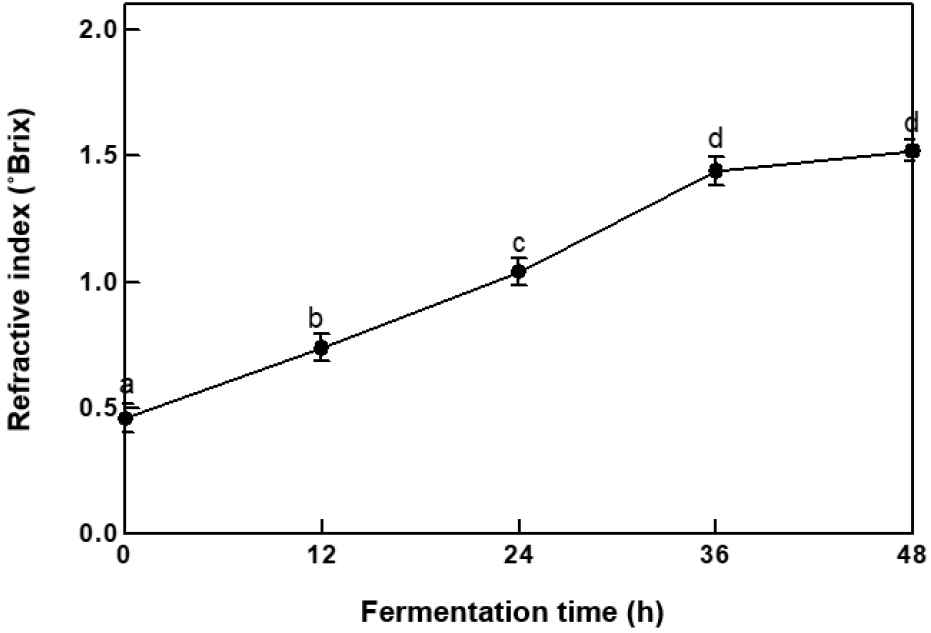
점질물의 발효 시간별 굴절률은 Fig. 2와 같다. 굴절 당도계는 당의 농도를 대략적으로 측정하는 것으로 용액 속에 함유된 당의 질량뿐만 아니라, 수용성 고형분도 측정 가능하기 때문에 저분자 펩타이드, 아미노산, 염, 산 등의 대략적인 양을 측정할 수 있다(Lioe 등, 2007). 0시간 0.6 °Brix였으며, 발효가 진행되며 생성되는 아미노산 등 수용성 물질로 인해 굴절률도 증가하였지만, 36시간 1.44±0.05 °Brix, 48시간 1.52±0.05 °Brix로 유의적인 차이를 나타내지 않았다.
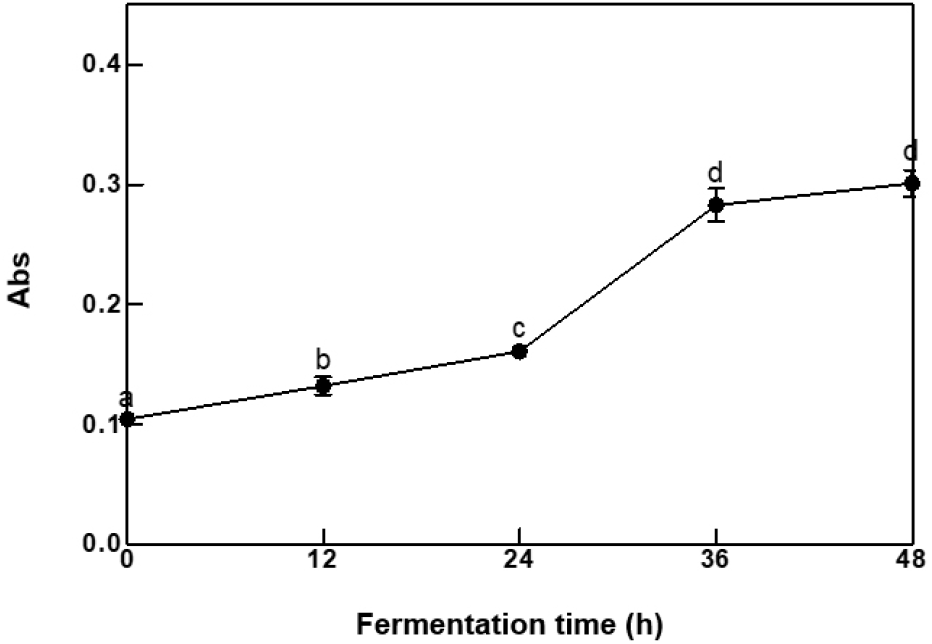
청국장 발효 중 생성되는 점질물의 시간별 흡광도 측정값은 Fig. 3과 같다. 0시간(0.100±0.004)에서 36시간(0.280±0.014)까지 유의적인 증가를 보였으나, 발효 48시간에서 0.300±0.001로 36시간과 비교하였을 때 유의적인 증가를 나타내지 못하였다. 280 nm 흡광도 측정법은 단백질 합성과 관련 있는 방향족 아미노산인 tryptophan, tyrosine, histidine, phenylalanine이 280 nm에서 강한 흡광성을 나타내는 특징을 활용하는 분석방법으로 신속한 단백질 유사 물질의 측정이 가능하다(Reinmith-Selzle 등, 2022). Yang과 Kim(2013)은 surfactin의 tryptophan과 tyrosine의 페닐 고리에는 공액이중결합이 포함되어 있어 280 nm의 파장에서 흡수 피크를 나타낸다고 보고하였다. 방향족 아미노산뿐만 아니라 방향족 화합물의 함량 추정에도 활용되는 것으로 보고되어 있기 때문에(Noh 등, 2017; Ryu 등, 2011), 280 nm 흡광도 측정을 이용하여 청국장의 발효 기간 중 surfactin의 함량을 비교적 간단하게 측정 가능할 것으로 생각된다.
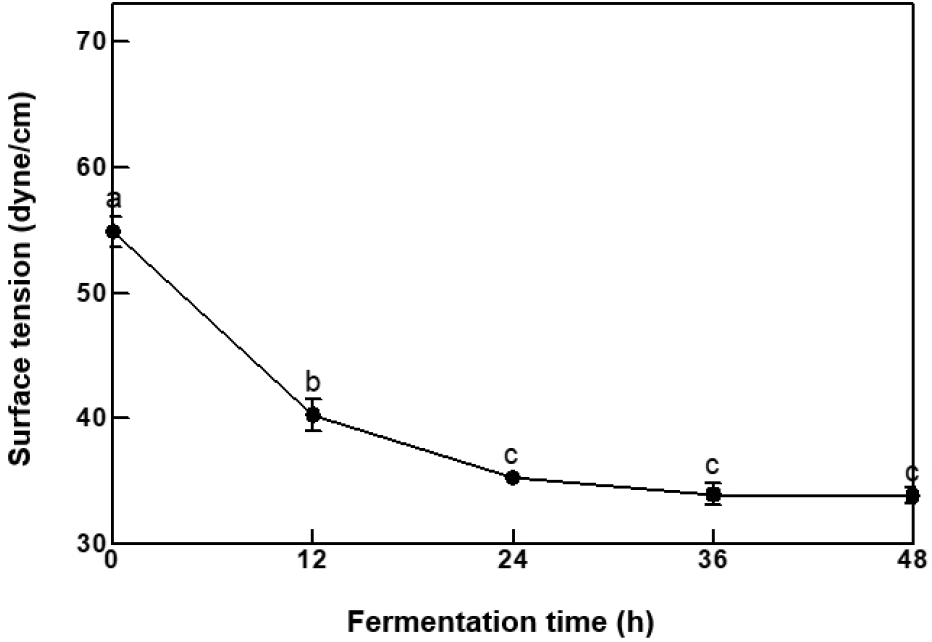
점질물의 발효 시간별 표면장력은 Fig. 4와 같다. 표면장력은 계면활성제의 성능을 비교하는 지표로 사용되며(Mulligan, 2005), 발효로 인해 생성된 surfactin은 표면장력을 감소시키는 힘을 가지고 있다. 물의 표면장력인 72 dyne/cm를 기준으로 0시간에서 54.93±1.22 dyne/cm를 나타내었다. 이는 CH-1 자체가 가지고 있는 계면활성력으로 생각된다. 표면장력은 24시간(35.33±0.59 dyne/cm)까지 감소율을 보였으나, 이후부터 유의적인 감소를 보이지 못하였다. 계면활성제의 친유성 부분이 용액 표면에 흡착되어 일정 농도의 micelle을 형성하는데, 그 이후로부터 농도는 증가해도 표면장력의 변화는 발생하지 않는다(Web page: KRUSS, 2022). 이러한 이유로 청국장 점질물 용액은 24시간부터 임계 미셸 농도가 형성된 것으로 판단되며, 발효 시간이 증가하여도 변화가 없을 것이라 생각된다.
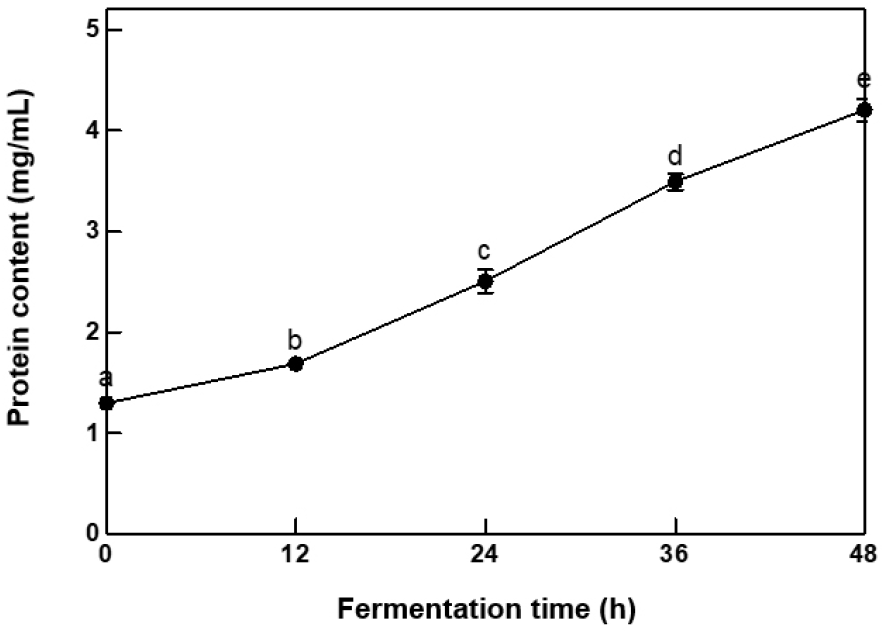
점질물의 발효 시간별 단백질 함량은 BCA assay로 분석하였고, 그 결과는 Fig. 5와 같다. BCA assay는 알칼리 조건에서 안정하다는 특징과 계면활성제와 호환성을 나타내기 때문에(Walker, 2009), 청국장의 surfactin의 시험에 적합한 방법이라 판단되어 적용하였다. 청국장 발효 기간 중 생성되는 점액질 내의 단백질 함량은 0시간 1.30±0.03 mg/mL에서 48시간 4.21±0.11 mg/mL로 유의적인 증가를 확인할 수 있었다. Ann(2011)의 단백질 측정 실험의 결과에 따르면 청국장 발효가 진행됨에 따라 균주가 분비한 protease에 의해 단백질이 펩타이드와 아미노산으로 분해하여 흡광도가 증가한다고 보고하였다. 본 연구의 균주 성장곡선과 surfactin 함량 변화를 분석할 때 발효 36시간까지 점질물 내 surfactin이 생성되는 1차 대사가 진행되며, 36시간 이후로 protease에 의한 펩타이드와 아미노산이 생성되는 2차 대사과정이 진행되는 것으로 판단된다.
Surfactin 표준품으로 분석한 chromatogram(Fig. 6(A))에서 6개의 isomer가 검출되었으며 이는 Koim-Puchowska 등(2019)의 연구와 동일한 isomer임이 확인되었다. 또한 청국장 분석 결과, Fig. 6(B)의 chromatogram을 확인할 수 있었으며 표준품과 청국장의 isomer spectrum을 비교하여(Fig. 6(C)) 동일한 물질임을 확인하였다. 하지만 Fig. 6(B) isomer가 표준품과 동일한 농도를 나타내지 못해 6개의 isomer(A-F isoforms) 중 높은 농도를 보이는 3개의 isomer(isoform C, isoform E, isoform F)를 선정하여 검정곡선을 작성 후 사용하였다.
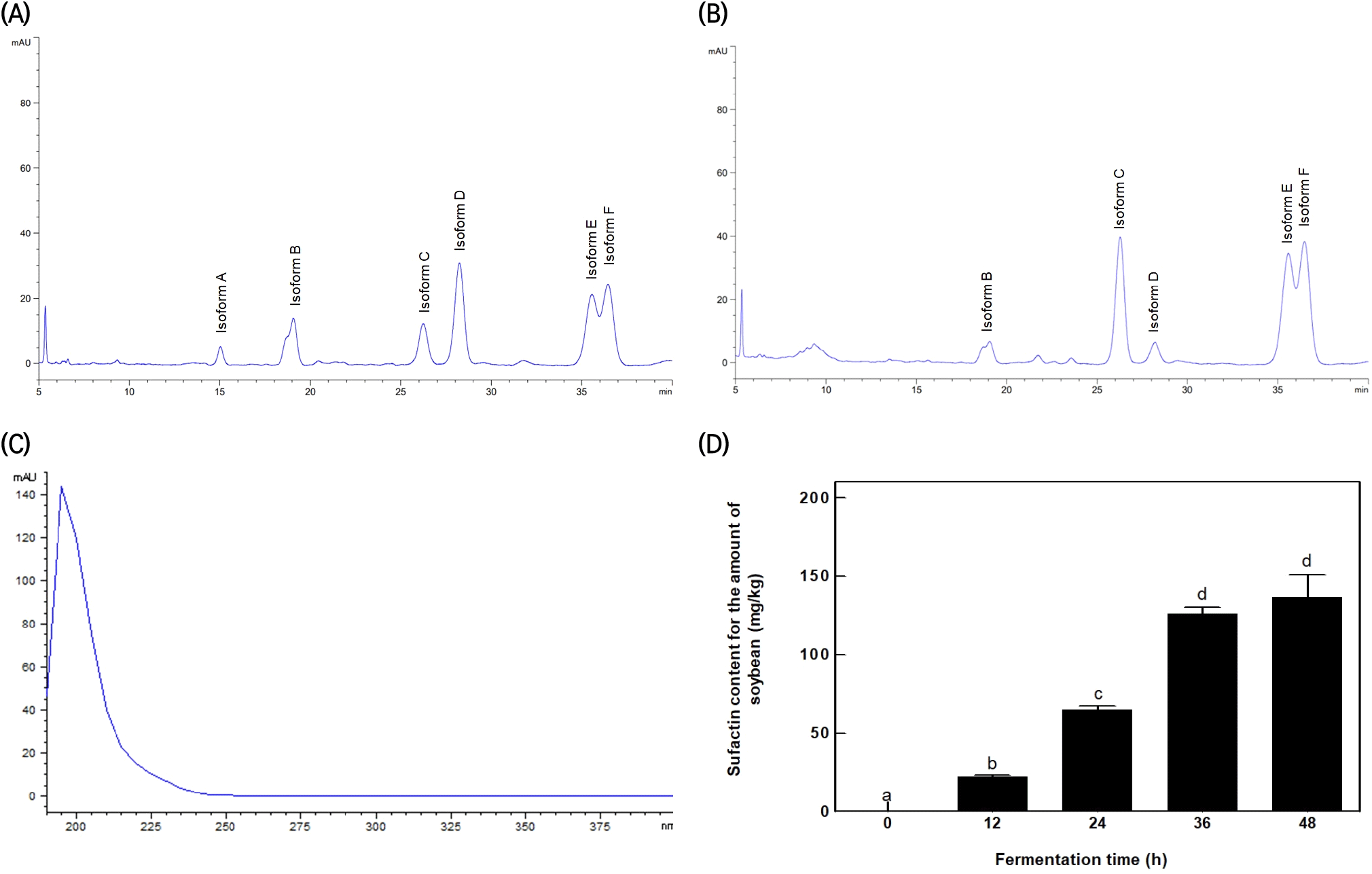
발효 시간별 HPLC 분석으로 도출한 surfactin 함량과 산 침전법으로 생산한 surfactin 분말을 대두 원료 대비 생산량(mg/kg)으로 표현한 값은 Fig. 6(D)와 같다. 발효 시간이 증가함에 따라 36시간에서 125.94±4.15 mg/kg의 생산량을 보였지만, 48시간에서 136.66±14.43 mg/kg으로 유의적인 증가를 보이지 못하였기 때문에, surfactin의 최대 생산 시간대는 36시간으로 생각되며, 이후의 발효는 무의미할 것으로 생각된다.
청국장 발효 시간에 따른 surfactin 생산량과 품질지표 간의 상관관계는 Table 2와 같다. 표면장력을 제외한 품질지표인자에서 유의적인 상관관계를 확인하였으며, 굴절률이 p<0.001 수준의 가장 높은 상관관계를 나타내었다. 그러나 surfactin 최대 생산량을 확인할 품질지표를 선정함에 있어 각 지표들의 발효 시간별 경향에 대한 유의성 입증을 고려해야 하기 때문에, 일원분산분석 결과와 함께 비교하여 surfactin 생산량과의 연관성을 비교하였다. 발효 시간에 따른 청국장의 surfactin 생산량 증가와 유의적인 경향을 나타내고 있는 인자들(색차, 굴절률, 흡광도)이 청국장 발효의 품질관리 지표로 유의적인 연계성이 높게 나타났다.
| pH | Color difference | Refractive index | Abs | Surface tension | Protein | |
|---|---|---|---|---|---|---|
| Surfactin production | 0.984**,1) | 0.960** | 0.997*** | 0.982** | −0.822 | 0.989** |
