1. 서론
우리나라 전라도 지역 및 제주도에 자생하는 황칠나무(Dendropanax morbiferus)는 미나리목 두릅나무과에 속하는 관속식물로, 수피에서 나오는 노란 진액은 전통적인 가구나 금속, 가죽의 도료로 사용되어 왔다. 황칠나무의 주성분은 sesquiterpene이며, 항균(Lee 등, 2015), 항산화작용(Lee 등, 2015), 항노화(Lee 등, 2015), 항암활성(Rhee 등, 2000), 항당뇨(An, 2014) 등의 효과가 보고되었으며, 민간약용으로 사용은 본초강목(本草學者) 등의 고문서에서도 찾아볼 수 있다(Kim, 2015). 현재 황칠나무 추출액은 화장품 및 천연 치약 등에 기능성 소재로 첨가되며, 맛과 풍미가 강하지 않아 음료, 발효식품 등의 소재로 활용되고 있다.
고초균(Bacillus subtilis)은 주로 대두 발효식품에 관여하는 전통 발효 미생물로 낫또, 청국장을 제조할 때 이용되며(Kwon 등, 2004), 혈전용해효소, 면역기능 강화 및 항산화 효과 등의 기능성에 관한 연구가 활발히 진행되고 있다(Heo 등, 1998; Kim 등, 1996). 또한, 고초균은 단백질분해효소를 생산하는 대표적인 미생물이며, 세포 외로 생산되는 단백질 분해효소는 열 안정성을 가지고 있고 넓은 pH 범위에서도 효소활성을 띠어 산업적으로 널리 사용되고 있다(Yoon 등, 2006).
젖산균은 당류를 발효하여 젖산을 생성하는 통성혐기성 세균으로 김치와 같은 전통 발효식품에 주로 관여하며 발효유, 치즈의 제조에 starter로 활용되고 있다. Lactobacillus plantarum은 유제품, 육류 및 김치와 같은 발효된 채소 등에서 발견되는 젖산균이며(De Vries 등, 2006), 유당의 소화, 장내 균총의 개선, 알레르기 및 면역계 조절 등의 유익한 작용을 제공하는 probiotics로 사용된다(Sanders and In’t Veld, 1999). 특히 L. plantarum은 기능성 물질인 γ-aminobutyric acid(GABA)를 생산하는 특징을 갖고 있다(Hasséssian 등, 1991). 최근 GABA 생성능이 뛰어난 젖산균을 이용하여 GABA를 고농도로 생산하여 기능성 식품소재로 활용하려는 연구가 진행되고 있다(Lim 등, 2022).
GABA는 신경전달 억제물질로서 박테리아와 식물, 동물의 뇌나 척수에 존재하는 비단백질 아미노산의 일종이며(Diana 등, 2014), 발아현미, 맥아 등에 소량 함유되어 있다(Chang 등, 1992). 미생물에 의해 고농도 GABA 생산이 가능하며, 세포 내 효소 glutamic acid decarboxylase (GAD)의 작용으로 인해 기질인 glutamic acid가 GABA로 전환된다(Fonda, 1985). 최근 GABA는 뇌 혈류 개선, 스트레스 해소, 기억력 증진, 혈압강하작용, 우울증 완화, 치매 예방, 불면 등에 효과가 있는 것으로 알려져 있다(Kang과 Oh, 2007). 따라서 고령화 시대에 기억증진, 수면 개선 등의 목적으로 미생물이 생산한 GABA를 함유한 다양한 건강식품의 개발이 필요한 실정이다.
가쓰오부시(katsuobushi)는 가다랑어(Katsuwonus pelamis)를 찌고 훈연한 후 발효시킨 일본의 가공식품이며, 나무토막처럼 단단한 상태의 제품을 슬라이스 형태로 얇게 깎아 직접 섭취하거나, 우수한 풍미와 감칠맛을 내는 다양한 조미성분을 함유하고 있어 육수로 다양한 요리에 이용된다(Kawaguchi, 2005). 가쓰오부시의 열수 추출물을 얻는 과정에서 생성되는 부산물은 식품소재보다는 동물의 단백질 사료로 활용되고 있는 실정이다. 최근 식품기업은 지속 가능한 성장을 위한 방안으로 ESG(environmental, social, governance) 경영을 통해서 환경친화적인 제품생산과 식품부산물의 재활용에 대한 필요가 증가하고 있다. 가쓰오부시 부산물은 우수한 풍미 성분과 고농도 단백질을 함유하고 있어서 이를 이용한 고부가가치 식품 소재 개발이 가능하여, 본 연구에서는 가쓰오부시 부산물 단백질을 생물전환기술을 통한 기능성 발효소재로 전환시키고자 한다. 1차적으로 가쓰오부시 단백질의 가수분해를 위해서 황칠나무 추출물에 고초균을 배양시켜 단백질 분해 효소원의 생산조건을 최적화하고, 이를 이용하여 가쓰오부시 부산물의 단백질을 고온에서 단시간 가수분해시킨다. 이후 연속적으로 젖산균 배양을 통해서 기질인 mono sodium L-glutamate(MSG)로부터 기능성 물질 GABA 생산의 최적화를 수행함으로써, 황칠나무 추출물에 가쓰오부시 단백질 가수분해물인 peptide와 고농도 GABA, probiotic가 강화된 복합 기능성 발효 소재를 개발하고자 한다.
2. 재료 및 방법
본 연구에서 사용된 가쓰오부시 열수 추출 후에 얻어진 부산물은 ㈜한라식품(Gyeongbuk, Korea)에서 제공받았으며 -20°C에서 냉동 보관하면서 사용하였고, 고초균 발효소재로써 황칠나무 추출물(Dendropanax morbiferus extract, DME)은 옻가네(Jecheon, Korea)에서 구입하여 사용하였다. 고초균 발효와 젖산균 발효 시 전구물질로 첨가한 MSG와 glucose, yeast extract는 각각 CJ Cheiljedang (Seoul, Korea), Samyang Genex Corporation(Incheon, Korea), ㈜조흥(Ansan, Korea) 제품을 구입하여 사용하였다. Peptide 생성을 위해 사용한 Flavourzyme과 skim milk 분말은 각각 Nnovozymes(Denmark, Europe)과 서울우유(Seoul Milk, Seoul, Korea) 제품을 구입하여 사용하였다. MRS broth는 Difco™(USA)사의 제품을 구매하여 사용하였다.
B. subtilis HA(KCCM 10775P) 균주는 계명대학교 식품가공학과 식품소재개발 연구실에서 재래식 청국장으로부터 직접 분리하여 사용하였다. MRS agar plate에서 42°C, 24시간 배양한 B. subtilis HA 균주를 5% skim milk에 한 백금이 접종한 뒤, 항온배양기(SI-900R, JeioTech. Co., Ltd., Daejeon, Korea)에서 42°C, 24시간 동안 160 rpm으로 진탕배양한 후 starter로 사용하였다.
L. plantarum KS2020(KCCM 12782P) 균주는 물김치에서 분리된 GABA 생성능이 우수한 균주로서, 계명대학교 식품가공학과 식품소재개발연구실에서 분리하여 사용하였다. MRS agar plate에서 30°C, 48시간 배양한 L. plantarum KS2020 균주를 MRS broth에 한 백금이 접종한 뒤, 항온배양기(IS-971R, JeioTech. Kimpo, Korea)에서 30°C, 24시간 동안 정치배양한 후 starter로 사용하였다.
단백질 분해 활성을 갖는 고초균 발효물을 제조하기 위해서 황칠나무 추출물 25%(v/v)를 autoclave에서 121°C, 15분간 고압증기멸균 과정을 거친 후 glucose 2%(w/v), skim milk 1%(w/v) 또는 MSG 1.5%를 추가로 혼합하였다. B. subtilis HA starter를 5%(v/v) 접종하여 42°C, 160 rpm으로 15시간 동안 호기적 조건에서 진탕배양하였다. 단백질 분해를 위해서 황칠나무 추출물의 고초균 발효물에 분쇄된 가쓰오부시 부산물 10%(w/v)를 첨가하여 60°C, 120 rpm으로 3시간 동안 효소분해시켰으며, 대조군으로 상업적 효소 Flavourzyme은 증류수에 기질 대비 0.75% 첨가하여 사용하였다.
GABA 생산을 위한 젖산균 발효는 가쓰오부시 단백질 가수분해물에 MSG 10%(w/v), glucose 3%(w/v), yeast extract 0.5%(w/v)를 첨가한 후 L. plantarum KS2020 starter 1%(v/v)를 접종하여 항온배양기(IS-971R, JeioTech, Kimpo, Korea)에서 30°C, 7일간 정치배양한 후 발효물의 이화학적 특성을 분석하였다.
생균수는 시료 1 mL에 생리식염수 9 mL를 첨가해 10배 희석법을 이용하여 106배로 희석된 것을 MRS agar plate에 20 μL 도말한 후, B. subtilis HA는 42°C의 항온배양기에서 24시간 배양하여 측정하였고, L. plantarum KS2020은 30°C의 항온배양기에서 48시간 배양하여 측정하였다. 생균수는 log CFU(colony forming unit)/mL로 나타내었다.
pH는 pH meter(Digtal pH meter 420A+, Thermo Orion Beverly, MA, USA)로 측정하였다. 적정 산도는 시료 1 mL에 증류수 9 mL를 첨가하여 0.1 N NaOH를 이용하여 pH 8.3까지 적정한 소비량을 lactic acid 함량(%, v/v)으로 환산하였다.
황칠나무 추출물의 고초균 발효물의 peptide 생성 정도를 측정하기 위하여 Folin-phenol 시약을 이용하여 발효물에 존재하는 tyrosine 함량을 측정하였다(Mungal과 Surendra, 2004). 희석한 시료 0.7 mL에 0.44 M trichloroacetic acid(TCA) 용액 0.7 mL를 첨가하여 37°C 항온수조에서 30분간 반응 후 15,000 rpm에서 10분간 원심 분리하여 침전물을 제거하였다. 회수된 상등액 1 mL에 0.55 M Na2CO3 2.5 mL와 3배 희석된 phenol reagent 0.5 mL를 순차적으로 넣고 혼합한 후 37°C 항온수조에서 30분간 반응시킨 후 흡광도를 spectrophotometer(Amersham Biosciences, Amersham, UK)로 660 nm에서 측정하였다.
황칠나무 추출물의 고초균 발효물의 단백질 분해효소 활성을 측정하기 위해 Folin-phenol 시약을 이용하여 casein 기질의 분해 산물인 tyrosine 함량을 측정하였다. 희석한 시료 0.35 mL에 0.6% casein 0.35 mL를 첨가하고 37°C 항온수조에서 10분간 반응시킨다. 그 후 0.44 M TCA 용액 0.7 mL를 첨가하여 37°C에 30분간 반응 후, 15,000 rpm에서 10분간 원심 분리하여 회수된 상등액 1 mL에 0.55 M Na2CO3 2.5 mL와 3배 희석된 phenol reagent 0.5 mL를 순차적으로 넣고 혼합한 후 37°C 항온수조에서 30분간 반응시킨 후 흡광도를 spectrophotometer(Amersham Biosciences, Amersham, UK)로 660 nm에서 측정하였다. 효소 활성 1 unit은 기질인 casein으로부터 분당 1 μg의 tyrosine을 생성시키는 데 필요한 효소의 양으로 정의되었다.
MSG 및 GABA의 함량을 silica gel TLC plate(10×20 cm)를 사용한 thin layer chromatography(TLC)로 정성분석을 하였다. 전개 용매는 n-butyl alcohol : acetic acid glacial : distilled water를 각각 3 : 1 : 1(v/v)로 혼합하여 사각 chamber(30×25×10)에 넣은 후 4시간 정도 실온에서 포화시켰다. 발효물과 standard 용액을 TLC plate 하단 15 mm 위치에 2 μL씩 점적한 뒤 건조하여 전개를 시켰다. 전개 후 TLC plate는 100°C 감압건조기에서 건조한 후 0.2% ninhydrin 발색 시약 용액을 뿌려 100°C에서 5분 정도 발색시켜 MSG와 GABA의 spot을 확인하였다.
발효물의 유리아미노산 glutamic acid와 GABA 정량분석을 수행하였다. 발효물 1 g을 취하여 여과지로 여과한 후 유도체화를 위해 10 μL를 취하여 borate buffer 70 μL와 ACCQ-Fluor Reagent(Waters Co., Ltd., New York, NY, USA) 20 μL를 넣어 10초간 잘 혼합한 후 1분 방치하고 55°C oven에서 10분간 가열 후 방냉하여 HPLC(Waters 2475)를 사용하여 측정하였다. ACCQ · Taq™(3.9×150 mm) column과 Fluorescense 검출기(250 nm)를 이용하고, mobile phase(A, Waters AccQ Taq Eluent A; B, acetonitrile; C, tertiary distilled water)를 유속 1.0 mL/min의 속도로 흘려주었다. 표준물질은 증류수에 녹여 각 단계별로 희석하여 작성한 표준 검량선을 이용하여 함량을 계산하였다.
이때 S는 시험용액의 농도(μg/mL), V는 시험용액의 양(mL), D는 희석배수, 그리고 W는 채취한 검체량(g)이다.
3. 결과 및 고찰
황칠나무 추출물은 짙은 황색으로 약간의 떫은맛을 지니며, 고형분 함량은 7.26%±0.15%이고 pH는 5.68±0.01, 산도는 0.01±0.01%이다. 무기질 함량은 K 2.38 mg%, P 0.44 mg%, Mg 0.25 mg%, Na 0.25 mg%, Fe 0.22 mg% 순으로 K의 함량이 가장 많은 것으로 보고되었으며(Choi, 2017), Kim(1997)에 따르면 황칠나무의 무기질 함량 중 K 함량이 457.60 mg%로 가장 높다고 보고하였다. 황칠나무 추출물에 존재하는 K, P, Mg, Na, Fe, Ca, Mn 등 다양한 무기질들이 발효 미생물의 생육에 도움을 줄 것으로 사료된다.
황칠나무 추출물에 skim milk 또는 MSG를 첨가하여 고초균 발효를 15시간 동안 수행한 후 단백질 분해효소 활성을 측정하였다(Table 1). 황칠 추출물에 탄소원으로 포도당 2%만을 첨가한 경우에 B. subtilis HA 발효물의 단백질 분해효소 활성은 매우 낮은 1.65 unit/mL값을 나타냈다. 단백질원으로 skim milk 1%와 전구물질 MSG 1.5%를 모두 추가적으로 첨가한 경우에 고초균 발효물은 비교적 높은 30.31 unit/mL의 단백질 분해효소 활성을 보였다. 반면에 황칠 추출물에 탄소원을 제외하고 skim milk만을 1% 수준으로 첨가한 DME 배지(Table 1(C))에서 고초균 발효 15시간에 102.22 unit/mL로 가장 높은 단백질 분해효소 활성을 나타내었다. B. subtilis HA를 이용하여 42°C에서 1일 동안 고체 발효시킨 조직대두단백 발효물의 단백질분해효소 활성이 120 unit/g이었으며, 이는 고초균에 의한 고체배양과 비교할 때 액상의 황칠나무 추출물의 발효물이 유사한 단백질 분해 활성을 나타내었다(Kim과 Lee, 2009).
또한, 황칠의 고초균 발효물의 생균수를 측정한 결과 황칠나무 추출물에 포도당만을 첨가한 경우에 고초균 생균수가 매우 낮았으며, 추가적으로 skim milk, MSG를 첨가한 조건에서 109 CFU/mL 정도로 높은 생균수를 보였다. 이는 황칠나무 추출물에서 고초균의 생육을 위해서 탄소원 이외에 영양성분이 필요하며, 영양성분이 부족한 제한배지 환경에서 단백질원으로 skim milk 첨가가 고초균에 의한 단백질 분해효소의 생산을 높이는 것으로 판단된다. 고초균에 의해서 세포 외로 분비되는 단백질 분해효소 활성은 탄소원과 질소원의 배지조성과 농도에 영향을 받으며, 전분과 corn steep liquor, yeast extract 등이 효과적이었으며, 발효시간 24시간 정도에서 가장 높은 효소 활성을 나타낸다고 보고하였다(Sepahy와 Jabalameli, 2011).
황칠나무 추출물에 skim milk가 1% 첨가된 배지(Table 1(C))에서 얻어진 고초균 배양물을 이용하여 참치부산물을 첨가해 단백질을 분해한 결과, 간접적인 peptide 함량의 측정으로써 tyrosine 함량이 72.94 mg%에서 156.85 mg%로 2배 이상 증가하였다(Fig. 1). 특히 황칠나무 추출물에 skim milk가 혼합된 고초균 배양물에서 초기 tyrosine 함량이 높게 나타남으로써 배지에 함유된 skim milk 단백질이 고초균 발효물의 단백질 분해효소의 높은 활성으로 일부 단백질이 가수분해되는 것으로 판단되었다.
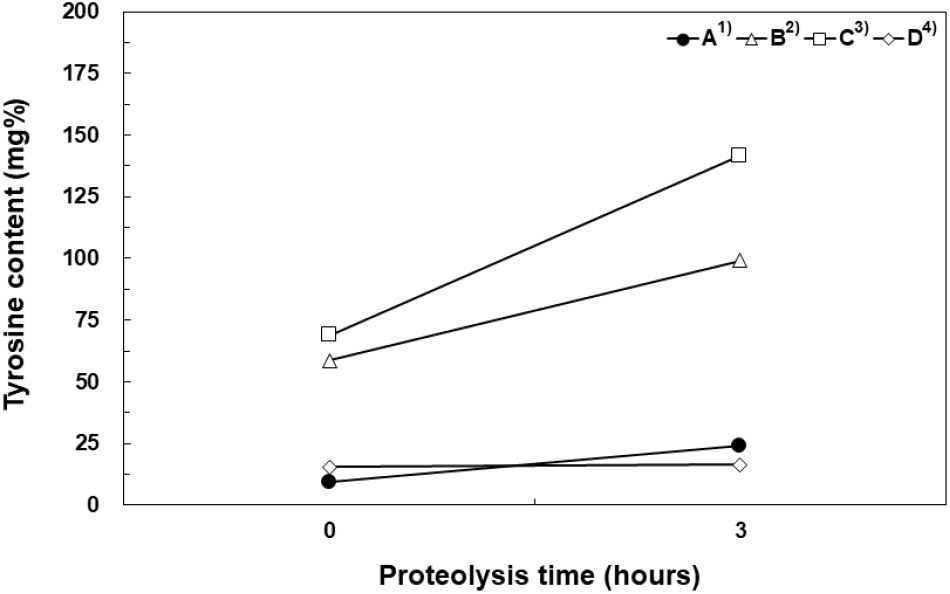
대조군으로 상업적 효소인 Flavourzyme을 사용한 조건(Fig. 1(A))과 고초균 배양 시에 황칠나무 추출물에 skim milk와 MSG를 첨가한 조건(Fig. 1(B)), 황칠나무 추출물에 고초균만 첨가한 조건(Fig. 1(D))과 비교하여 황칠나무 추출물에 skim milk만 첨가한 조건(Fig. 1(C))이 고초균 발효 15시간에 단백질 분해 활성이 가장 높은 것으로 나타났다. 유청을 이용한 고초균과 젖산균의 혼합발효를 통해서 유청 단백질이 가수분해되어 최종 혼합발효물의 tyrosine 함량이 38 mg%임을 보고하였다. 이는 유청 단백질의 함량과 구조적 특징 등에 의해서 낮은 tyrosine 함량 값을 나타내는 것으로 판단된다(Kim 등, 2018).
이 결과로부터 상업적 단백질 분해효소를 사용하는 것보다 황칠나무 추출물에 skim milk를 첨가하여 고초균을 발효시킨 배양물이 단백질 분해 효소원으로 사용될 때 단시간 안에 가쓰오부시 부산물의 단백질을 가수분해시킬 수 있는 것으로 나타났다.
GABA 생산을 위해서 황칠나무 추출물의 고초균 배양물에서 가수분해시킨 가쓰오부시 단백질의 가수분해물을 이용하여 젖산균 발효를 진행한 후 생균수 변화를 측정하였다(Fig. 2). L. plantarum KS2020을 이용해 젖산균 발효를 수행한 결과 젖산균 생균수가 0일 차에 7.65 log CFU/mL에서 발효 1일 차에 9.84 log CFU/mL로 크게 증가하였고, 그 후 소폭 감소하면서 발효 7일 차에는 9.33 log CFU/mL로 높은값을 나타내었다.
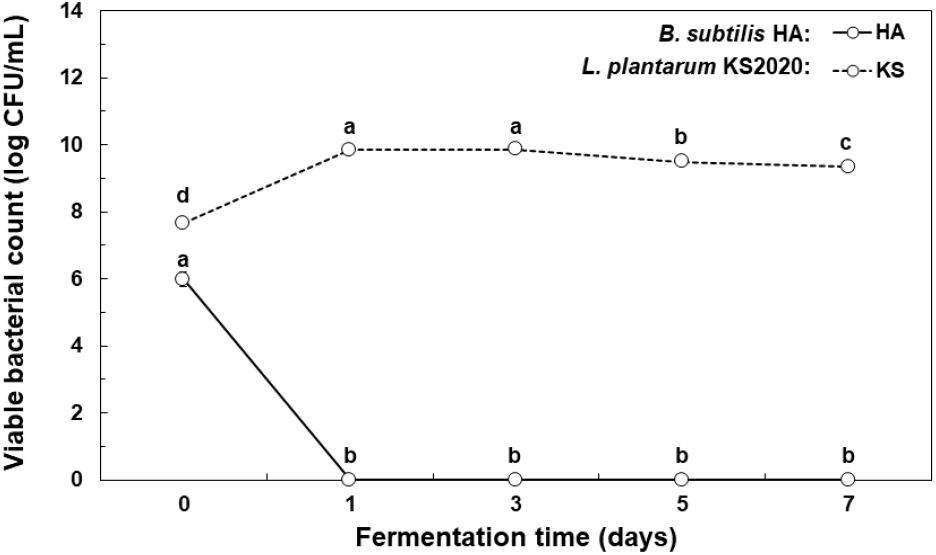
반면에 황칠나무 추출물의 고초균 발효물(Fig. 2(C))을 이용하여 가쓰오부시 단백질을 60°C의 온도에서 1차 가수분해시키는 과정에서 발효물에서 고초균의 생균수가 크게 감소되면서, 젖산발효 0일 차에 고초균 생균수 5.98 log CFU/mL에서 젖산균에 의한 발효가 진행되면서 대부분 고초균이 사멸되는 것으로 나타났다. 대조적으로 젖산균 생균수는 10 log CFU/mL 정도로 높게 유지되는 경향을 보였다.
2차 젖산균 발효 기간 중의 발효물에 pH 및 산도를 측정하였다(Fig. 3). 젖산균 발효물의 pH는 0일 차에 7.14에서 발효 1일 차에 5.77로 감소하였다가, 발효 3일 차에 8.3으로 크게 증가한 후 7일 차까지 pH 9.0으로 유지하였다. 산도는 0일 차에 0.19%에서 발효 1일에 젖산균 발효가 진행되면서 생성된 유기산으로 인해 산도 1.92%로 증가한 후 발효 3일 차에 pH 8.3으로 알칼리성이 되어 잔존하는 유기산이 없는 것으로 나타났다.
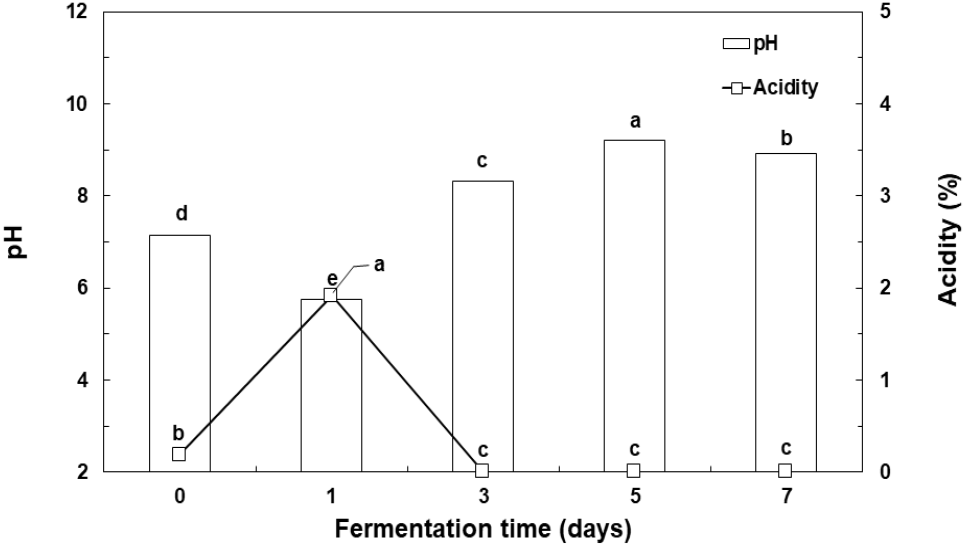
Kang과 Oh(2007)에 따르면 젖산균에 의한 발효를 통해서 발효성 당으로부터 생성된 젖산으로 인해 배양액의 pH는 낮아지고 산도는 증가한다. 그러나 젖산균에 의한 GABA 생성이 수반되는 경우에 기질인 MSG를 첨가하여 젖산균을 배양시키면 균체 내 glutamate decarboxylase에 의해서 탈탄산화되면서 GABA가 생합성된다. 동시에 세포 내에 존재하는 proton이 소비되어 배양액에 존재하는 proton이 감소한다(Lim과 Lee, 2014; Ningzi와 Long, 2020). 따라서 젖산균에 의한 발효과정에서 GABA 전환이 수반되면서 배양액의 산도가 감소하는 것으로 판단된다. 이는 젖산균 배양물의 높은 산도로 인하여 발효 소재로 사용이 제한되는 점을 개선할 수 있다고 판단된다.
이상발효 젖산균인 L. plantarum을 이용한 발효 시 MSG로부터 GABA 전환을 TLC를 통해 정성분석을 하였다(Fig. 4). GABA의 생성은 1일 차부터 진행되었으며 발효 3일에 대부분 MSG가 소진되면서 GABA로 전환되었으며, 일부 MSG가 잔존하는 것으로 나타났다. 따라서 가쓰오부시 단백질 가수분해물의 젖산균 발효를 통해서 고농도인 10% MSG로부터 GABA 전환이 가능하였다. 최종 발효물에는 MSG가 일부 잔존하지만 발효물을 간장 등 소스류에 첨가하는 발효소재로 사용할 때 맛, 풍미 향상에 도움이 될 것으로 판단된다.
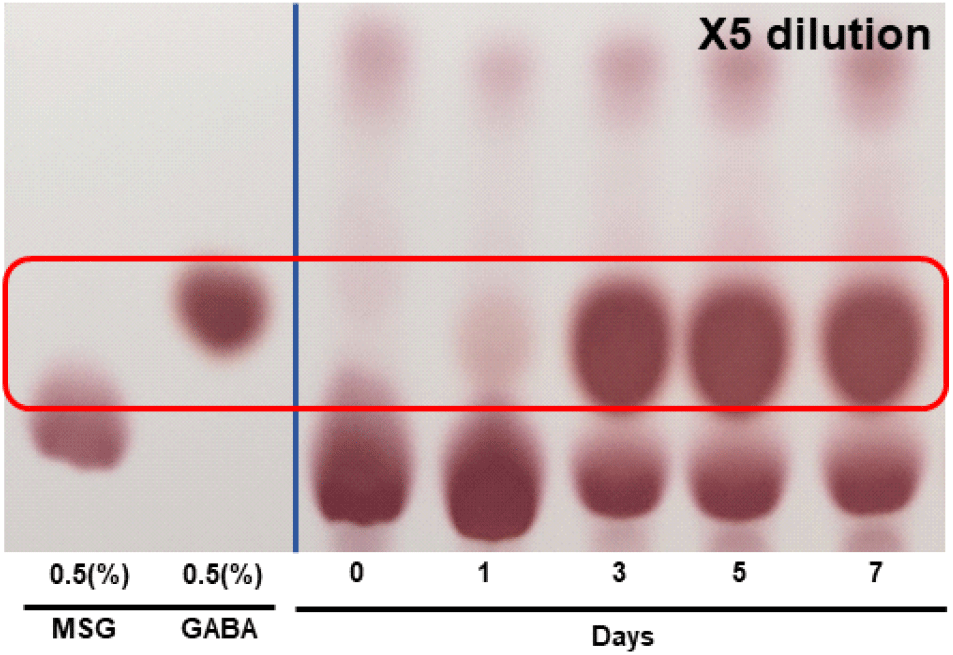
천연물에 젖산균을 이용한 GABA 생성에서 젖산균의 종류와 배양조건에 따라서 GABA 생산에 차이가 보이는 것으로 나타났으며, 단일 발효보다 고초균 또는 효모와 젖산균의 혼합발효를 통해서 효과적으로 GABA 생산이 가능함이 보고되었다. Kim 등(2018)에 따르면 유청을 이용한 고초균과 젖산균이 혼합발효를 통해서 2.21%의 GABA를 강화시켰으며, Kang과 Lee(2022)에 따르면 옻나무 추출물을 이용한 효모와 젖산균 혼합발효를 통해서 2.5%의 GABA를 생산함을 보고하였다. 젖산균의 복합발효를 통해서 GABA 생산이 효율적인 것은 고초균 또는 효모의 배양물에 glutamate decarboxylase 활성에 필요한 pyridoxal phosphate 조효소 생성에 기인한 것으로 사료된다.
황칠나무 추출물의 고초균 발효물에 의해 얻어진 가쓰오부시 단백질 가수분해물의 젖산균 발효물의 glutamic acid, GABA 함량을 HPLC를 통해 분석하였다. 2차 혼합발효 시 생성된 GABA의 함량은 3,139.58 mg/100 g으로 나타났으며, 잔존하는 glutamic acid의 함량은 83.44 mg/100 g으로 확인되었다. Kwon과 Lee(2018)에 따르면 MSG 3.5%가 첨가된 녹각 추출액의 GABA 생산에서 1.43%의 GABA를 생산할 수 있다고 보고하였으며, Choe와 Lee(2019)에 따르면 산돌배 추출액에 MSG 3% 첨가 후 5일간 젖산균을 발효할 시 1.78%의 GABA를 생산할 수 있다고 보고하였다. 따라서 가쓰오부시 단백질 가수분해물에 MSG 10%를 첨가 후 젖산균 발효를 통해서 생산된 GABA는 3,139.58 mg/100 g으로 고농도 값으로 판단된다.
