1. 서론
된장은 대두를 주원료로 하는 우리나라 전통 발효식품으로, 필수아미노산, 유기산, 지방산, 무기질 등 영양학적으로 우수하고 저장성이 뛰어나며 특유의 맛과 향을 지닌 단백질 급원으로서 한국 식문화에서 중요한 위치를 차지해 왔다(Choi 등, 2016; Jeon 등, 2016; Kim 등, 2006). 또한 지속적인 연구를 통해 된장은 항암(Lee 등, 2011b), 면역증진(Lee 등, 2011a), 혈압 강하(No 등, 2006), 고지혈증과 당뇨 개선(Kim 등, 2012), 항산화능(Oh and Kim, 2007), 혈전 용해능(Yi 등, 2014), 항당뇨(Bae 등, 2013) 등 여러 가지 생리활성 효과가 있다고 입증되었다.
기능학적·영양학적 효능뿐 아니라, 자연적으로 증식하는 Bacillus subtilis에 의한 고유의 풍미는, 종균을 사용하는 개량식 된장보다 다양한 미생물에 의해 발효·숙성되는 재래식 전통 된장에서 느낄 수 있다(Song 등, 1984). 이러한 재래식 전통 된장의 소비는 지속적인 증가 경향을 보이고 있으나(KOSIS, 2016), 지역의 기후, 원료, 제조 방법, 담금 시기 등의 영향을 받기 때문에(Chang 등, 2007; Cho 등, 2017; Lee, 2004), 재래식 된장은 품질이 균일하지 못하며, 미생물과 이들의 대사산물에 의한 오염 등 식품 안전 측면에서 위험성을 안고 있어(Kwon, 2002; Sun과 Baek, 2008) 소비를 꾸준히 지속시키려면 그 영향요인에 따른 제품의 품질에 대한 제어가 시급하다. 장류의 발효과정에서 식품 안전을 좌우하는 주요 인자는 바이오제닉 아민, 곰팡이 독소인 aflatoxin, 식중독 미생물인 Bacillus cereus의 3가지로 요약할 수 있다(Kim 등, 2012).
한편, 전 세계적으로 지구온난화 현상이 점차 심각해지는 가운데 한국이 지구의 평균온도 상승보다 2배 빠르게 진행되고 있는데(KMA, 2017), 제조 시 온도 및 습도 등 외부 자연환경과 밀접한 관련을 갖는 재래식 전통 된장의 이상발효, 부패, 변색 등의 품질에 영향을 줄 수 있다(Baek 등 2019). 특히, 전통 된장의 숙성에 관여하는 유익균은 Aspergillus oryzae, B. subtilis 등으로, 여러 미생물이 복합적으로 작용하여 된장의 맛과 향이 결정되기 때문에(Park, 1992) 된장의 숙성 과정에 작용하는 미생물이 가장 중요하다고 할 수 있다(Lee 등, 2016). 하지만 숙성 중 된장은 서로 다른 제조 및 담금 시기의 외부 자연환경에 따라 가장 중요하게 작용하는 미생물 군집의 영향을 받게 된다.
최근에는 된장의 품질에 영향을 주는 이러한 미생물 군집 연구와 주성분 분석(principal component analysis, PCA) 방법으로 된장의 품질을 평가하는 연구들이 발표되고 있다. Cho 등(2017)은 도서 지역인 제주도와 내륙이면서 바다를 접하고 있는 호남지역의 특이적인 기후 및 풍토가 전통 장류에 미치는 세균과 진균에 대한 미생물 군집을 비교 분석하였으며, Shim 등(2018)은 한식 된장의 숙성기간에 된장의 품질에 영향을 주는 요인을 PCA를 통해 분석하였고, Baek 등(2019)은 한국의 8개 권역에서 전통 방식으로 제조한 고추장의 품질 특성과 외부환경과의 상관관계를 연구하였으며, Ku 등(2014)은 9년 숙성된 구입 된장을 정량적 묘사분석과 군집 분석으로 관능적인 품질을 평가하는 연구였다. 그러나 이들 선행 연구 대부분은 숙성기간이나 제조 방법이 다른 된장을 구매하여 실험실에서 한 연구로, 일관성 있게 발효 초기부터 숙성기간 동안 된장 성분들의 총체적인 변화를 모니터링한 분석이 아니므로 이들을 비교하기에는 한계를 가지고 있다.
본 연구는 재래식 전통 된장을 직접 제조하는 현장에서 같은 메주를 같은 방법으로 발효시킨 같은 된장 시료를 각각 다른 지역 및 위치에서 숙성하여, 숙성지역 및 위치에 따른 온도 차이가 전통 된장의 품질 특성, 바이오제닉 아민 등 유해 물질, 미생물 군집에 영향을 주는지를 비교하였고, 재래식 전통 된장이 식품 안전성 측면에서 가질 수 있는 인자와 외부 요인과의 상관성을 통해 주요한 영향요인을 분석하고자 하였다.
2. 재료 및 방법
본 연구에 사용된 전통 된장은 전남 담양의 전통 장류업체에서 한식 메주를 이용하여 담근 된장을 구매하여 사용하였다. 담근 직후 된장과 숙성 후 된장 시료는 스토마커를 이용해 균질화 후 −20°C에서 보관하면서 분석용 시료로 사용하였다.
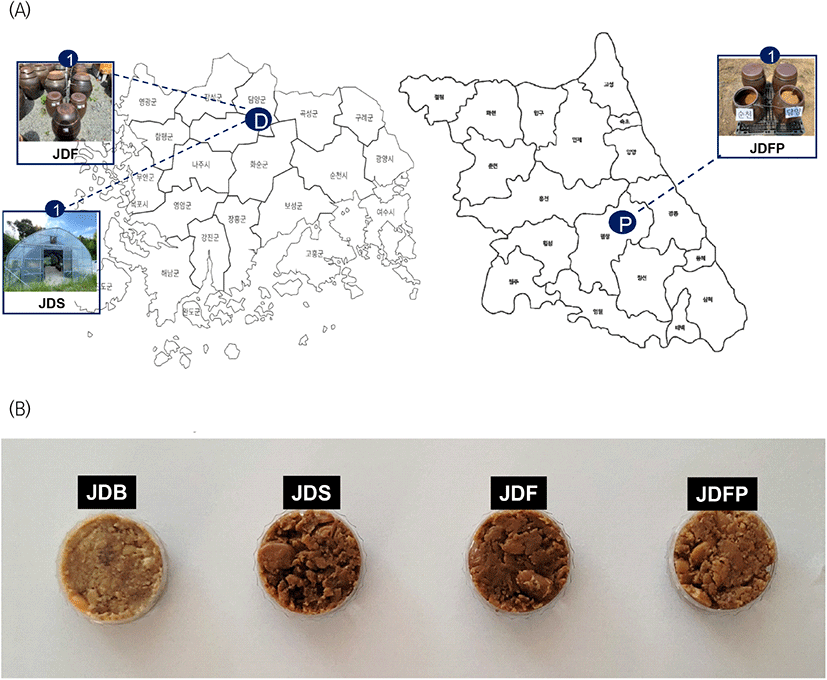
전통 된장은 4월 중순에 장을 담그고, 노지에서 발효 후 5월 중순 간장과 분리한 것을 담근 직후 시료(JDB)로 수집하였고, 이 시료를 3개 장소로 나누어 숙성한 후 12월에 시료로 수집하였다. 숙성 장소는 Fig. 1(A)에 제시한 것처럼 담양 장류업체의 노지(JDF) 및 스마트 관리 시설(JDS), 강원도 평창 장류업체의 노지(JDFP)에서 진행하였다. 스마트 관리시설은 28°C 이상 온도가 올라가면 측창, 차광막(50%), 환기팬, 배기팬 순으로 작동하는 단동 비닐하우스이다. 또한, 숙성 장소별 온도를 측정하기 위해 데이터 로거(HOBO Pro v2 Temp/RH, Onset Computer, USA) probe를 시료 중앙 그리고 표면으로부터 10 cm 깊이에 삽입하였다.
색도는 색차계(CM-5, Konica Minolta, Toyokawa, Japan)를 이용하여 측정 후, Hunter value의 명도(L*, lightness), 적색도(a*, redness), 황색도(b*, yellowness)로 나타내었다. 표준 백색값은 L*=99.44, a*=-0.09. b*= −0.25이었다.
갈변도(browning index)는 시료 1 g을 증류수 20 mL와 잘 섞어준 후 10%(w/v) trichloroacetic acid(TCA, Sigma Chemical., Riedstr, Germany) 용액 5 mL를 가하고, 상온에서 150 rpm으로 2시간 동안 교반한 후 여과(Whatman No. 2, 0.45 μm syringe filter)하였다. 여과액을 24 well plate에 1.5 mL씩 넣고 마이크로플레이트리더(MQX200R, BioTek, Winooski, USA)를 이용하여 420 nm에서 흡광도를 측정하였다.
아미노태 질소 함량은 Formol법을 일부 변형하여 측정하였다(AOAC, 1990). 5배 희석한 시료 추출액 5 mL와 증류수 10 mL, 중성 formalin 용액(0.1 N NaOH, pH 8.3) 10 mL 넣은 후 0.5% 페놀프탈레인 지시약을 가하고, 0.1 N NaOH 용액으로 pH 8.3(미홍색)이 될 때까지 적정하여 아미노태 질소 함량을 계산하였다.
암모니아태 질소 함량은 phenol-hypochloride 반응을 이용한 방법으로 측정하였다(Cho, 2017). 5배 희석한 시료 추출액 0.1 mL A 용액(phenol 5 g + sodium nitroprusside - dihydrate 0.025 g/DW 500 mL)과 B 용액[sodium phosphate dibasic 4.5 g + NaOH 3 g + sodium hypochlorite 용액(NACIO) 5 mL/DW 500 mL]을 순서대로 각각 2 mL씩 넣고, 37°C 항온수조에서 20분간 중탕 후 냉각하고 0.2 mL씩 96 well plate에 넣고 마이크로플레이트리더를 이용하여 630 nm에서 흡광도를 측정하였으며, ammonium sulfate(Sigma Chemical Co., María de Molina, Spain)를 이용한 표준곡선을 이용하여 암모니아태질소량을 계산하였다.
환원당은 DNS법을 이용하였다(KMFDS, 2015). 5배 희석한 시료 추출액을 10배 희석 후, 희석액 1 mL에 DNS 시약(A 용액 + B 용액, A 용액: 1% dinitrosalicylic acid + 4.5% NaOH + Rochelle염, B 용액: 결정 phenol 10 g + 10% NaOH 22 mL/DW 100 mL 용액 69 mL에 sodium bisulfate 6.9 g 용해) 3 mL를 넣고 100°C 항온수조에서 5분간 중탕하고 냉각 후, 0.2 mL씩 96 well plate에 넣어 마이크로플레이트리더를 이용하여 550 nm에서 흡광도를 측정하였다.
유리당은 시료 1 g에 10% acetonitrile(ACN)을 가해 10 mL로 정용한 후, 40°C에서 30분간 sonication으로 추출하고 원심분리 후 상등액을 0.45 μm syringe filter로 여과하였다. 시료 추출액은 HILICpak VG-50 4E(4.6×250 mm, 5 μm) 컬럼을 이용하여 HPLC(1260 infinity Ⅱ, Agilent Technologies, Santa Clara, USA)로 분석하였고, 분석조건은 이동상으로 3차 증류수 : ACN : MEOH = 10 : 87 : 3(1 mL/min), 가스 N2(1.3 mL/min), 컬럼온도 60°C, 주입량 10 μL, 검출기 ELSD(ET40, NT35)이었다. 유리당 함량은 fructose, glucose, galactose, sucrose, lactose(Sigma Chemical Co., Saint Louis, Netherlands) 표준물질의 농도에 대한 peak 면적의 표준정량곡선으로부터 계산하였다.
Protease 활성은 식품공전의 방법(제8. 일반시험법, 6.8.3.2)을 이용하여 측정하였다(KMFDS, 2015). 37°C에서 정확히 10분 동안 가온한 0.6% 카제인 기질용액(0.1 M phosphoric acid, pH 7.0) 0.5 mL에 2.5배 희석한 시료 추출액 0.1 mL를 넣고 잘 섞어, 37°C에서 정확히 10분 동안 반응 후 0.4 M TCA액 0.2 mL를 넣고 다시 37°C에서 25분 동안 반응을 중지시켰다. 공시험은 시료 추출액 0.1 mL를 100°C에서 15분간 효소 불활성화시킨 후 상온 냉각하고, 0.4 M TCA액 0.2 mL와 0.6% 카제인 기질 용액 0.5 mL를 넣고 37°C에서 25분 동안 반응시켰다. 0.45 μm 필터(PVDF, Ø13 mm)로 여과한 시험구와 공시험구 시험액 0.1 mL를 24 well plate에 넣고 여기에 Folin 시약 0.1 mL와 0.4 M Na2CO3 용액 0.5 mL를 순서대로 넣은 후, 37°C에서 20분 동안 발색시키고 마이크로플레이트리더를 이용하여 660 nm에서 흡광도를 측정하였다. 1 unit은 1분 동안 L-tyrosine(Sigma Chemical Co., Riedstr, Germany) 1 μg을 유리시키는 양을 환산하여 나타내었다.
α-Amylase 활성은 MAK009 kit(Sigma Chemical, Saint Louis, USA)를 이용하여 측정하였다. 시료 200 mg에 amylase assay buffer 1,000 μL를 넣어 조효소액을 만들어준 후, 96 well plate에 시료 추출액 10-50 μL와 amylase assay buffer 40-0 μL를 넣어 총 부피 50 μL를 만들어 준 후, MRM(Master Reaction Mix) 시액 100 μL를 넣고 잘 섞어주었다. 3분 후 마이크로플레이트리더를 이용하여 405 nm에서 흡광도를 측정하고, 25°C 인큐베이터(암소)에서 반응시키면서 5분마다 405 nm에서 흡광도를 측정하여, 20 nm nitrophenol 표준물질의 흡광도값과 비슷하거나 큰 값이 나올 때까지 측정하였다. 최종 흡광도값은 마지막 흡광도값 이전 값으로 하여 nitrophenol 표준물질의 농도에 대한 반응시간 동안 생성된 nitrophenol의 양(nmol)으로 그 활성을 계산하였다. 1 unit은 1분간 전분으로부터 포도당 1 μg을 분해하는 데 필요한 α-amylase의 양으로 정의한다.
산도는 5배 희석한 시료추출액 5 mL에 증류수 20 mL를 넣고 0.5% 페놀프탈레인 지시약을 가한 후 0.1 N NaOH 용액으로 pH 8.3(미홍색)이 될 때까지 적정하여 측정하였다(Choi 등, 2016).
유기산은 시료 0.5 g에 증류수 9.5 mL를 가하고 40°C에서 30분간 sonication으로 추출 및 원심분리 후, 상등액을 0.45 μm syringe filter로 여과하였다. 시료 추출액은 Supelco GEL C 610H(7.8×300 mm, 5 μm)와 Capcell Pak C18 MGⅡ 컬럼(4.6×250 mm, 5 μm; Osaka Soda, Osaka, Japan)을 이용하여 DAD 210 nm에서 HPLC (DE/1200, Agilent Technologies, Santa Clara, USA)로 분석하였고, 분석조건은 이동상 0.1% phosphoric acid, 유속 0.5 mL/min, 컬럼온도 30°C, 주입량 10 μL이었다. 유기산 함량은 oxalic acid, citric acid, tartaric acid, malic acid, succinic acid, acetic acid(Sigma Chemical Co.) 표준물질의 농도에 대한 peak 면적의 표준정량곡선으로부터 계산하였다.
바이오제닉 아민은 식품공전(제8. 일반시험법, 6.8.14.6.) 방법을 이용하여 측정하였다(KMFDS, 2015). 시료 5 g에 0.1 N 염산 25 mL를 가해 상온에서 200 rpm으로 10분 동안 진탕 추출 후, 원심분리 과정을 3회 반복하여 추출한 상층액을 모아 0.1 N 염산을 가해 50 mL로 정용하여 시험용액을 제조하였다. 시험용액은 유도체화한 후 Capcell Pak C18 MGⅡ 컬럼(4.6×250 mm, 5 μm)을 이용하여 DAD 254 nm에서 HPLC(Nanospace SI-2, Osaka Soda, Osaka, Japan)를 이용해 분석하였다. 분석조건은 이동상 A 용액(3차 DW)과 B 용액(100% ACN)의 농도구배, 유속 1.0 mL/min, 컬럼온도 40°C, 주입량 5 μL이었다. 유도체화는 시험용액 1 mL에 내부표준용액인 100 ppm 1,7-diaminoheptane 100 μL를 가한 후 포화탄산나트륨용액 0.5 mL와 에테르 5 mL를 가하고 10분간 진탕 후 상층액을 취해 질소 농축하고, ACN 용액 1 mL를 가하여 0.2 μm syringe filter로 여과하여 제조하였다. 바이오제닉 아민 함량은 putrescine, cadarverine, histamine, tyramine (Sigma Chemical Co.) 표준물질의 농도에 대한 peak 면적의 표준정량곡선으로부터 계산하였다.
알코올 함량은 GC/MS를 이용하여 HS-SPME 방법으로 분석하였다(Gil 등, 2016). 시료 1 g에 내부표준용액인 2.5% butanol(v/v in DW) 100 μL를 SPME vial에 넣어 분석시료를 준비하였다. Gas chromatography-mass (5977A MSD, Agilent Technologies, United States, U.S.A)를 사용하였고, 컬럼은 DB-wax(60 m×0.25 mm ×0.25 μm film thickness; Agilent Technologies, Santa Clara, USA), SPME fiber는 DVB/CAR/PDMS (50/30 μm)(Supelco, Bellefonte, USA)를 사용하였다. 분석조건으로 이동상 가스는 He(1.0 mL/min), 오븐 온도는 50°C에서 2분간 유지한 다음 분당 10°C씩 140°C까지 승온시킨 후 1분간 유지하고, 다시 분당 10°C씩 200°C까지 승온시켜 4분간 머물렀다. 오븐 온도의 ratio는 7°C/min, inlet mode는 split mode(split ratio 10:1), 시료 주입량은 1 μL, incubation 온도는 60°C이었다.
숙성지역 및 위치별 전통된장의 genomic DNA를 추출하기 위해 DNeasyPowerSoil kit(Qiagen, Hilden, Germany)를 사용하였다. 추출된 genomic DNA의 정밀한 농도 측정을 위해 PicoGreen(Invitrogen) 장비를 이용하여 정량화하였다. 추출한 DNA에서 세균 군집은 16SV3-4 영역을 타켓으로 하는 primer set을 사용하였고, 진균 군집은 ITS3-4(ITS2) 영역을 타켓으로 하는 primer set를 이용하여 Illumina Amplicon Metagenomic Sequencing Library 프로토콜에 따라 PCR을 수행하였다. 추출된 total genome DNA를 주형(template)으로 16S ribosomal DNA amplicon 및 ITS amplicon을 확보하기 위하여, V3-F(TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG), V4-R(GTCTCGTGGG CTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC)을 기반으로 하는 bacterial primer와 ITS3-F(TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGGCATCGATGAAGAACGCAGC) 그리고 ITS-4R(G TCTCGTGGGCTCGGAGATGTGTATAAGAGACAGTCCTCCGCTTATTGATATGC)을 기반으로 하는 ITS3-4 primer를 사용하여 1차 PCR을 진행하였다. 1차 PCR 생성물을 AMPure 비드(Agencourt Bioscience, Beverly, MA)로 정제 후, 1차 PCR 생성물 2 μL를 NexteraXT Indexed Primer를 사용하여 인덱스를 포함하는 최종 라이브러리 구축을 위해 2차 PCR을 진행했다. 2차 PCR 생성물은 AMPure 비드로 정제 후 생성물은 qPCR Quantification Protocol Guide(KAPA Library Quantificatoin kits for IlluminaSequecing platforms)에 따라 qPCR을 사용하여 정량화하고 TapeStation D1000 ScreenTape(Agilent Technologies, Waldbronn, Germany)로 증폭산물의 길이와 농도를 측정하였다. 최종 PCR 산물은 차세대염기서열 분석인 MiSeqTM platform(Illumina, San Diego, USA)을 사용하여 Macrogen Inc.(Seoul, Korea)에서 paired-end(2×300 bp) 시퀀싱을 수행하였다.
본 연구의 분석 결과는 모두 3회 반복 측정한 것으로 XLSTAT-Base program(Ver. Perpetual, Addinsoft Inc., NY, USA)을 이용하여 ANOVA(one-way analysis of variance) 분산분석 후, 95% 유의수준(p⟨0.05)에서 Duncan’s multiple range test로 각 실험군의 평균치 간의 유의성을 검정하였고, PCA(principal component analysis)로 여러 개의 변수를 2개의 중요한 주성분(principal component, PC)으로 축소하여 데이터의 전체 변수 사이의 관계를 분석하였다. 또한, 숙성지역 및 위치별 전통 된장 품질 특성에 영향을 주는 주요 인자를 평가하기 위한 Heat map, VIP score는 MetaboAnalyst 5.0에서 PLS-DA(partial least squares discriminant analysis)로 수행하였다.
3. 결과 및 고찰
된장 숙성 시 온도에 따른 장의 품온이 품질 특성과 미생물에 미치는 영향을 파악하기 위해 온도가 다른 숙성 장소별로 데이터 로거를 이용해 된장의 일일 품온을 측정하였고, 숙성지역 및 위치에 따른 연중 일일 품온과 외부온도는 Fig. 2(A), 월별 일일 최고 품온 결과는 Fig. 2(B)에 나타냈다.
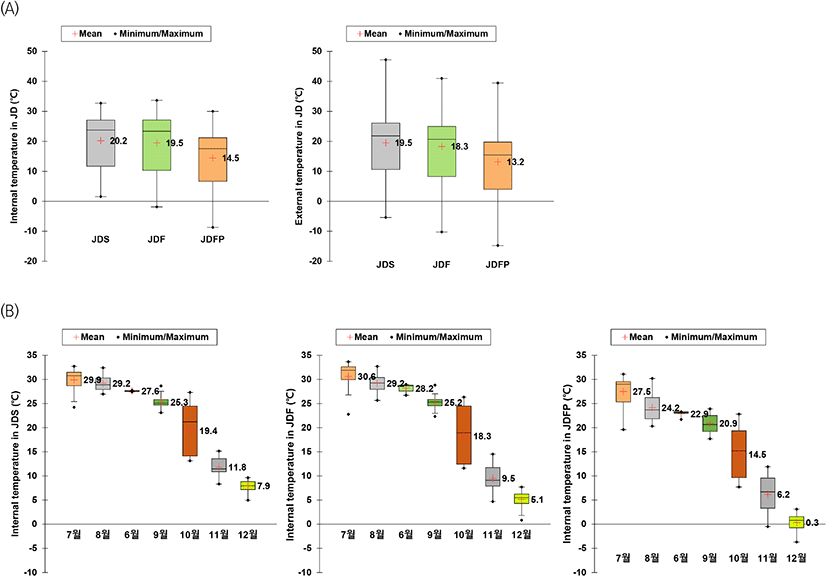
온도가 다른 숙성 장소별 연중 일일 된장 품온의 범위는 JDS 1.57-32.72°C, JDF −1.86-33.67°C, JDFP –8.70-30.00°C로, 최고와 최저의 차이는 JDS, JDF, JDFP 순으로 낮았으며, 평균 품온은 JDS 20.2°C, JDF 19.5°C, JDFP 14.5°C로 JDS가 가장 높았다. 특히, JDS는 숙성 초기인 여름철(6-7월)의 평균 품온이 28.20°C로, 28.77°C인 JDF보다 낮은 값을 나타냈고, 숙성 후기인 겨울철(11-12월)에는 8.77°C로, 6.60°C인 JDF보다 높았다. 연중 일일 외부온도 역시 평균온도와 겨울철뿐 아니라 여름철의 외부온도도 JDS가 가장 높았다. 또한, 월별 일일 최고 품온 역시 여름철(6-7월)에는 JDF, JDS, JDFP 순으로 높았고, 겨울철(11-12월)에는 JDS, JDF, JDFP 순으로 나타내 연중 일일 품온과 같은 결과를 보였다.
따라서, 뜨거운 여름철 된장 항아리의 외부온도는 노지보다 높을 수 있으나, 스마트 관리시설이 된장의 품온이 상승되는 것을 제어해 줄 수 있다는 것을 시사한다고 생각한다.
된장의 색은 맛과 함께 소비자 기호도에 큰 영향을 줄 수 있는 품질평가의 중요한 지표로서, 숙성 중 생성되는 아미노산과 당에 의해 갈색 색소인 멜라노이딘이 생성되어 장류의 색이 숙성 중 점차 갈색으로 변하게 된다(Ahn과 Bog, 2007; Gomyo과 Miura, 1983). Table 1의 서로 다른 지역 및 위치에 따라 숙성된 전통 된장의 품질 특성 비교를 보면, 숙성 전(JDB) 대비 숙성 후(JDS, JDF, JDFP)에 L*(명도) 53.69에서 43.70-48.61로 모두 감소하였고, a*(적색도)와 b*(황색도)는 9.42, 26.68에서 12.31-14.07, 26.90-31.59로 모두 증가하였다. 특히, JDFP는 JDS, JDF 대비 유의적으로 명도가 가장 높았고, 적색도와 황색도는 가장 낮은 값을 보였으며, JDF는 갈변의 정도를 알 수 있는 황색도와 갈변도(BI) 값이 JDS 대비 유의적으로 가장 높았다(p⟨0.0001). 이러한 갈변의 정도는 Fig. 1(B) 사진을 통해서도 알 수 있었으며, Im 등(2004)에 따르면 비지장의 숙성 시 명도는 숙성온도보다 숙성시간에서, 적색도와 황색도는 숙성온도에서 유의적인 차이를 보였고, 40°C에서 숙성한 비지장의 적색도와 황색도 값은 35°C에서 숙성시킨 것보다 그 값이 높게 나타났다고 한 것처럼, JDFP는 숙성속도가 느려 명도가 높았고, JDS보다 JDF에서 숙성 품온이 높아 갈변도가 높은 것으로 생각한다.
JDB, traditional doenjang of Damyang, Jeollanam-do before fermentation; JDS, traditional doenjang of Damyang, Jeollanam-do fermented in a smart fermentation management facility in Damyang, Jeollanam-do; JDF, traditional doenjang of Damyang, Jeollanam-do fermented in a fields in Damyang, Jeollanam-do; JDFP, traditional doenjang of Damyang, Jeollanam-do fermented in a field in Pyeongchang, Gangwon-do.
또한, 상관관계를 분석한 결과(p⟨0.05), L*값은 아미노태 질소와 강한 (−)의 상관관계(0.823)를 나타내었는데, 이는 아미노산이 증가할수록 갈색 색소의 증가로 감소하는 것으로 생각되며, 갈변도(BI)는 환원당, fructose, b* 값과 강한 (+)의 상관관계(0.844, 0.945, 0.987)를 나타내었으며, 이 역시 당이 증가할수록 갈색 색소의 증가로 갈변도와 b* 값이 증가하는 것으로 생각한다.
따라서 본 연구의 된장은 숙성 품온에 따라 단백질과 전분을 분해하는 효소의 생성 및 분해 작용이 영향을 받아 생성된 아미노산과 당에 의해 이러한 결과가 나타난 것으로 생각한다.
된장은 미생물에 의해 생성된 amylase의 높은 활성에 의해 탄수화물이 분해되어 숙성 초 환원당 함량이 높지만, 숙성이 진행될수록 미생물의 영양원, 알코올 및 유기산 숙성의 기질, Maillard 반응으로 유리당이 소모되어 감소하기 때문에(Choi 등, 2016; Kim, 1998), 환원당과 유리당 함량을 통해 된장의 숙성 진행 정도를 판단할 수 있다.
본 연구의 서로 다른 지역 및 위치에서 숙성된 전통 된장의 환원당과 유리당 결과를 Table 1에 나타내었다. 환원당은 된장의 숙성 전 2.33%에서 숙성 후에는 모두 0.11-0.18%로 감소하였고, 유리당은 숙성 전 fructose 1,698 mg/100 g, glucose 1,937 mg/100 g, galactose 556.7 mg/100 g이었으나 숙성 후 galactose는 검출되지 않았고 fructose는 570.6-881.3 mg/100 g, glucose는 567.9-1,239 mg/100 g으로 감소하였다. 이는 된장의 주요 당은 glucose와 fructose이었다고 보고한 Jeon 등(2016)의 결과와 된장의 유리당은 주로 glucose, fructose, galactose이었다고 보고한 Lee 등(2002)의 결과와 유사하게 나타났다.
또한, JDF, JDS, JDFP 순으로 환원당 및 유리당 함량이 유의적으로 높았다(p⟨0.0001). Sim 등(2018)은 숙성 24개월 이후에도 glucose, galactose 함량의 증감은 일정하지 않았으나 숙성 30개월 이후에는 검출되지 않았다고 하였고, Ku 등(2014)은 1년 이상 숙성된 된장의 대부분 당류는 분해된다고 하였기 때문에, 본 연구의 7개월 차 된장은 현재 숙성이 진행되고 있는 것으로 예측되며, JDF, JDS, JDFP 순서로 숙성 초기에 효소활성이 높아 많은 당을 생성하였으나 아직 숙성이 진행되고 있어 미생물의 영양원으로 모두 이용되지 못해 소모량이 적은 것으로 사료된다. 이에 더해 Lee와 Mok(2010)에 의하면 된장 숙성 시 전분질 원료의 분해로 환원당이 생성되는 속도가 미생물에 의해 이용되는 속도보다 높으면 총 함량이 증가한다고 하였다.
따라서 된장의 숙성온도가 숙성 초기 당 생성에 관여하는 미생물과 효소의 활성에 관여하여 같은 시료의 된장이 숙성온도별로 당의 생성과 소모가 서로 다른 것으로 생각한다.
된장의 아미노태 질소는 구수한 맛과 향미에 깊은 연관이 있으며 숙성 정도와 품질 수준을 알 수 있는 중요한 지표로, 그 기준은 식품공전에서 160 mg%, 전통 식품 표준규격에서 300.0 mg% 이상 함량이 높으면 장류의 성분 면에서 좋은 것으로 평가된다(Lee 등, 2013; Rho 등, 2008). 또한, 암모니아태 질소는 발효식품에서 이상발효의 지표로 사용되어 그 함량이 낮을수록 우수한 품질로 평가되는 된장이다(Choi 등, 2016). 본 연구의 서로 다른 지역 및 위치에서 숙성한 된장의 아미노태 질소 및 암모니아태 질소 함량은 Table 1에 나타냈다.
아미노태 질소 함량은 숙성 전 178.2 mg%에서 숙성 후 평균 4배 정도 증가한 JDFP 649.5 mg%, JDF 710.3 mg%, JDS 804.7 mg%로 연중 일일 평균 품온이 높은 순으로 아미노태 질소 함량이 높았는데, Im 등(2004)에 따르면 비지장의 숙성 시 35°C보다 40°C에서 숙성할 때 비지장의 아미노태 질소 함량 및 수용성 질소 함량이 더 높았던 결과와 유사하였다. 또한, 상관관계를 분석한 결과(p⟨0.05) 아미노태 질소 함량은 protease 활성과 약한 (+)의 상관관계(0.238)를 나타냈으나, 숙성 초기 주요 유기산인 acetic acid, oxalic acid와 강한 (+)의 상관관계(0.988, 0.961)를 나타냈다. 이는 아미노태 질소가 많이 생성된 시기에 유기산도 증가하여 protease의 활성이 감소되는 것으로, 아미노태 질소 함량과 protease의 활성의 낮은 상관성을 설명할 수 있을 것으로 생각한다.
암모니아태 질소 함량은 숙성 전 150.9 mg%에서 숙성 후 평균 2.7배 감소한 JDS 53.55 mg%, JDF 55.36 mg%, JDFP 58.57 mg%로 아미노태 질소와 시료 간 상반되는 경향을 보였는데, 이들의 상관관계를 분석한 결과(p⟨0.05), 암모니아태 질소 함량은 아미노태 질소와 강한 (−)의 상관관계(0.914)를 나타냈다.
따라서 된장의 숙성 중 아미노태 질소 및 암모니아태 질소는 효소의 작용보다 연중 일일 평균 품온과 높은 관련이 있을 것으로 생각한다.
된장의 단맛과 구수한 맛의 결정은 된장의 주원료인 콩 전분과, 단백질을 가수분해하는 발효에 관여하는 미생물에 의해 분비되는 amylase와 protease 효소활성이 깊은 관련이 있으며, 이들의 결과는 Table 1에 나타냈다.
α-Amylase 활성은 숙성 전 0.17 unit/g이었으나, 숙성 후에 JDF 0.11 unit/g, JDS 0.13 unit/g, JDFP 0.15 unit/g으로, 서로 유의적인 차이를 보이며 모두 감소하였다(p⟨0.05). Jana와 Pati(1997)에 따르면 amylase 활성은 pH와 온도의 영향을 받는데, α-amylase 활성의 최적 pH는 6.0 정도였고, 숙성기간이 경과되면서 pH나 염 등의 농도에 의해 효소의 활성이 저해되었다고 보고하였으며, Kim 등(2006)은 된장 숙성 초기에 α-amylase는 높은 활성을 나타내다 숙성이 진행되면서 기질로 사용되는 탄수화물이 고갈됨에 따라 점차 활성이 낮아진다고 하였고, Im 등(2004)은 amylase 활성은 비지장의 숙성 초기 12시간 동안 급격히 증가하다 감소하였고, 35°C보다 40°C에서 더 높은 활성도를 보였다고 보고하였는데, 본 연구와 유사한 결과를 보였다.
Protease 활성은 숙성 전 63.16 unit/g이었으나, 숙성 후에 JDF만 28.42 unit/g으로 감소하였고, JDFP와 JDS는 각각 75.79 unit/g, 85.26 unit/g로 증가하였다(p⟨0.05). Im 등(2004)에 의하면 단백질의 가수분해 시 중성 protease가 주로 관여하며, 활성도는 비지장의 숙성온도와 상관없이 감소하다가 점차 증가하였다고 보고하였고, 본 연구와 유사한 결과를 보였다.
이들의 상관관계를 분석한 결과(p⟨0.05), α-amylase 활성은 환원당, fructose, 유기산, 갈변도와 강한 (−)의 상관관계(0.940, 0.969, 0.969, 0.926)를 나타내었고, protease 활성은 lactic acid, glucose와 강한 (−)의 상관관계(0.806, 0.809)를 나타내었으며, 이를 통해 숙성이 잘 진행되면 당과 유기산의 생성으로 α-amylase 및 protease 활성도는 떨어지는 것으로 판단되었다.
따라서, α-amylase 활성도는 연중 일일 평균 품온보다 여름철 일일 평균 품온이 높았던 JDF, JDS, JDFP 순으로 높아 여름철 평균 품온이 α-amylase 활성도에 영향을 미치는 것으로 사료되며, protease 활성은 숙성온도보다 산도에 따른 영향이 더 큰 것으로 생각한다.
된장이 숙성됨에 따라 미생물의 대사로 인해 생성되는 유기산은 된장의 맛에 영향을 주며, 적당량은 pH를 낮춰 된장의 보존성에도 관여하는 중요성분(Jeon 등, 2015)으로 그 함량과 그로 인한 산도의 결과는 Table 1에 나타냈다.
산도는 숙성 전 대비 JDFP는 감소하였고 JDF와 JDS는 증가하였으며, 서로 유의적인 차이를 나타냈다(p⟨0.05). 일반적으로 산도 변화는 된장의 숙성 중 미생물의 대사 작용으로 인해 lactic acid, acetic acid, oxalic acid 등 유기산의 축적으로 산도가 높아졌다가 이후 미생물에 의해 대사되고 ester 등의 풍미 형성에 이용되어 낮아진다(Kim 등, 2008; Shim, 2018). 또한 Im 등(2004)은 숙성온도가 높았던 비지장의 pH가 더 낮았고 총산 함량이 더 높았다고 보고하였다. 따라서 본 연구 결과에서 산도가 높았던 JDF와 JDS는 숙성온도의 영향을 받은 것으로 판단되었으며, JDFP는 숙성속도가 늦어 유기산의 소비 속도가 생성 속도를 상회하여 숙성 초 대비 감소한 것으로 생각한다.
본 연구에서 제조한 된장의 숙성 전 유기산은 oxalic acid, malic acid, acetic acid, lactic acid 4종으로 lactic acid가 주요 유기산이었으며, 숙성이 진행되면서 malic acid는 완전히 소모되었고 oxalic acid는 감소하였으며, acetic acid, lactic acid는 모두 증가하였다(p⟨0.05). 숙성지역 및 위치에 따른 유기산 함량은 JDFP 624.1 mg/100 g, JDS 795.2 mg/100 g, JDF 897.4 mg/100 g으로 숙성 전 대비 약 2.9, 3.7, 4.2배 증가하였으며, 온도 차에 따른 주요 유기산은 JDS와 JDFP에서 acetic acid, JDF에서 lactic acid이었다. Axelsson 등(1998)의 연구에서 숙성 12개월 전 된장의 주요 유기산은 acetic acid였으나, 휘발과 유산균에 의한 대사 작용으로 12개월 이후의 주요 유기산은 lactic acid이었다고 보고된 것처럼, 본 연구에서 JDF는 주요 유기산이 lactic acid로 JDS 및 JDFP보다 숙성이 더 빠르게 진행되었고, 이는 여름철 평균 품온과 유사한 결과를 보여 결론적으로 연중 품온보다 여름철 품온이 숙성 속도에 영향을 미치는 것으로 생각한다.
또한, 상관관계를 분석한 결과(p⟨0.05), 유기산은 환원당, 갈변도, b*값과 강한 (+)의 상관관계(0.964, 0.954, 0.989)를 나타냈으며, 산도는 당 및 유기산 관련 품질과 강한 (+)의 상관관계를 나타냈었다. 이는 숙성이 진행될수록 당 함량이 증가하며, 이는 미생물의 영양원으로 이용되어 많은 유기산을 생성하고, 이러한 유기산과 당을 기질로 미생물의 대사 작용과 Maillard 반응을 일으켜 갈색 색소를 생성하는 것을 잘 설명해 주는 결과로 생각한다.
따라서, 산도와 유기산은 숙성 초기인 여름철 평균 품온에 따른 숙성속도에 따라 미치는 영향이 다른 것으로 생각한다.
바이오제닉 아민(biogenic amine, BA)은 식품의 안전을 좌우하는 주요 인자로, 식품의 발효나 저장 과정 중 미생물의 작용에 의한 amino acid decarboxylase 반응으로 생성되며, 생체기능을 유지하기 위한 필수 대사물질이지만 과량으로 섭취할 때 혈압 저하와 알레르기(histamine), 혈압상승과 두통(tyramine), 장내 미생물 대사를 통해 발암물질인 nitrosamine, nitropiperidine으로 전환(putrescine 및 cadarverine)될 수 있다(Warthesen 등, 1975). 따라서 식품의 안전성 측면에서 우리나라는 냉동어류, 염장어류, 통조림, 건조/절단한 해산물 내 histamine에 대해서 200 ppm 이내로 권장 규격을 설정하여 관리하고 있지만(KMFDS, 2015), 전반적인 식품에 대한 다른 아민류의 기준은 마련되어 있지 않다(Ten Brink 등, 1990). 일반적으로 장류의 원료인 콩은 단백질이 발효되는 동안 다양한 미생물들의 protease에 의해 저분자 펩타이드, 아미노산 및 암모니아로 분해되고, decarboxylase에 의해 아미노산의 카르복실기가 제거됨으로써 다량의 바이오제닉 아민이 생성될 수 있으며, 바이오제닉 아민의 합성 효소인 amino acid decarboxylase는 Bacillus, Clostridium, Proteus, Lactobacillus, Pediococcus, Streptococcus를 포함하는 대부분의 발효 관련 미생물들에서 발견되었고(Karovičová and Kohajdová, 2005), 유산균이 바이오제닉 아민 생산에 주된 역할을 하는 것으로 보고되었다(Coton 등, 2010).
서로 다른 지역 및 위치에서 숙성한 전통 된장의 바이오제닉 아민 함량 결과는 Fig. 3에 제시하였다. 된장의 바이오제닉 아민은 숙성 전과 후 모두 4종 중 putrescine과 tyramine만 검출되었고, 모두 기준 이하인 0.009-0.044 ppm으로 미량 검출되었다. 특히, JDS는 숙성 전 대비 0.015 ppm 증가하였는데 이는 JDS에서 바이오제닉 아민에 관련된 미생물인 Bacillus, Clostridium, Pediococcus, Streptococcus 속 비율이 62.99%로 가장 높았다. 직접 영향을 주는 균주는 확인되지 않았지만, 관련 미생물의 비율이 바이오제닉 아민 함량에 영향을 미친 것으로 판단되며, 가을, 겨울철 온도도 높게 유지되어 관련 미생물 생육에 영향을 미친 것으로 사료된다. 하지만 Kim(2021)의 연구에 의하면 재래식 장류 제품 내 바이오제닉 아민의 함량은 된장의 숙성 단계에서 추가적인 증가가 일어나지만, 일정 기간 미생물의 작용이 완료되면 생성된 바이오제닉 아민이 미생물에 의해서 대사되면서 감소한다고도 보고하였다.
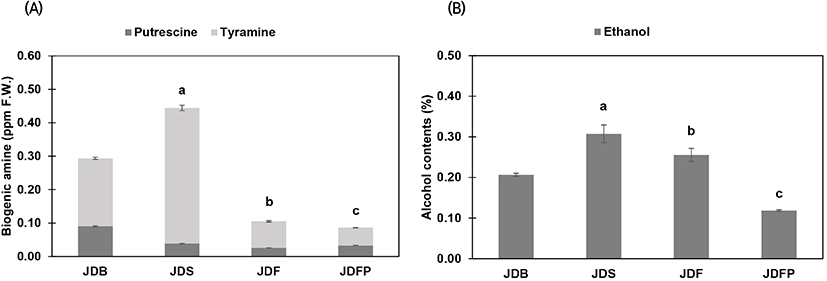
알코올은 된장 숙성 중 미생물에 의해 당이 알코올로 전환되어 생성될 수 있으며(Gil 등, 2016), 이는 된장의 숙성 및 저장 중 CO2 생성에 영향을 미칠 수 있다. Fig. 3에 제시한 알코올(에탄올) 함량은 된장 숙성 후 JDS와 JDF는 숙성 전보다 함량이 증가하여, JDS는 0.31%, JDF는 0.26%이었으며, JDFP는 숙성 전보다 낮은 0.12%를 나타내었다. 알코올은 된장 숙성 중기 이후 지속적으로 증가하는데(Lee, 2008), 이는 알코올이 젖산 숙성 후 알코올 숙성으로 진행된 산물로 JDFP에서 낮은 알코올 함량을 보인 것은 온도가 낮아 숙성 속도가 느렸기 때문이며, JDS는 숙성 속도보다 겨울철 높은 온도로 알코올 숙성 미생물에 의한 영향이 더 큰 것으로 생각한다.
따라서 본 연구 결과, 일일 품온이 연중 높았던 JDS에서 그 함량이 기준치 이하였지만 바이오제닉 아민과 알코올 생성에 관여하는 미생물 생육에 적합하여 JDF, JDFP보다 더 높은 것으로 생각한다.
다수의 미생물이 관여하는 장류 숙성의 경우, 미생물 대사 제어는 어려운 일이기 때문에 우점 미생물의 역할은 중요하다(Oh 등, 2014). 따라서 서로 다른 지역 및 위치에서 숙성한 된장의 미생물 군집 변화를 확인하기 위해 세균과 진균의 군집 분석을 수행하여 Fig. 4에 제시하였다.
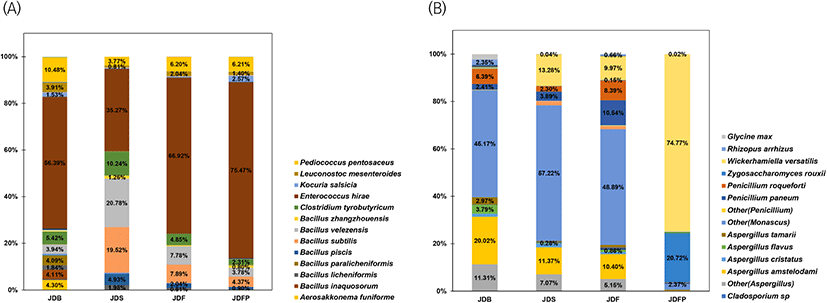
세균의 분포도를 문(phylum) 수준에서 보았을 때, Firmicutes 문이 숙성 전 92.90%에서 숙성 후 96.31-99.55% 수준으로 더 증가하여 우점하고 있었으며, 다음으로 높았던 Cyanobacteria 문은 4.30% 수준에서 숙성 후 0.00-0.01% 수준으로 감소하였다. 속(Genus) 수준에서 보았을 때, 총 35종의 세균 속이 검출된 숙성 전 된장을 우점하고 있는 Enterococcus 속은 57.46%, Bacillus 속은 15.14%, Pediococcus 속은 10.48%이었고, 숙성 후에는 총 50종으로 증가했으며, Enterococcus 속은 35.35-95.84%, Bacillus 속은 10.28-48.99%, Clostridium 속은 2.31-10.24%로 그 수준이 높아졌고 Pediococcus 속은 3.77-6.21%로 낮아졌으며, Enterococcus 속과 Bacillus 속은 숙성 전과 후 모두 우점하고 있었다. 종(species) 수준에서는 숙성 전 총 49종에서 숙성 후 총 72종의 세균이 관여하는 것으로 확인되었다. 특히 숙성 후에 우점하고 있던 Bacillus 속은 고초균인 Bacillus subtilis(Fig. 4(A), apricot color), Bacillus velezensis(Fig. 4(A), gray color), Enterococcus 속은 유산균인 Enterococcus hirae (Fig. 4(A), brown color), Pediococcus 속은 유산균인 Pediococcus pentosaceus(Fig. 4(A), yellow color), Clostridium 속은 Clostridium tyrobutyricum(Fig. 4(A), green color)이 주로 우세하였다.
본 연구 결과, 속 수준에서 숙성지역 및 위치에 따른 된장에 관여하는 세균 수가 JDS 17종, JDF 18종, JDFP 27종으로, JDF와 JDFP는 Enterococcus 속이 각각 66.95%, 75.84%로 우세하였고, JDS는 Bacillus 속이 48.99%, Enterococcus 속이 35.45%로 우세하였다. 특히, 식품 및 의약 산업에서 안전한 GRAS 균주로 전통 발효식품에서 Aspergillus sp.가 생산하는 아플라톡신 등의 발암물질 생성 및 균체의 생육을 억제하며, amylase, protease, cellulase 효소를 생산하여 된장 숙성에 유용한 미생물인 B. subtilis(Ryu 등, 2007; Yang 등, 2014)와 바이오제닉 아민을 분해하는 B. licheniformis(Kim 등, 2012)는 숙성 후 JDS에서 19.52%, 1.98%로 가장 높은 수준이었으며, JDF는 7.89%, 0.81%, JDFP는 4.37%, 0.36%로 확인되었다. 또한, JDF와 JDFP의 우점균이었던 E. hirae는 장구균 감염의 주요 원인 물질이며, 바이오제닉 아민(히스타민, 카다베린)을 생성하는 균주이고(Lee and Andrew, 2020), P. pentosaceus는 잠재적인 프로바이오틱 균주이며 항염증, 항암, 항산화 효과로 주목받고 있는 유망한 젖산균이다(Shiman 등, 2021).
곰팡이의 분포도를 문(phylum) 수준에서 보았을 때, Ascomycota 문이 숙성 전 93.90%에서 숙성 후 99.09-99.98% 수준으로 더 증가하여 우점하였으며, 다음으로 높았던 Mucoromycota 문은 2.85% 수준에서 숙성 후 0.02-0.78% 수준으로 감소하였다. 속(Genus) 수준에서 보았을 때, 총 13종의 진균 속이 검출된 숙성 전 된장에 우점하고 있는 Aspergillus 속은 39.57%, Monascus 속은 45.17%, Penicillium 속은 9.10%이었으며, 숙성 후에는 진균 속이 총 17종으로 증가했고 Aspergillus 속은 0.64-21.15%로 낮아졌으며, Monascus 속과 Penicillium 속은 각각 2.43-59.05%, 0.63-19.23%로 증감되었으며 Wickerhamiella 속과 Zygosaccharomyces 속이 새로운 주요 우점균으로 확인되었다. 종(species) 수준에서는 숙성 전 총 26종에서 숙성 후 총 40종의 진균이 관여하는 것으로 확인되었다. 특히 숙성 후에 우점하고 있던 Aspergillus 속은 A. amstelodami(Fig. 4(B), yellow color), Wickerhamiella 속은 W. versatilis(Fig. 4(B), light yellow color), Penicillium 속은 P. paneum(Fig. 4(B), dark blue color)과 P. roqueforti(Fig. 4(B), dark orange color), Zygosaccharomyces 속은 Z. rouxii(Fig. 4(B), blue color)가 우세하였다. 본 연구 결과, 속 수준에서 숙성온도별 된장에 관여하는 진균 수가 JDS 12종, JDF 14종, JDFP 7종으로, JDFP는 효모인 Wickerhamiella 속과 Zygosaccharomyces 속이 74.77%, 21.26%로 우세하였고, JDS와 JDF는 Aspergillus 속이 각각 21.15%, 19.46%, Monascus 속이 각각 59.05%, 50.27%, Penicillium 속이 각각 6.28%, 19.23%로 우세하였다. 또한, Aspergillus 속 중 아플라톡신을 생성할 수 있는 A. flavus(Lee 등, 1993)는 JDS(0.28%)나 JDFP(0.08%)보다 JDF(0.86%)에서 더 높은 수준으로 검출되었다는 것을 알 수 있었다.
최종적으로, JDFP 된장에 관여하는 미생물 중 진균보다 세균의 종류가 더 높았으나, 특히 낮은 온도에서 생육하면서 당을 이용하여 향을 생성하는 효모인 W. versatilis와 Z. rouxii가 95.49%를 차지하여 주로 영향을 주는 미생물로 예측되었다. 또한, JDF와 JDS는 관여하는 세균과 진균의 수준이 비슷하였지만 JDS는 B. subtilis, B. velezensis가 40.30%를 차지하였고, JDF는 E. hirae가 66.92% 차지하여 이들 균주가 주로 영향을 주는 미생물로 예측되었고, JDF는 JDS에 비해 가을·겨울철(9-12월) 품온이 낮아 젖산균의 영향을 더 받은 것으로 생각한다.
서로 다른 지역 및 위치에서 숙성한 전통 된장의 품질특성 데이터를 주성분 분석(principal component analysis, PCA) 통계 방법을 이용하여, 본래의 데이터값을 중심으로 새로운 차원의 변수(principal component, PC)를 만들어 변수를 간략화하였고(Lawless and Heymann, 1998), PC 축을 중심으로 숙성 여부 및 온도에 따른 분산 결과는 Fig. 5에 나타냈다.
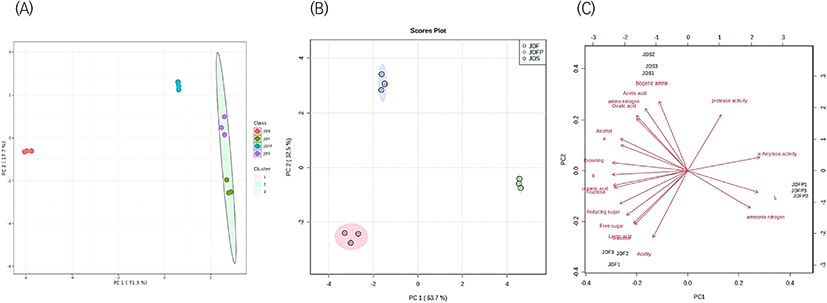
Fig. 5(A)는 된장의 숙성 여부를 품질특성을 기반으로 주성분 분석을 한 것으로, PC1이 71.3%이었으며 PC2가 27.7%이었다. 이 결과를 통해 JDF와 JDS는 상관성이 매우 높은 수준이었고 JDB와 (−)의 상관성을 가졌으며, JDFP는 PC1 축의 0에 가까이 위치한 것을 통해 JDF 및 JDS에 비해 숙성의 정도가 더딘 것을 알 수 있었다.
Fig. 5(B), 5(C)는 된장의 숙성지역 및 위치에 대한 품질특성을 기반으로 주성분 분석을 한 것으로, PC1이 63.7%이었고 PC2가 32.5%이었다. 이 결과를 통해 PC1에 따라 JDS 및 JDF는 JDFP와 (−)의 상관성을 가지며, PC2에 따라 JDF 및 JDFP는 JDS와 (−)의 상관성을 갖는 것을 알 수 있었다. 이러한 결과를 도출시킨 주요 영향인자를 보면, PC1 변수에는 Fig. 5(C)의 제 1, 3사분면에 있는 효소활성과 L*값이며, JDFP가 숙성 속도가 늦어 이러한 품질특성 결과가 높은 것으로 사료된다. PC2 변수에는 제 2사분면에 있는 바이오제닉 아민, 아미노태 질소, acetic acid와 제 4사분면에 있는 산도, lactic acid, glucose로 JDF가 JDS보다 숙성 속도가 빠르다는 것을 알 수 있었고, JDS가 연중 평균 품온은 높았으나 여름철 품온이 JDF보다 낮았기 때문으로 숙성 초기 여름 온도가 숙성 속도와 상관이 있다는 것을 예측할 수 있었다.
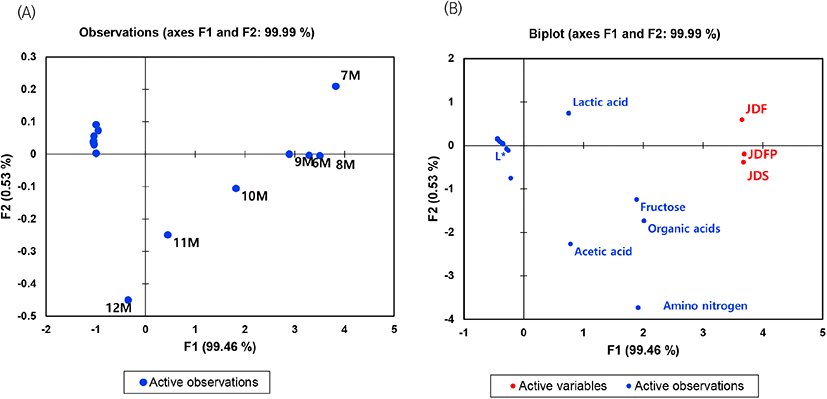
이는 숙성온도에 따른 된장의 품질특성, 미생물, 월별 품온을 기반으로 주성분 분석을 한 Fig. 6을 통해 확인한 결과, 연중 온도가 가장 높았던 7월의 품온이 높은 JDF에서 lactic acid 함량이 높았으며, 주로 Penicillium 속 미생물이 높은 비율을 보였다. 또한, 10-11월 온도가 높았던 JDS에서 acetic acid 함량이 높았으며, 주로 Bacillus 속 미생물 비율이 높았다.
또한, 이러한 상관성과 주요 영향요인을 결정하기 위해 데이터의 값을 컬러로 변환시켜 열 분포 형태로 시각화한 Heat map과, 두 집단을 구분하는 PLS-DA 분석을 통해 각각의 변수들이 기여한 정도의 차이를 나타내는 VIP (variable importance in projections) score를 Fig. 7에 나타내었다. Fig. 7(A)의 Heat map에서 확인한 결과, JDFP는 amylase 활성, L*, 암모니아태 질소가 높은 시료였으며, JDF와 JDS는 a*, b*, 갈변도, 알코올, fructose, 유기산은 유사하였으나, JDF는 lactic acid, 산도, 유리당, 환원당, glucose가 높은 시료였고, JDS는 oxalic acid, acetic acid, 아미노태 질소, 바이오제닉 아민이 높은 시료임을 한눈에 알 수 있었다. 또한, Fig. 7(B)의 VIP score는 1.0 이상은 군집 간의 유의적인 차가 큰 것으로 간주하는데, 본 연구에서 JDS는 바이오제닉 아민, protease 활성, acetic acid, JDF는 산도, glucose, lactic acid, 환원당에서 1.2 이상으로 유의차가 커 다른 시료와 확연하게 차이를 볼 수 있는 품질특성이었다.
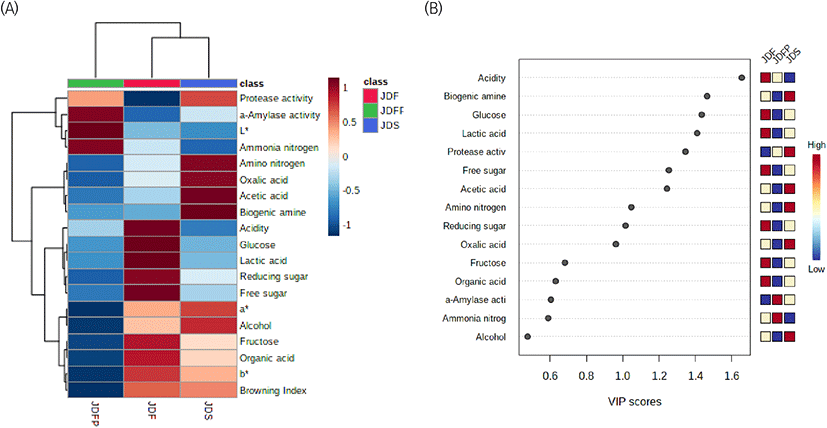
따라서, 전통 된장은 온도에 따라 숙성 속도에 차이가 있다는 것을 확인할 수 있었으며, 이에 대한 주요 영향인자로써 품질특성은 산도, 바이오제닉 아민, glucose, lactic acid 함량을 확인하는 것이 바람직할 것으로 생각한다.
서로 다른 지역 및 위치에서 숙성한 전통 된장의 미생물 군집 데이터를 주성분 분석을 하였고, PC 축을 중심으로 숙성온도에 따른 세균과 진균의 분산 결과는 Fig. 8에 나타냈다.
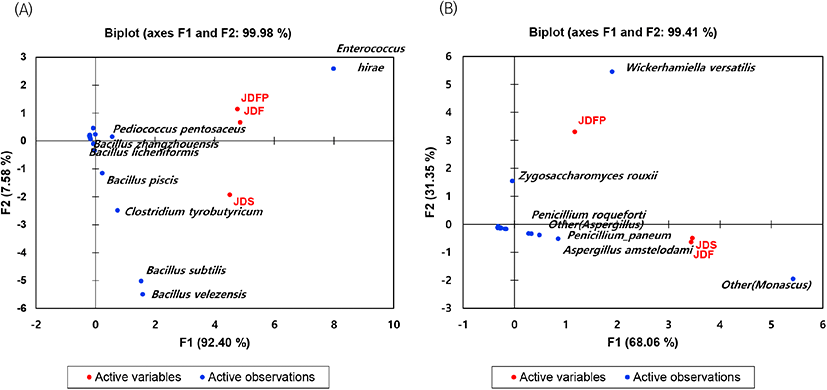
Fig. 8(A)는 된장의 숙성지역 및 위치에 의한 세균 군집을 기반으로 주성분 분석을 한 것으로 군집의 수준이 높아 숙성에 주로 관여하는 미생물을 설명하는 PC1은 92.40%이었고, 젖산균과 고초균 등 세균의 종류를 설명하는 PC2는 7.58%이었다. JDFP와 JDF는 E. hirae가 높은 수준을 보였던 시료로 서로 상관성이 매우 높았으며 JDS는 (−)의 상관성을 가지며 B. subtilis, B. velezensis, C. tyrobutyricum이 높은 수준임을 나타냈다.
Fig. 8(B)는 된장의 숙성지역 및 위치에 의한 진균 군집을 기반으로 주성분 분석을 한 것으로, 군집의 수준이 높아 숙성에 주로 관여하는 미생물을 설명하는 PC1은 68.06%이었고, 효모와 곰팡이 등 진균의 종류를 설명하는 PC2는 31.35%이었다. 진균은 세균과 달리 JDF와 JDS 시료가 서로 상관성이 매우 높았으며 Aspergillus 속과 Penicillium 속이 좀 더 높은 수준을 보였고 JDFP는 (−)의 상관성을 가지며 W. versatilis와 Z. rouxii가 높은 수준임을 나타냈다.
즉, 세균 군집에 대해 JDF 및 JDFP가 JDS와 (−)의 상관성을 보이는 것은, 세균의 생육온도 대비 겨울철 온도가 낮은 경우 세균의 활성이 떨어지기 때문에 겨울철 온도가 높았던 JDS와 온도가 낮았던 JDF 및 JDFP에 영향을 주는 세균이 서로 다른 것으로 사료된다. 또한, 진균 군집에 대해 JDF 및 JDS가 JDFP와 (−)의 상관성을 보이는 것은, 진균의 생육온도가 30°C이나 여름철 온도가 약 28°C였던 JDF와 JDS는 높은 온도에서 숙성되었지만, JDFP는 여름철 온도가 약 23°C로 평균 5°C 낮은 온도에서 숙성되었기 때문에 영향을 주는 진균이 서로 다른 것으로 생각한다.
