1. 서론
메밀은 식물분류학적으로 대부분의 곡식과 달리 특이하게도 마디풀과(Polygonaceae)의 메밀속에 속하는 일년생 초본이다. 또한, 생약으로 쓰이는 하수오, 소리쟁이, 대황, 수영 등과 같은 과에 속해 있다. 현재 전 세계적으로 재배되고 있는 메밀의 종류는 크게 재배종과 야생종으로 구분된다(Jeong 등, 2014). 재배종은 보통메밀(Fagopyrum esculentum Moench, 단메밀)과 달단메밀(Fagopyrum tartaricum Gaertn. 쓴메밀 또는 타타리메밀) 등 두 종이 주류를 이룬다(Weisskopf과 Fuller, 2014). 한반도에서는 그 중에서도 재배종인 보통메밀이 주로 많이 재배되어 왔다. 메밀의 주요 생산국은 중국, 러시아, 우크라이나, 카자흐스탄, 슬로베니아 등이다. 그 중에서도 동남아시아를 비롯한 아시아의 넓은 지역의 척박한 땅 또는 비교적 해발이 높은 산지에 적합한 작물로 재배되어 왔다.
메밀에는 ‘루틴(Rutin)’ 성분이 많이 들어 있다. 루틴은 플라보노이드 배당체로 식물의 갈색 색소 성분이다(Jiang 등, 2007). 혈관을 튼튼하게 해 고혈압 환자에게 특히 좋다(Zhu, 2021). 예부터 머리에 열이 몰린 경우, 메밀베개를 베고 자면 머리가 맑아지고 어지러움을 예방할 수 있다 믿어 베갯속에 메밀을 넣었다. 또한, 메밀은 위와 장을 튼튼하게 한다. 음식을 먹고 나서 속이 울렁거릴 때 속을 개운하게 한다. 설사, 딸꾹질, 장이 자주 뭉칠 때 효과가 있다(Giménez-Bastida과 Zieliński, 2015; Kreft 등, 2022; Ren 등, 2021). 한국 고유의 농산물 유래 천연 식물인 메밀의 잎은 체내 지질대사 개선, 항비만, 항산화 및 항염/암 효과를 가지고 있는 gallic acid, chlorogenic acid, epicatechin, benzoic acid 그리고 quercetin 등과 같은 phenylpropanoid 계통 물질을 함유하고 있다(Bernatova, 2018; Huang 등, 2018; Hwang 등, 2018; Salehi 등, 2020). 또한, 메밀 잎 추출물은 식이 섭취량에는 영향을 미치지 않았으나, 고지방식으로 인한 체지방 및 혈장 leptin 수준 증가 현상을 억제하는 것으로 나타났다(Jung 등, 2011). 메밀 잎은 루틴(rutin)을 비롯하여 다양한 phenylpropanoid 계통 물질이 함유되어 있으나, 메밀 잎을 이용한 메밀즙 생산에 관한 보고나 상품이 아직 없는 것으로 나타났으며, 메밀즙 제조 공정에 따른 기능성 물질 함량의 변화 등에 관한 과학적인 데이터가 없는 실정이다.
따라서 본 실험에서는 기능성 물질 고함유 메밀 잎 생산을 위한 적합한 품종 선별과 메밀 잎을 온도별 열수추출 조건에 따라 추출한 메밀즙의 가공 특성을 비교하기 위해 HPLC를 이용하여 메밀 잎 추출물의 phenylpropanoid 함량을 분석함으로써 메밀 잎 열수 추출에 따른 메밀즙의 품질 특성에 대한 기초 자료를 제공하고자 하였다.
2. 재료 및 방법
본 연구에 사용된 메밀은 보통메밀(F. esculentum)품종 6종(미국 품종, 일본 HS4251, 대원, 대관, 대산, 그리고 양절)을 재배하여 생식생장기 전단계에서 수확하여 메밀 잎 추출물 phenylpropanoid 함량을 분석하였다. Catechin, gallic acid, chlorogenic acid, caffeic acid, (-)-epicatechin, benzoic acid, rutin의 표준품은 씨그마알리치코리아로부터 구매되었으며, trifluoroacetic acid(99%. EP) 및 HPLC 전용 methanol은 대정화금으로부터 구매하여 사용하였다.
6종의 보통메밀 잎을 수확하여 액체질소(−196°C)로 동결하고 동결건조기(FD8512, ilShinBioBase Co., Ltd., Gyounggi-do, Korea)를 이용하여 건조하여 분석 전까지 보관하였다. 건조된 6종의 보통메밀 잎을 막자 사발을 이용하여 세밀하게 분쇄하여 각각 0.1 g씩 정량하여 15 mL conical tube에 담았다. 각각의 conical tube에 1.5 mL의 methanol(80:20, v/v)을 넣고 20초간 강하게 진동 혼합한 뒤, 60°C로 설정된 항온수조에서 1시간 동안 음파처리를 강하게 처리한 후 원심분리를 통하여 상층액을 취하였다. 동일한 과정을 2회 반복하여 메밀 잎 추출액을 모은 뒤 질소가스를 이용하여 증발시켜 1.5 mL의 methanol을 넣고 재희석하였다. 추출액은 0.45 μm PTFE syringe filers(MF-Millipore, Darmstadt, Germany)로 여과처리하여 갈색의 HPLC vial에 투입하고, phenylpropanoid 계통 물질 HPLC 분석을 준비하였다.
기존 논문으로 보고된 메밀 추출방법에 따르면 용매를 첨가하여 60°C에 추출하였을 때 rutin 함량이 최적임을 확인하였다(Choung 2005; Jeon 등, 2015; Kim 등, 2017; Shin 등, 2020). 따라서, 열수 추출을 기반으로 하는 본 연구는 이를 참고하여 건조된 대관 품종 메밀 잎 추출 조건을 60, 70, 80, 90, 그리고 100°C로 열수추출 방법으로 3시간 동안 각 온도의 메밀 잎을 추출하여 phenylpropanoid 함량이 최대로 함유된 최적조건을 조사하였다. 추출한 각각의 메밀 추출액은 −80°C로 동결하고, 동결건조기(FD8512, ilShinBioBase Co., Ltd., Korea)를 이용하여 건조하였다. 건조 분말을 각각 0.1 g씩 정량하여 15 mL conical tube에 담은 후, 위의 메밀 잎과 동일하게 전처리하였다.
High-performance liquid chromatography(HPLC) 분석은 OptimaPak C18 column(250 mm×4.6 mm, 5 μm; RStech; Daejeon, Korea)가 결합된 Agilent Technologies 1200 series HPLC system(Palo Alto, CA, USA)을 이용하여 수행하였으며, 분석조건은 Table 1과 같다. 게다가, 총 14가지의 페놀성 계통 물질들의 표준품을 5가지의 농도로 희석시킨 후 HPLC 분석을 통하여 area 값을 획득하였고, 이를 이용하여 검정곡선을 작성하였다. 각각의 표준품의 검정곡선의 식은 Table 2와 같다. HPLC를 이용한 phenylpropanoid 계통 물질 분석 data를 이용하여 미국 품종, 일본HS4251, 대원, 대관, 대산, 그리고 양절 메밀 6종 품종을 대상으로 시각화 및 주성분 분석을 실시하였다.
주성분분석은 통계적인 파라미터(parameter)를 가지는 고유의 값을 의미하는 고유 값과 방향성(+, −)을 나타내는 고유벡터의 곱으로 나타낼 수 있다. 개별 고유 값의 제곱의 합은 1을 초과하지 못하며, 이 고유수치는 전체변량을 설명하는 비율을 나타낸다. Score plot에서 제시된 PC1은 principal component 변량의 분산을 가장 크게 할 때를 의미하며, PC2, PC3, component n 순으로 기여도는 작아진다. 분리도의 정도는 x와 y축의 component 변량(PC1&PC2, PC1&PC3 또는 PC2&PC3 등)의 선택으로 분산이 달라지므로 변화된 패턴을 분석한다.
HPLC를 통해 획득한 11개의 phenylpropanoid 계통 물질들 간의 상관분석을 수행하기 위해 MetaboAnalyst (https://www.metaboanalyst.ca)를 이용하였다. 일반적으로 상관분석 시 상관계수 (r)이 −1.0<r≤-0.7일 때 매우 강한 음의 상관관계, −0.7<r≤-0.3일 때 강한 음의 상관관계, 그리고 −0.3<r≤-0.1일 때 약한 음의 상관관계를 나타내고, −0.1<r<0.1일 때 상관관계 없음, 0.1<r≤0.3일 때 약한 양의 상관관계, 0.3<r≤0.7일 때 강한 양의 상관관계, 그리고 0.7<r≤1.0일 때 매우 강한 양의 상관관계를 나타낸다.
3. 결과 및 고찰
HPLC 분석 결과를 이용하여 y축 피크면적과 x축 표준폼 용액의 농도 수준에 따른 기울기를 기반으로 한 linear regression equation을 계산하였다. 이때 작성된 검량선을 이용한 각각의 지표 성분의 coefficient of determination (R2)값을 통하여 직선성을 확인한 결과, R2이 0.999로 1에 가까운 것을 확인 할 수 있었다(Table 2). 이는 기존 보고된 HPLC를 이용한 추출물 분석법에서 결과와 동일하게 R2>0.9999를 확인할 수 있었다(Yang 등, 2010). 따라서 HPLC 분석을 이용한 메밀 잎 추출물 내의 phenylpropanoid 함량 조사가 가능하였다.
메밀 잎을 이용한 메밀즙 생산에 적합한 품종을 선발하기 위하여 보통메밀(F. esculentum) 품종 6종(미국 품종, 일본폼종 HS4251, 대원, 대관, 대산, 그리고 양절)을 파종하여 재배 후 생식 생장기에 접어들기 전에 각 품종의 잎을 수확 및 동결건조하여 전처리 과정을 거친 후 80% methanol로 추출한 추출물을 회석 후 여과처리하여 HPLC를 이용해 phenylpropanoid 함량을 조사하였다.
메밀 잎의 품종별 phenylpropanoid 함량 비교를 위하여 분석한 결과, gallic acid, chlorogenic acid, caffeic acid, epicatechin, coumaric acid, ferulic acid, bezoic acid, rutin, cinnamic acid, quercetin, 그리고, kaempferol 등 총 11종의 phenylpropanoid를 분석할 수 있었다(Table 3). 그러나 catechin, 4-hydroxybenzoic acid, 그리고 sinapic acid는 검출되지 않았다.
메밀에 함유된 페놀 화합물 함량은 메밀 품종, 재배시기 그리고 지역에 따라 차이를 나타낸다(Hyun 등, 2018). 기존 연구 결과에 따르면, 메밀에 가장 많이 함유된 rutin 함량의 경우, 봄 재배보다 가을 재배에서 최대 3.8배 이상 높다고 보고했다(Hyun 등, 2018). 또한, 전남 지역에서 추출한 메밀의 chlorogenic acid, orientin, isoorientin, vitexin, isovitexin, rutin, 그리고 quercetin 등의 총플라보노이드 함량을 보면 0.43 mg/g으로 나타났다(Hyun 등, 2018). 이는 본 연구 결과에서 대원 종자는 약 15.42 mg/g으로 차이를 보였는데, 이는 메밀 종과 재배 지역 그리고 추출 재료의 차이에 따라 페놀 화합물 함량에 많은 차이가 있음을 보여준다.
Gallic acid는 3,4,5-trihydroxybenzoic acid을 알칼리 가수분해함으로써 생기는 carboxylic acid이다. 구조상으로는 3,4,5-trihydroxybenzoic acid에 해당하며, gallic acid라고도 한다. Gallic acid는 지방 분해 효소를 억제해 몸에서 분해된 지방이 흡수되는 것을 차단하고, 지방을 몸 밖으로 내보내 체지방 감소를 돕는 것으로 알려졌다(Huang 등, 2018; Silva 등, 2018). Gallic acid는 양절에 가장 많이 함유되어 있었으며, 그 다음으로 대원과 대관에도 많이 함유되어 있는 편이었으나, 미국 품종, 일본품종 HS4251, 그리고 대산 품종에는 상대적으로 적게 함유되어 있었다.
Chlorogenic acid는 caffeic acid와 quinic acid가 ester 결합으로 합쳐진 물질이다. 녹색 커피콩의 약 6-10% 정도가 chlorogenic acid이다. 스트레스에 대한 식물의 저항성을 높여주며, 초식곤충에 대한 방어작용을 한다(Kundu과 Vadassery, 2019). 또한, chlorogenic acid는 항산화(Hwang 등, 2018), 항암(Deka 등, 2017), 그리고 골다공증 억제(Min 등, 2018) 등 여러가지 생리활성에 관한 보고가 있다. Chlorogenic acid는 특이하게 대관 품종에 424.92 μg/g으로 다른 5품종에 약 2배 이상 함유되어 있었으며, 미국 품종, 일본폼정 HS4251, 대원, 대산, 그리고 양절에는 서로 비슷한 수준의 양이 함유되어 있었다.
Caffeic acid는 hydrocinnamic acid 그룹에 속한 물질로 탄소 6개-탄소 3개가 결합된 구조를 가지고 있다. Lignin 합성에 사용되는 핵심 물질이다. 커피 등에 다량 함유되어 있는 chlorogenic acid 합성에 사용되며 당과 결합하기도 한다. 커피콩을 포함한 배와 같은 과일과 바질, 타임, 버베나, 타라곤, 오레가노, 그리고 민들레와 같은 약용식물에 포함되어 있는 페놀성 화합물이다(Khan 등, 2016). 발암억제제로서 작용하고(Tyszka-Czochara 등, 2017), 생체 안과 밖에서 항산화제로서 알려져 있으며, 다른 항산화제보다 효과가 우수한 것으로 나타났다(Agunloye 등, 2019). 또한, 95% 이상 aflatoxin의 생산을 줄여줄 뿐만 아니라, 산화 스트레스를 유발하고 aflatoxin의 생산을 방해할 수 있다(Akçam 등, 2013). Caffeic acid는 대관 품종에 55.62 μg/g으로 가장 많이 함유되어 있었으며, 미국 품종, 일본폼종 HS4251에는 다른 한국 품종에 비하여 다소 적게 함유되어 있었다.
Epicatechin은 catechin의 입체이성체이다. Tannin의 구성성분으로서 식물체에 널리 존재한다. 화학 구조적으로 2개의 benzene환 A, B가 산소를 함유한 pyrone환 C의 양측에 배치한 형이다(Fraga 등, 2018). Flavanol(flavan-3-ol)의 유도체로 C환 2위치, 3위치의 탄소는 부제성이다. Epicatechin도 강한 항산화작용이 있어 항암, 항균, 그리고 항동맥경화작용 등 여러가지 생리활성을 가진다(Bernatova, 2018; Borges 등, 2018; Haskell-Ramsay 등, 2018). Epicatechin은 특이하게 대관 품종에 97.37 μg/g으로 다른 5품종에 약 2배 이상 함유되어 있었으며, 미국 품종, 일본폼종 HS4251, 대원, 대산, 그리고 양절에는 서로 비슷한 수준의 양이 함유되어 있었다.
Coumaric acid는 monohydroxycinnamic acid의 트란스형, 시스형의 p-coumaric acid는 불안정하고, 요오드 처리, 산과의 가열, 수은염 처리로 안정된 p-coumaric acid가 되고, 트란스형은 자외선 조사에 의해 p-coumaric acid로 변한다(Ferreira 등, 2019). 항산화와 항암 등의 생리활성이 보고되었다(Pei 등, 2016). Coumaric acid는 미국 품종에 18.56 μg/g으로 가장 많이 함유되어 있었으며, 일본품종 HS4251과 한국 품종에는 다소 적게 함유되어 있었다.
Ferulic acid는 식물의 세포벽을 형성하는 lignin의 전구체로서 ferulic acid에는 슈퍼옥사이드 이온, 산화질소, 하이드록시 라디칼과 같은 활성산소를 중화하는 항산화 작용이 있으며, 그 효과는 활성산소의 독성으로부터 생체를 방어하는 SOD(super oxide dismutase)와 같은 것으로 알려져 있다(Zduńska 등, 2018). 특히 세포에 있어서 지질의 산화에 대한 억제작용이 매우 우수하다. Ferulic acid는 항산화력이 매우 강해 멜라닌 색소를 제거하고, 기미, 주근깨의 생성을 억제하는 효과가 매우 우수하기 때문에 미용 효과가 좋으며, 혈당 강하 및 콜레스테롤 저하 효과도 있다 (Li 등, 2017; Nankar 등, 2017). Ferulic acid는 대관 품종에 13.11 μg/g으로 가장 높은 함량을 보였으며 다른 5품종에는 대관에 비하여 다소 낮은 함량을 나타냈다.
Benzoic acid는 가장 간단한 방향족 carboxylic acid의 하나로 무색의 결정성 고체이다. 방부제의 일종으로 간장에 쓰이며, 매염제로도 사용한다. 식품위생법에 의하여 허가된 방부제의 일종으로 간장에 쓰이는 외에, 매염제로도 사용하고 있다. 나트륨염은 방부제/거담제로 쓰이는 외에, 해열제로서 급성관절류머티즘, 방과염, 그리고 만성기관지염의 치료에 쓰인다. Caffeine sodium benzoate의 조제에도 사용된다. 또한, 벤조산에스터는 향료의 보류제난 용제로 사용한다(del Olmo 등, 2017; Johnson 등, 2017). Benzoic acid는 미국 품종에 77.49 μg/g으로 가장 높은 함량을 보였으며, 다른 5품종에는 미국 품종에 비하여 다소 낮은 함량을 나타냈다.
Rutin은 flavonoid glycoside 중 가장 흔하게 분포하는 것 중 하나로서, 메밀에는 rutin 성분이 많이 들어 있다. Rutin은 flavonoid 배당체로 식물의 갈색 색소 성분이다. 혈관을 튼튼하게 해 고혈압 환자에게 특히 좋다(Al-Dhabi 등, 2015; Ganeshpurkar과 Saluja, 2017). 예로부터 머리에 열이 몰린 경우 메밀베개를 베고 자면 머리가 맑아지고 어지러움을 예방할 수 있다고 믿어 베갯속에 메밀을 넣었다. 또한, 메밀은 위와 장을 튼튼하게 한다. 음식을 먹고 나서 속이 울렁거릴 때 속을 개운하게 한다. 설사, 딸국질, 그리고 장이 자주 뭉칠 때 효과가 있다(Chua, 2013; Hosseinzadeh과 Nassiri-Asl, 2014). Rutin은 대관 품종에 12,535.85 μg/g으로 가장 높게 함유되어 있었으며, 미국 품종, 일본품종 HS4251, 대원, 대산, 그리고 양절에는 서로 비슷한 수준의 양이 함유되어 있었다.
Cinnamic acid는 유기 화합물이다. 약간의 수용성인 백색의 결정성 화합물이다. 불포화 carboxylic acid로 분류되고, 많은 식물에 존재한다. 1780년에 Trommsdorf가 계피유에서 처음으로 단일 분리하였고, 1834년에는 그 성상도 명확하게 밝혀졌다. 천연품은 주로 트렌스형 구조를 가지고 있다. 최근 연구에 의하면 항균, 항산화, 항염, 그리고 항암 등의 생리활성이 있으며, 식품 첨가제뿐만 아니라 화장품의 원료 등으로 이용되고 있다(Adisakwattana, 2017; De 등, 2011; Gunia-Krzyżak 등, 2018; Sova, 2012). Cinnamic acid는 특이하게 미국 품종에 6.55 μg/g으로 다른 5품종에 약 3-8배 이상 함유되어 있었다.
Quercetin은 flavonol의 일종으로 식물에 널리 분포한다. 다른 많은 페놀계 복소환 화합물과 마찬가지로 항산화제이다. Quercetin은 양파, 사과, 녹차, 딸기, 케일, 그리고 견과류 등에 많이 함유되어 있으며, 항산화, 혈당 강하, 항암, 혈압 강하 작용과 모세 혈관을 튼튼하게 하는 작용이 있다(Babaei 등, 2018; Kim과 Park, 2018; Salehi 등, 2020). Quercetin은 특이하게 대관 품종에 2,199.77 μg/g으로 다른 5품종에 약 3-7배 이상 함유되어 있었다.
Kaempferol은 전형적인 C6-C3-C6의 구조를 가진 중요한 flavonoid 중의 하나이다. 지방과 DNA의 산화 위험을 막고 강한 항산화작용을 하며, 암세포 형성을 억제하는 화학적 예방 작용제로서 활동한다. 사과, 양파, 부추, 감귤류, 포도, 레드와인, 그리고 고추나물에 포함되어 있다. Kaempferol은 대관 품종에 17.03 μg/g으로 가장 높은 함량을 보였으며, 미국과 양절 품종에서는 대관과 비슷한 수준의 함량을 보였다. 반면, 다른 품종에서는 다소 낮은 함량을 보였다.
각 메밀 품종의 잎을 수확 및 동결건조하여 전처리 과정을 거친 후 80% MeOH로 추출한 추출물을 회석 후 여과처리하여 HPLC를 이용해 분석한 총 phenylpropanoid함량의 경우 대관 메밀이 가장 높은 것으로 나타났으며, 미국 품종, 대산, 양적, 대원, 일본HS4251 메밀 잎 순으로 높은 것으로 나타났다. 특히, 대관 메밀의 잎에서는 chlorogenic acid(424.92±9.69 μg/g), caffeic acid(55.63±2.82 μg/g), ferulic acid(13.11±1.09 μg/g), rutin(12,535.85±431.43 μg/g), epicatechin(97.37±8.06 μg/g), quercetin(2,199.73 ±60.53 μg/g), kaempferol(17.03±2.33 μg/g)의 함량이 다른 품종의 잎에 비하여 통계적으로 유의하게 높은 것으로 나타났다. 반면에, 미국 메밀 잎에서 p-coumaric acid (18.56±1.94 μg/g), benzoic acid(77.49±3.24 μg/g), trans-cinnamic acid(6.55±0.06 μg/g)의 함량이 가장 높은 것으로 나타났다.
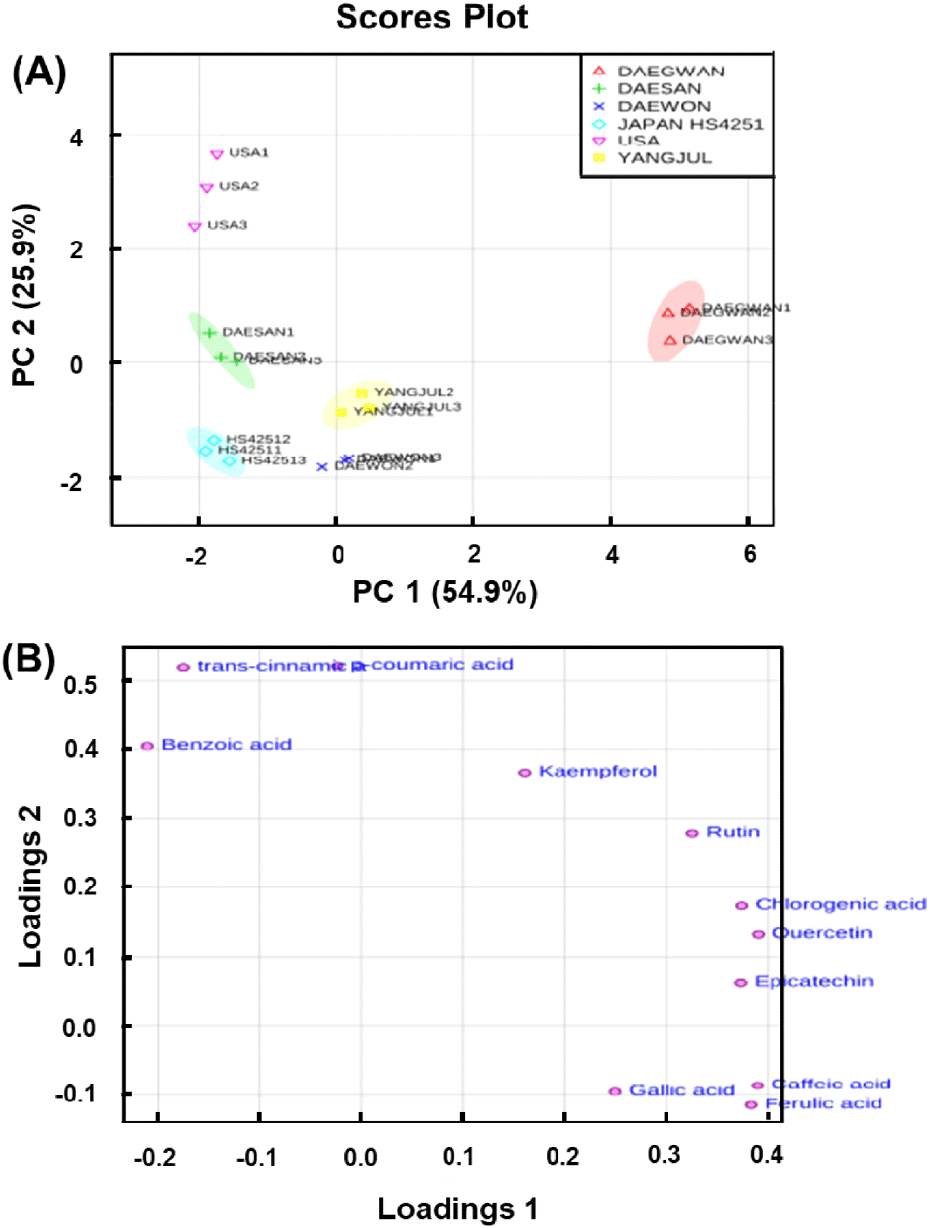
미국, 일본HS4251, 대원, 대관, 양절, 그리고 대산 메밀 품종의 메밀 잎에서 HPLC를 통하여 확인되고, 정량된 11개의 phenylpropanoid 계통 물질 데이터를 이용하여 주성분분석을 실시하였고, 주성분 분석결과는 PC1과 PC2를 이용하여 나타냈다(Fig. 1). Score plot에서 각각의 품종들이 서로 분리된 그룹을 형성하였으며, 그 중 phenylpropanoid 계통 물질의 함량이 가장 높은 대관 메밀의 경우 다른 분리된 그룹들과 더욱 분리되어 그룹을 형성하는 것을 확인할 수 있었으며, 이는 loading plot에 따르면 rutin, chlrogenic acid, quercetin, 그리고 epicatechin의 높은 함량에 의한 것임을 확인할 수 있으며, Table 3의 결과와 동일한 것으로 나타났다. 두 번째로 함량이 높았던 미국 메밀 잎 역시 다른 그룹들과 다소 분리되어 그룹을 형성하는 것을 확인 할 수 있었다.
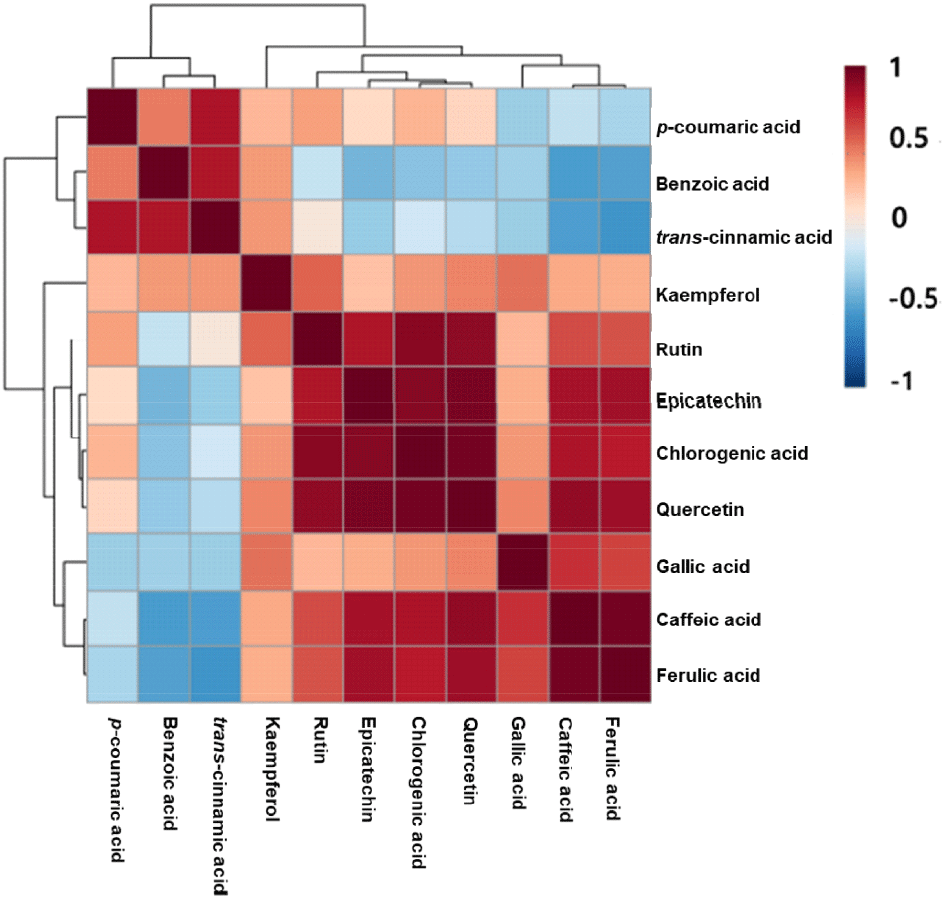
Fig. 2에 따르면, 3개의 phenolic acid(trans-cinnamic acid, p-coumaric acid, 그리고 benzoic acid)와 kaempferol의 상관관계에 의하여 하나의 작은 그룹이 형성되며, 4개의 phenolic acid(ferulic acid, caffeic acid, gallic acid, 그리고 chlorogenic acid) 및 4개의 flavonoid 계통 물질(kaempferol, rutin, quercetin, 그리고 epicatechin)의 상관관계에 의하여 큰 그룹이 형성됨을 확인할 수 있었다. 구체적으로, trans-cinnamic acid는 p-coumaric acid (r=0.8093; p⟨0.0001), benzoic acid(r=0.8003; p< 0.0001)와 매우 강한 양의 상관관계를 나타내었다. 이는 trans-cinnamic acid가 p-coumaric acid는 benzoic acid의 합성의 직접적인 전구체이기 때문으로 사료된다. 게다가, caffeic acid와 ferulic acid(r=0.9626; p⟨0.0001) 역시 매우 강한 양의 상관관계를 보였는데, 이는 caffeic acid가 ferulic acid의 합성의 직접적인 전구체로 이용되기 때문으로 생각된다. 유사하게 flavonoid 계통 물질들 또한 양의 상관관계를 나타내는 것을 확인할 수 있었으며, rutin 및 quercetin의 전구물질로 작용하는 kaempferol은 각각의 물질과 약한 양의 상관관계를 나타내고 있었다.
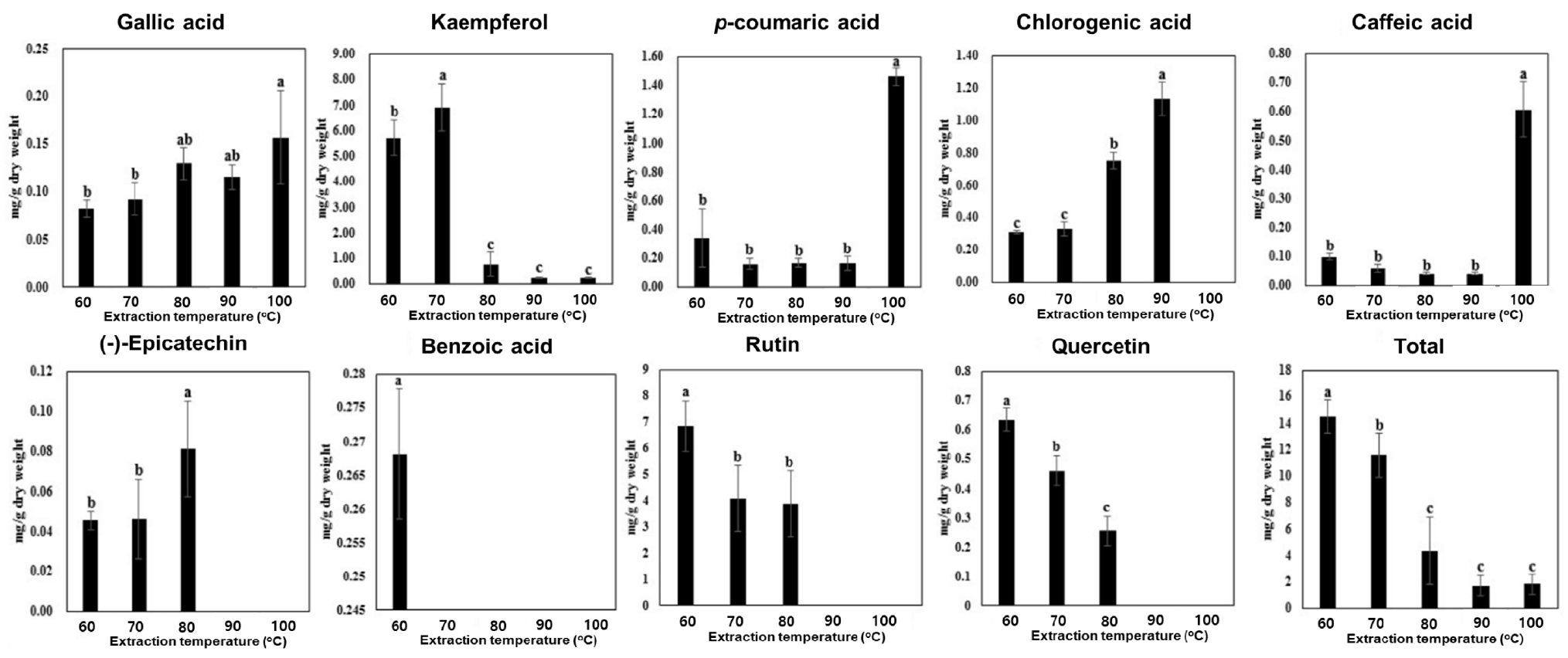
식품가공에 사용하기 위한 목적으로 수확한 대관 품종 메밀 잎을 깨끗하게 세척 후 60, 70, 80, 90, 100°C에서 3시간 동안 메밀 잎을 열수 추출하였다. 물을 용매로 사용하는 열수추출 방법은 시료가 받는 온도의 변화에 따라 실온의 물과 다르게 용질에 반응하여 유전상수는 감소하고 이온강도를 증가한 상태가 되어 용질 내의 구성성분 추출 효율에 영향을 미친다(Kwon and Youn, 2015). 따라서 추출시 온도를 달리하여 phenylpropanoid 함량이 최대로 함유된 최적조건을 조사하였다(Fig. 3). 각각의 온도별로 열수추출 후 동결건조한 시료 내의 최고 phenylpropanoid 함량을 살펴본 결과, gallic acid는 100°C, kaempferol는 70°C, p-coumaric acid는 100°C, chlorogenic acid는 90°C, caffeic acid는 100°C, epicatechin은 80°C, benzoic acid는 60°C, quercetin은 60°C 온도처리에서 각각 최고 수율을 보였다. 잎에 가장 많이 함유되어 있는 rutin 함량은 60°C에서 최고로 추출되어 이 영향으로 총 phenylpropanoid 함량도 60°C 열수추출에서 가장 높은 수준의 총 phenylpropanoid 함량을 보였다. 기존 보고된 용매 첨가 메밀 추출 결과에 따르면 약 66% 에탄올을 용매로 사용하여 60°C에 추출하였을 때 rutin 함량이 최적임을 확인한 결과와 유사함을 나타냈다(Shin 등, 2020). 그러나 ferulic acid와 trans-cinnamic acid는 검출되지 않았다. 따라서 메밀 잎을 이용한 메밀즙 생산은 60°C 열수추출한 즙으로 생산하는 것이 식품가공에 사용하기 위한 열수추출 온도로 적합할 것으로 판단된다.