Article
아이스플랜트 추출물의 3T3-L1 지방세포 내 TNF-α 유도 염증 및 인슐린 저항성 개선 효과
Mesembryanthemum crystallinum extract ameliorates TNF-α-induced inflammation and insulin resistance in 3T3-L1 adipocytes
Se-Eun Park
1
, Hyo-Jeong Lee
1
, In-Seon Jeong
2
, Seung Kim
1,*
1Department of Health Functional Food, Gwangju University, Gwangju 61743, Korea
2Hyundai F&B Co., Ltd., Gwangju 61200, Korea
Citation: Park SE, Lee HJ, Jeong IS, Kim S. Mesembryanthemum crystallinum extract ameliorates TNF-α-induced inflammation and insulin resistance in 3T3-L1 adipocytes. Korean J Food Preserv, 29(6), 1000-1011 (2022)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Aug 29, 2022; Revised: Sep 19, 2022; Accepted: Sep 19, 2022
Published Online: Oct 31, 2022
4. 요약
본 연구에서는 아이스플랜트 추출물이 TNF-α에 의해 유도된 염증 및 인슐린 저항성 개선 효능을 나타내는지 확인하였다. 추출물에 의한 세포독성을 확인한 결과, 1,500 μg/mL 이하에서는 세포 생존율이 감소하지 않았으며, oil red O 염색을 통해 TNF-α에 의한 지방구 감소를 억제하였으며 이를 통해 지방분해를 억제하는 효능이 있음을 확인하였다. 염증과 관련된 adipokine의 생성에 미치는 영향을 확인한 결과, 염증을 유도하는 MCP-1과 IL-6의 생성은 억제하고, 반대로 항염증 작용을 하는 adiponectin의 생성을 증가시켰으며 염증에서 중요한 전사인자로 작용하는 NF-κB의 translocation을 억제하였다. 또한, 지방세포 내 인슐린 신호전달에 관여하는 IRS-1, GLUT4의 발현을 조절하여 TNF-α에 의해 감소된 glucose 유입을 증가시킴을 확인하였다. 이러한 결과를 통해 아이스플랜트 추출물이 지방세포 내에 존재하는 NF-κB 경로를 차단하여 inflammatory cytokine뿐만 아니라 adiponectin의 생성을 조절하여 염증을 억제하고, 인슐린 신호전달에 관여하는 IRS와 GLUT4의 발현을 조절하여 glucose uptake를 증가시켜 염증에 의한 인슐린 저항성 개선 효과를 나타냄을 확인하였다. 이와 같은 아이스플랜트 추출물의 활성은 비만에 의해 유발되는 대사증후군의 개선을 위한 기능성 식품 소재로 활용 가능성을 보여주는 것으로 판단된다.
Abstract
Obesity is classified as a low-grade chronic inflammatory disease. Obesity-induced inflammation is associated with the development of insulin resistance (IR). In this study, we investigated the effects of Mesembryanthemum crystallinum extract (MCE) on tumor necrosis factor-alpha (TNF-α)-induced inflammation and IR in 3T3-L1 adipocytes, as well as underlying mechanisms. Lipolysis was monitored by oil red O staining. Glucose uptake was measured by 2-deoxyglucose (2-DG). The production of cytokines and adiponectin was evaluated using enzyme-linked immunosorbent assay (ELISA). Protein expression was measured using western blotting. IR was induced in differentiated 3T3-L1 adipocytes by treatment with TNF-α. MCE treatment decreased lipolysis while increasing adiponectin production. MCE inhibited the production of pro-inflammatory cytokines such as interleukn (IL)-6 and monocyte chemoattractant protein (MCP)-1, as well as the Nuclear factor-κB (NF-κB) translocation. Additionally, MCE increased glucose uptake, prevented the protein expression of phosphorylated insulin receptor supstrate (IRS) and increased the protein expression of Glucose Transporter Type 4 (GLUT4) in a dose-dependent manner. These results demonstrate the potential of MCE in improving chronic inflammation and insulin sensitivity in obesity. Therefore, MCE can be used as a novel candidate for developing functional foods.
Keywords: Mesembryanthemum crystallinum; adipocyte; TNF-α; inflammation; insulin resistance
1. 서론
비만은 제2형 당뇨, 고혈압, 심혈관계질환, 암, 그 외 각종 질환의 주된 원인으로 여겨 여러 연구에 따르면 비만은 만성적으로 낮은 수준의 염증을 동반하며, 이러한 염증은 지방조직 내 당 대사 및 지방 대사의 이상을 일으키며 인슐린 저항성을 유발하여 제2형 당뇨, 동맥경화, 고혈압 같은 다양한 대사증후군의 발생을 증가시키는 것으로 보고되고 있다(Fantuzzi, 2005; Moller, 2000). 지방조직은 에너지를 저장하는 기능과 함께 adiponectin, leptin뿐만 아니라 tumor necrosis factor-α(TNF-α), interleukin-6 (IL-6), monocyte chemoattractant protein-1(MCP-1)과 같은 inflammatory cytokine을 포함한 다양한 adipokine을 생성하고 분비하는 기능을 수행하며, 비만에 의한 염증과 대사증후군 발생에 중요한 기능을 수행한다(Takeuchi와 Akira, 2010). 지방조직 내 inflammatory cytokine의 증가는 adiponectin의 농도를 감소시키며 지방조직 내 염증을 지속시킬 뿐만 아니라 인슐린 신호전달 경로를 방해하는 원인으로 작용한다(Aldhahi 등, 2003; Fontana 등, 2007)
TNF-α는 비만과 염증, 인슐린 저항성에서 중요한 역할을 담당하는 inflammatory cytokine으로, 지방세포 내 염증 신호전달 경로를 활성화하여 IL-6, MCP-1과 같은 염증 유발 인자들의 생성을 촉진한다(Suganami 등, 2005). 생성된 염증 유발 인자들은 상호작용하며 지방조직의 염증을 증가시키는 악순환을 초래하고 인슐린 신호전달을 방해하여 최종적으로 인슐린 저항성을 일으킨다(Suganami 등, 2007). 비만 상태인 사람과 동물에서 지방조직 및 혈중 TNF-α 농도가 증가되었으며, 체중 감량과 soluble TNF-α receptor immunoglobulin에 의해 TNF-α 농도가 감소하고 인슐린 저항성이 개선되었음을 보고하였다(Hotamisligil 등, 1993: Hotamisligil 등, 1994; Kern 등, 1995). 이러한 결과들은 비만으로 인해 증가한 TNF-α와 인슐린 저항성 사이의 연관성을 보여주고 있다. 대사증후군과 같은 다양한 질병을 예방하거나 치료하는 효과적인 방법으로 여겨지고 있으며, 여러 연구를 통해서 식물 유래 기능성 소재의 TNF-α에 의한 염증 반응 억제 및 인슐린 저항성 개선 효과에 관한 연구 결과들이 보고되어 있다(Cha, 2013; Cheng 등, 2019; Kang과 Song, 2016; Luna-Vital 등, 2017; Yang 등, 2021; Yin 등, 2022).
아이스플랜트(Mesembryanthemum crystallinum)는 번행초과(Aizoaceae) 솔잎채송화속의 1년생 초목으로, 초장이 10-50 cm 정도로 자라는 포복성 식물로 남아프리카의 나미브 사막이 원산지이다(Nam 등, 2017). 염분과 자외선에 의한 피해를 억제하는 데 유용한 물질을 생산하는 내염 식물로, 줄기와 잎에는 배출된 염분이 얼음 결정처럼 보이는 bladder cell을 가지고 있으며, 이로 인해 아이스플랜트라고 불린다(Agarie 등, 2009; Drira 등, 2016). 일본에서는 다양한 질병 예방을 위한 기능성 식물로 알려져 있으며, myo-inositol, pinitol뿐만 아니라 β-cyanins, proline, pantothenic acid, β-carotene, 그 외에 다양한 flavonoid들을 함유하고 있으며, 항산화, 항균, 항염, 항암, 항당뇨, 간보호, 체지방 감소, 기억력 개선 등의 활성 등이 보고된 바 있다(Hanene 등, 2009; Kang 등, 2017; Lee 등, 2014; Lee 등, 2015; Nam 등, 2017; Seo와 Ju, 2019). 아이스플랜트의 다양한 생리활성 및 기능성 성분 분석에 관한 연구 결과들이 보고되며 국내에서도 재배하는 농가가 늘어나고 있지만, 국내에서 아이스플랜트는 재배와 관련된 연구 외에 생리활성에 관한 다양한 연구는 아직 미비한 실정이다. 아이스플랜트의 지방축적 억제 및 지방분해 효과에 관한 연구는 보고되어 있지만, 지방조직 내 염증 및 인슐린 저항성 개선과 관련된 연구는 아직 보고된 바 없다(Drira 등, 2016; Kang 등, 2017). 본 연구에서는 아이스플랜트 추출물의 3T3-L1 지방세포 내 염증과 인슐린 저항성 개선 효과를 측정하고, 이를 통해 아이스플랜트의 대사증후군 개선 기능성 식품 소재로의 가능성을 검토하고자 하였다.
2. 재료 및 방법
2.1. 추출물 제조
실험에 사용한 동결건조된 아이스플랜트는 ㈜현대에프엔비로부터 제공받아 사용하였다. 동결건조된 아이스플랜트 50 g에 70% 에탄올 100 mL를 첨가하여 상온에서 1주일 동안 추출하였다. 추출액은 여과지(Advantec, Tokyo, Japan)로 여과한 후 여과액을 회전 감압 농축기(N-1300, EYELA, Tokyo Rikakikai, Tokyo, Japan)를 이용하여 50°C에서 농축하였다. 농축액을 동결건조한 후, −20°C에 보관하며 실험에 사용하였다. 아이스플랜트 추출물은 0.76 g을 얻어 1.52%의 수율을 나타냈다.
2.2. 3T3-L1 세포 분화 및 TNF-α와 추출물 처리
실험에 사용한 3T3-L1 세포는 American Type Culture Collection(Manassas, VA, USA)에서 분양받아 사용하였다. Dulbecco’s modified Eagle’s medium(DMEM) (Invitrogen, Waltham, MA, USA) 배지에 10% bovine serum(BS)(Invitrogen, Waltham, MA, USA), 1% antibiotic-antimycotic solution(Invitrogen, Waltham, MA, USA)을 첨가하여 5% CO2, 37°C 배양기에서 세포를 배양하였다. 세포 분화를 위해서 3T3-L1 세포를 seeding한 후 100% confluent까지 배양한 후 10% fetal bovine serum(FBS)(Welgene, Gyeongsan, Korea)이 포함된 DMEM 배지로 교체하였다. 2일 후 10% FBS가 포함된 DMEM 배지에 2 mM dexamethsone, 0.5 mM 3-isobutyl-methylxanthine, 1 μg/mL insulin을 첨가하여 교체한 후 분화를 유도하였다. 2일 후 1 μg/mL insulin을 포함하는 10% FBS가 포함된 DMEM 배지로 교체하여 2일 동안 배양하였다. 10% FBS가 포함된 DMEM 배지로 교체하여 추가로 2일 동안 더 배양하였다. 완전히 분화된 3T3-L1 세포에 아이스플랜트 추출물을 농도별로 6시간 동안 처리한 후 10 ng/mL TNF-α 24시간 동안 처리하고 분석하였다.
2.3. MTT assay
3T3-L1 세포(1×104 cell/well)를 96 well plate의 각 well에 분주한 후 추출물을 처리하여 24시간 배양하였다. 배양 후 배지를 제거하고 5 mg/mL 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 용액을 배지로 희석하고 0.5 μg/mL MTT 용액을 100 μL씩 각 well에 처리하고 4시간 동안 배양하였다. MTT 용액을 완전히 제거하고 각 well에 형성된 formazan을 녹이기 위해 100 μL dimethyl sulfoxide를 첨가하고 실온에서 10분간 반응시켰다. Microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하고, 무처리군의 평균 흡광도값을 구한 후 추출물 처리군의 평균 흡광도값에 대한 백분율로 계산하여 세포 생존율로 나타내었다.
2.4. Oil red O 염색
3T3-L1 세포(5×104 cell/well)를 24 well plate의 각 well에 분주하고 완전히 분화된 세포에 6시간 동안 추출물을 처리하고 10 ng/mL TNF-α를 24시간 처리한 후 세포를 phosphate buffered saline(PBS)으로 2회 세척하였다. 3% Formaldehyde 용액으로 상온에서 세포를 30분 동안 고정한 후 증류수로 3회 세척하였다. 60% Isopropyl alcohol을 5분간 처리하고 건조한 후, 0.5% oil red O 시약을 처리하고 상온에서 30분간 염색하였다. 증류수로 3회 세척 후 100% isopropyl alcohol을 처리하고 10분 동안 교반하여 oil red O를 용출시켰다. 용출된 oil red O는 520 nm에서 microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 흡광도를 측정하고 지방구 축적 정도를 분석하였다.
2.5. Glucose uptake
3T3-L1 세포(1×104 cell/well)를 96 well plate의 각 well에 분주하고 분화 유도가 끝난 후 KRPH buffer(121 mM NaCl, 4.9 mM KCl, 1.2 mM MgSO4, 0.33 mM CaCl2 and 12 mM HEPES, pH 7.4)로 4시간 배양하였다. 추출물을 6시간 동안 처리한 뒤 10 ng/mL TNF-α를 15분 동안 처리하고 10 nM insulin을 30분 동안 처리하였다. 배지를 제거하고 900 μL KRPH와 10 μg/mL insulin을 1시간 처리한 뒤, 10 mM 2-deoxyglucose(2-DG)를 처리하여 30분간 배양하였으며, glucose uptake assay kit(Abcam, Cambridge, UK)를 이용하여 측정하였다.
2.6. ELISA
3T3-L1 세포(1×104 cell/well)를 96 well plate의 각 well에 분주하고 완전히 분화된 세포에 추출물을 6시간 동안 추출물을 처리한 후 10 ng/mL TNF-α를 24시간 처리하였다. 처리 후 얻은 배지 내에 함유된 adiponectin과 inflammatory cytokine은 enzyme-linked immunosorbent assay kits(Enzo Life Sciences, Farmingdale, NY, USA)를 이용하여 측정하였다.
2.7. 핵단백질 분리
완전히 분화된 3T3-L1 세포(1×105 cells/mL)에 추출물을 6시간 동안 처리하고 10 ng/mL TNF-α를 30분간 처리하였다. PBS로 2회 세척 한 후, hypotonic buffer(10 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid pH 7.9, 10 mM KCl, 1.5 mM MgCl2, 0.2 mM phenylmethylsulfonyl fluoride, 0.5 mM dithiothreitol, 10 μg/mL aprotinin)를 넣고, 20 μL의 5% nonidet NP-40을 첨가하여 4°C에서 5분 동안 반응시켰다. 10,000 ×g에서 5분간 원심분리하여 세포질 내 단백질이 포함된 상층액을 회수하였다. 원심분리하여 얻은 pellet에 hypertonic buffer (20 mM 4-(2-hydroxyethyl)-1-piperazin eethanesulfonic acid, 25% glycerol, 420 mM NaCl, 1.5 mM MgCl2, 0.2 mM ethylenediaminetetraacetic acid, 0.02% NaN3, 0.5 mM dithiothreitol, 1 mM PMSF, pH 7.4)를 넣고 4°C에서 1시간 동안 반응시킨 후 16,000 ×g에서 10분간 원심분리하고, 핵단백질이 포함된 상층액을 회수하여 실험에 이용하였다.
2.8. Western blot assay
처리가 끝난 후 PBS로 세포를 세척한 뒤, lysis buffer (RIPA buffer, 50 mM Tris-HCl, pH 8.0, 150 mM NaCl, 1% NP-40, 0.5% nadeoxycholate, 0.1% SDS)를 20분간 4°C에서 처리하여 단백질을 추출하였다. BCA protein assay kit(Thermofisher, Waltham, MA, USA)를 이용하여 단백질을 정량하여 동량의 단백질을 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)에서 전기영동하였다. 전기영동 후 polyvinylidene fluoride(PVDF) membrane(Roche Diagnostics GmbH, Mannheim, Germany)에 단백질을 transfer하고 blocking Buffer(Bio-Rad, Hercules, CA, USA)를 이용하여 상온에서 10분 동안 blocking하였다. 1차 antibody를 1: 1,000-1:4,000으로 희석하여 4°C에서 12시간 동안 부착시킨 후 membrane을 TBS-T(Tris-buffered saline with Tween-20) buffer로 15분씩 3회 세척 하였다. 2차 antibody를 1:1,000-1:2,500으로 희석하여 상온에서 2시간 동안 부착시키고 TBS-T buffer로 membrane을 15분씩 3회 세척하였다. Enhanced chemiluminescent substrate (Thermofisher, Waltham, MA, USA)를 처리하고 membrane에 생성된 protein band를 image reader(Microchemi 4.2, DNR, Neve Yamin, ISR)로 확인하여 단백질 발현 정도를 분석하였다.
2.9. 통계처리
모든 실험은 3회 이상 반복하여 실시하였으며, 실험결과는 평균±표준편차로 나타내었다. 각 실험군의 통계학적 분석은 SPSS program version 27(IBM, Armonk, NY, USA)를 가지고 일원배치 분산분석(one-way analysis of variance)을 실시하였다. 유의성 평가를 Duncan’s multiple range test를 실시하여 p⟨0.05 수준에서 유의성을 검증하였다.
3. 결과 및 고찰
3.1. 세포 생존율 및 지방구 분해에 미치는 영향
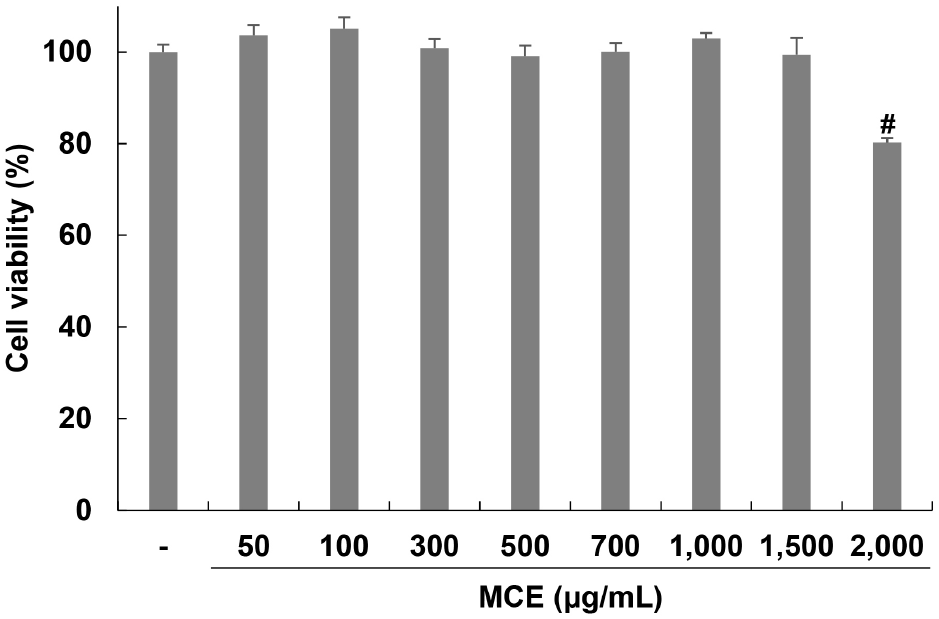
아이스플랜트 추출물의 처리농도를 결정하기 위해 3T3-L1 세포에 아이스플랜트 추출물을 0, 50, 100, 300, 500, 700, 1,000, 1,500, 2,000 μg/mL의 농도로 24시간 동안 처리한 후 MTT assay를 이용하여 세포 생존율을 평가하였다. 추출물을 농도별로 처리한 결과, 세포 생존율은 100, 103.65, 105.07, 100.78, 99.06, 100.07, 102.92, 99.40, 80.20%로 확인되었으며, 1,500 μg/mL 이하의 농도에서는 세포 생존율이 감소하지 않음을 확인하였지만 2,000 μg/mL에서는 80.20%로 세포 생존율이 감소하였다(Fig. 1). 세포 생존율에 영향을 미치지 않는 1,500 μg/mL 이하의 농도에서 다음 실험을 진행하였다.
Fig. 1.
Effects of Mesembryanthemum crystallinum extract (MCE) on cell viability in 3T3-L1 cells.
The cell viability was determined by MTT assay. The value was calculated as a percentage of cell viability of the non-treated cells. Values are expressed as the mean±SD of at least three independent experiments #p⟨0.05 relative to control cells.
Download Original Figure
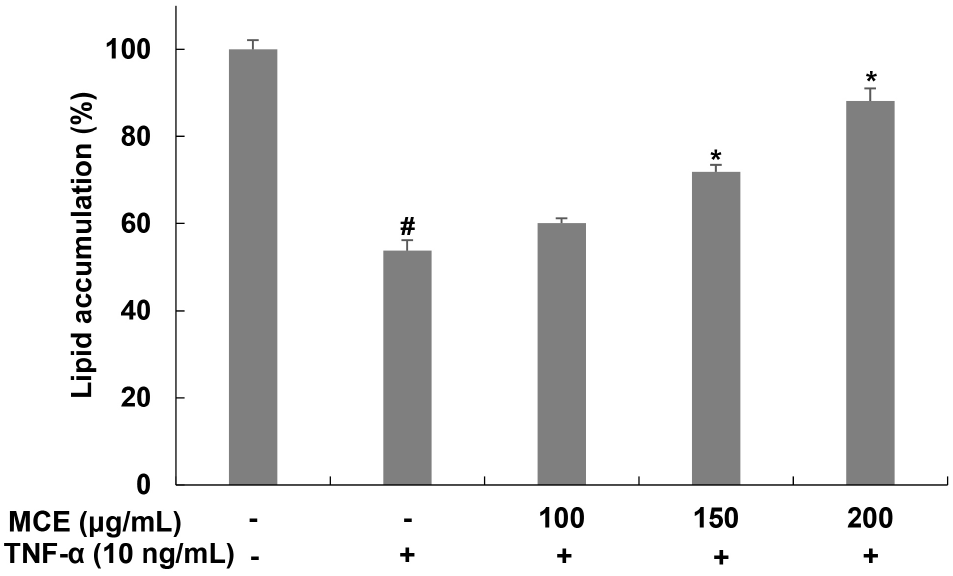
비만에 의한 지방조직 내 만성적인 염증은 다양한 inflammatory cytokine의 생성을 증가시킨다. 그중 TNF-α는 lipolysis 효과를 나타내며 혈중 유리 지방산의 농도 증가와 glucose uptake 기전 손상을 통해 인슐린 저항성을 직접적으로 매개한다(Guilherme 등, 2008; Jack 등, 2022; Ruan과 Lodish, 2003; Yang 등, 2021). TNF-α에 의한 지방세포 내 lipid droplet 감소가 아이스플랜트 추출물에 의해 억제되는지를 확인하기 위해, 분화된 3T3L-1 세포에 아이스플랜트 추출물을 6시간 동안 전처리 후 TNF-α를 24시간 처리하고 oil red O 염색을 이용하여 지방세포 내 지방구를 확인하였다(Fig. 2). 그 결과, 무처리군에 비해 TNF-α 단독 처리한 군에서는 지방구가 53.81%로 감소하였지만, 아이스플랜트 추출물을 처리한 군에서는 60.06, 71.93, 88.16%로 지방세포 내 지방구가 증가함을 확인하였다. 이는 아이스플랜트 추출물이 TNF-α로 염증이 유도된 지방세포 내 지방분해를 억제하는 효능이 있음을 나타내는 것으로 판단된다. Kang과 Song(2016)은 TNF-α에 의해 분화된 3T3-L1 세포 내 지방구 감소가 나타나고, Amomum cadamomum Linne 추출물 처리에 의해 TNF-α에 의한 3T3-L1 세포 내 지방구 감소가 억제됨을 보고하였으며, 이는 본 연구 결과와 유사한 경향을 나타냈다.
Fig. 2.
Effects of Mesembryanthemum crystallinum extract (MCE) on lipolysis in TNF-α-treated 3T3-L1 cells.
The lipid accumulation was measured by oil red O staining assay. Values are expressed as the mean±SD of at least three independent experiments. #p⟨0.05 relative to control cells; *p⟨0.05 relative to TNF-α-treated cells.
Download Original Figure
3.2. Inflammatory cytokine 및 adiponectin 생성에 미치는 영향
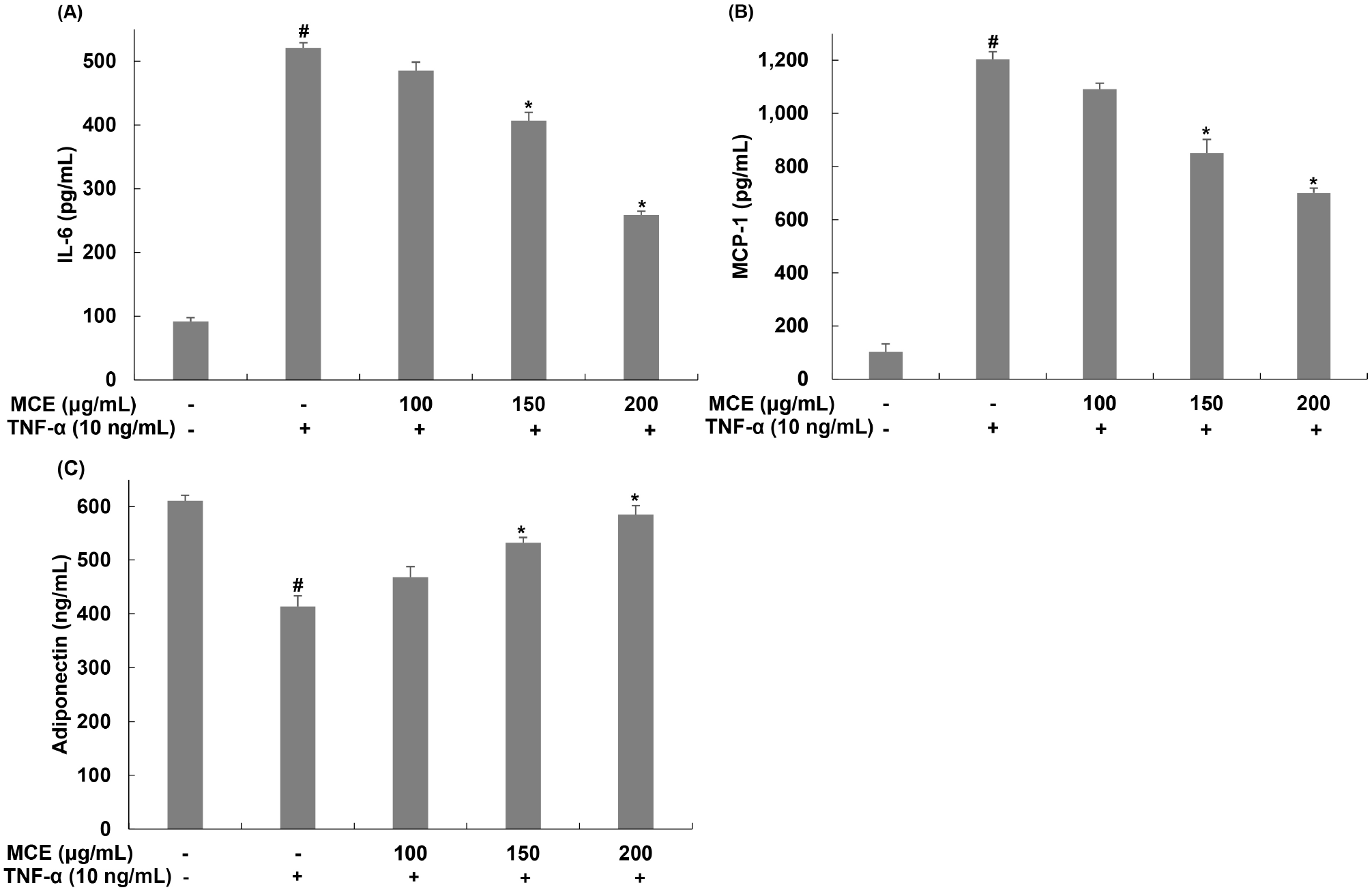
비만에 의해 지방세포가 비대해지고 지방조직 내에 만성적인 염증이 나타나며 TNF-α, IL-6, MCP-1과 같은 inflammatory cytokine들의 생성 또한 증가한다(Cheng 등, 2019; Guilherme, 2008; Hotamisligil, 2006). 이러한 cytokine들은 지방조직 내 만성적인 염증 상태를 지속시키며 인슐린 신호전달 기전을 방해하여 인슐린 저항성을 유발한다(Guilherme, 2008; Tilg과 Moschen, 2006). 그중, IL-6는 지방세포에서 분비되며 IRS-1, GLUT4와 같은 유전자의 발현을 감소시키며 인슐린 저항성을 일으킨다(Rotter, 2003). MCP-1은 지방세포뿐만 아니라 대식세포에서도 분비되며 지방조직 내로 대식세포의 침윤을 유도하여 염증 상태를 유지하고 LPL, GLUT4, PPARγ와 같은 유전자의 발현을 억제하며 인슐린 저항성을 유발한다(Anusree 등, 2018; Sartipy과 Loskutoff, 2003). TNF-α에 의해 유도된 염증에 대한 아이스플랜트 추출물의 억제 효과를 확인하기 위해 아이스플랜트 추출물을 6시간 동안 전처리하고 TNF-α를 24시간 처리한 후, inflammatory cytokine인 IL-6와 MCP-1의 생성량을 확인하였다. 그 결과, IL-6는 무처리군에서는 91.66 ng/mL, TNF-α 단독 처리한 군의 경우, 521.03 ng/mL로 TNF-α에 의해 IL-6 생성이 증가하였지만, 아이스플랜트 추출물을 처리한 군에서는 IL-6의 생성이 485.35, 406.55, 258.77 ng/mL로 TNF-α 단독 처리한 군에 비해 각각 6.84, 21.97, 50.33% 감소함을 확인하였다(Fig. 3(A)). 또한, MCP-1의 경우, 무처리군에서는 102.03 pg/mL, TNF-α 단독 처리한 군에서는 1,203.53 pg/mL로, TNF-α에 의해 MCP-1 생성이 증가하였다(Fig. 3(B)). 아이스플랜트 추출물을 처리한 군에서는 MCP-1의 생성이 1,090.99, 851.31, 701.03 pg/mL로, TNF-α 단독 처리한 군에 비해 각각 9.31, 29.23, 41.72% 감소함을 확인하였다.
Fig. 3.
Effects of Mesembryanthemum crystallinum extract (MCE) on inflammatory response in TNF-α-treated 3T3-L1 cells.
(A) MCP-1, (B) IL-6 and (C) adiponectin were analyzed by ELISA. Values are expressed as the mean±SD of at least three independent experiments. #p⟨0.05 relative to control cells; *p⟨0.05 relative to TNF-α-treated cells.
Download Original Figure
Adiponectin은 항염증성 adipokine으로 작용하며, 염증을 유발하는 inflammatory cytokine의 생성을 조절하여 인슐린 민감도뿐만 아니라 에너지 항상성 유지에 중요한 역할을 한다(Septembre-Malaterre 등, 2016). Adiponectin은 TNF-α에 의한 nuclear factor κB(NF-κB) 활성화를 억제하여 항염증 작용을 하며, 이를 통해서 인슐린 민감도를 향상시킨다(Ouchi 등, 2000). TNF-α에 의한 염증의 증가는 adiponectin을 감소시키며 지방조직 내 염증이 지속적으로 유지되도록 한다(Ruan과 Lodish, 2003). Adiponectin 농도 감소는 인슐린 저항성, 비만, 제2형 당뇨, 심혈관계질환 등의 발생과 관련이 있는 것으로 알려져 있다(Fantuzzi, 2013; Kuo 등, 2015; Lee 등, 2013; Li 등, 2016; Ye 등, 2014). 아이스플랜트 추출물을 6시간 동안 전처리 후 TNF-α를 24시간 처리하여 TNF-α에 의해 감소된 adiponectin이 아이스플랜트 추출물에 의해 증가 되는지를 확인하였다(Fig. 3(C)). 그 결과, 무처리군에서는 610.77 ng/mL, TNF-α 단독 처리한 군에서는 413.70 ng/mL로 TNF-α에 의해 adiponectin의 생성이 감소하였다. 아이스플랜트 추출물을 처리한 군에서는 adiponectin의 생성이 467.96, 531.66, 584.41 ng/mL로, TNF-α 단독 처리한 군에 비해 각각 113.11, 128.51, 141.26% 증가함을 확인하였다. 따라서 아이스플랜트 추출물이 adiponectin의 생성을 증가시키고, 이와 반대로 증가된 inflammatory cytokine의 생성 억제를 통해서 TNF-α에 의해 지방세포 내 염증과 인슐린 저항성에 대한 개선 효능을 나타내는 것으로 판단된다. Chae(2013)는 baicalin 처리에 의해 TNF-α로 염증이 유도된 3T3-L1 세포 내 adiponectin의 증가 및 inflammatory cytokine 억제를 확인하였으며, 이를 통해서 염증 억제 및 인슐린 저항성 개선 효과를 나타낸다고 보고하였다.
3.3. NF-kB 활성화에 미치는 영향
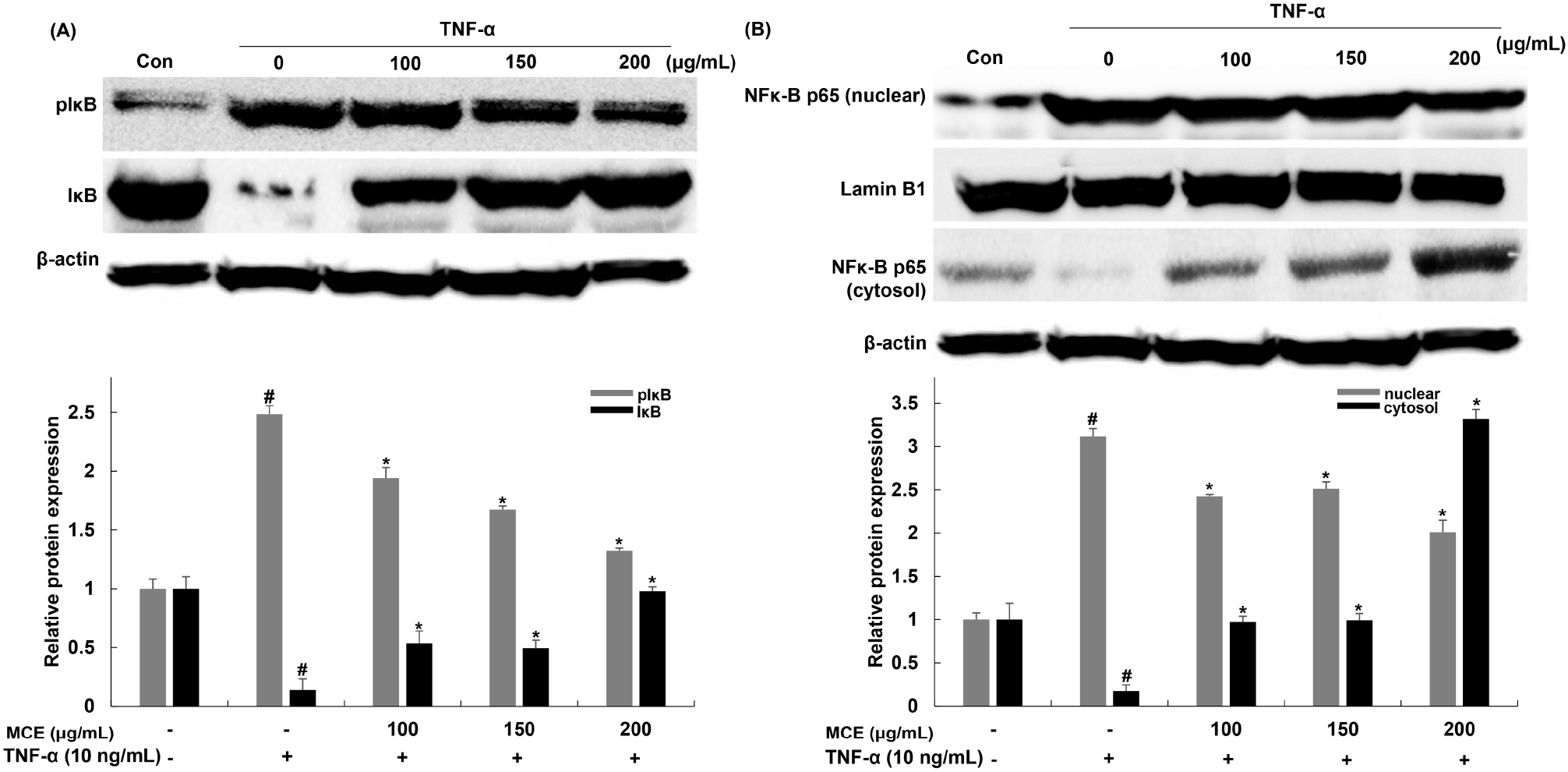
NF-κB는 염증, 지방분해, 인슐린 저항성에서 중요한 역할을 하는 전사인자로 알려져 있다. NF-κB는 세포질에 IκB와 결합되어 비활성 상태로 존재하다가 TNF-α에 의해 IκB kinase가 인산화되면 NF-κB는 IκB로부터 분리되고, 핵으로 이동하여 염증과 인슐린 저항성과 관련된 MCP-1과 IL-6와 같은 inflammatory cytokine의 생성을 유도한다. Inflammatory cytokine의 증가는 adiponectin 생성을 감소시키고 지방조직 내 염증을 지속시킬 뿐만 아니라 인슐린 저항성을 유발한다(Li 등, 2015; Li 등, 2018). 아이스플랜트 추출물이 TNF-α에 의한 IκB/NF-κB의 인산화와 핵 내 이동에 미치는 영향을 확인하기 위해 단백질 발현 변화를 western blot을 통해 확인하였다. TNF-α 단독 처리한 군에서는 인산화된 IκB가 무처리군에 비해 248.45% 증가한 것을 확인하였으며, 아이스플랜트 추출물을 처리한 군에서는 TNF-α 단독 처리한 군 대비 21.93, 32.63, 46.68% 감소함을 확인하였다(Fig. 4(A)). NF-κB p65의 핵 내 이동을 확인한 결과, TNF-α 단독 처리한 군에서 무처리군에 비해 311.65% 증가한 것을 확인하였으며, 아이스플랜트 추출물을 처리한 군에서는 TNF-α 단독 처리한 군 대비 22.17, 19.43, 35.52% NF-κB p65의 이동이 감소함을 확인하였다(Fig. 4(B)). Yin 등(2022)은 Lagerstroemia speciosa(L.) Pers 유래 flavonoid가 TNF-α에 의한 염증 및 인슐린 저항성을 NF-κB 신호전달 경로 차단을 통해서 나타냄을 보고하였다. 이와 관련하여 본 실험에서도 아이스플랜트 추출물이 TNF-α에 의한 IκB의 인산화와 NF-κB p65의 핵 내 이동을 억제함을 확인하였으며, 이를 통해서 TNF-α에 의한 염증 억제 및 인슐린 저항성을 개선 시키는 것으로 판단된다.
Fig. 4.
Effects of Mesembryanthemum crystallinum extract (MCE) on translocation of NF-κB in TNF-α-treated 3T3-L1 cells.
The protein levels of (A) IκB and (B) NF-κB was determined by western blot assay. Values are expressed as the mean±SD of of at least three independent experiments. #p⟨0.05 relative to control cells; *p⟨0.05 relative to TNF-α-treated cells.
Download Original Figure
3.4. Glucose uptake 및 insulin resistance 관련 단백질 발현에 미치는 영향
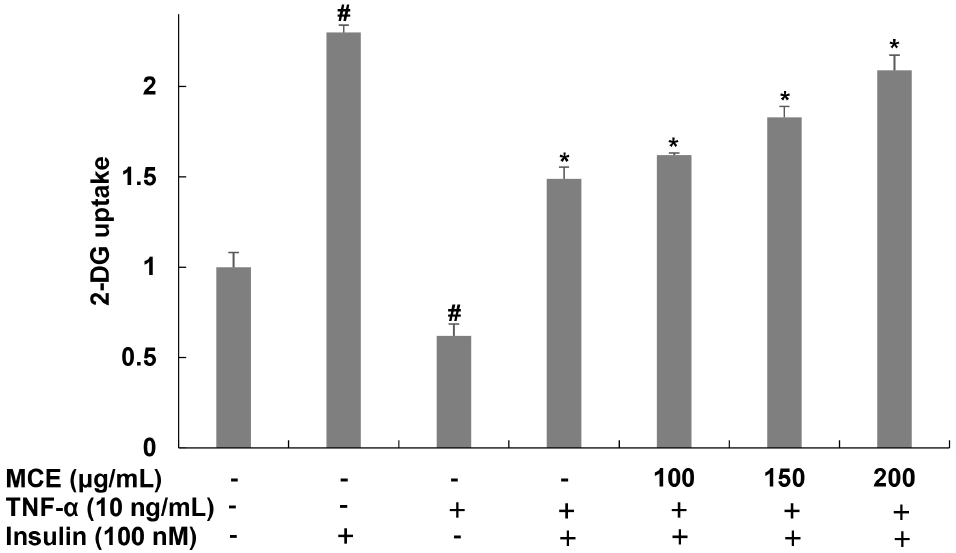
지방세포는 인슐린과 반응하여 인슐린 신호전달 과정을 통해 세포 외부에 존재하는 glucose를 내부로 유입하며, 체내 당 대사를 조절하는 기능을 수행한다. 비만에 의한 염증은 당 대사 이상 및 인슐린 저항성을 증가시키며 glucose homeostasis 유지에 영향을 주어 제2형 당뇨와 같은 대사증후군의 발생을 증가시킨다(Chen 등, 2015). TNF-α에 의해 감소된 glucose uptake에 대한 아이스플랜트 추출물의 개선 효과를 확인하기 위해 아이스플랜트 추출물을 6시간 동안 전처리하고 TNF-α를 15분 동안 처리한 후 glucose uptake 변화를 확인하였다(Fig. 5). 그 결과, 무처리군에 비해 TNF-α 단독 처리한 군의 경우, 38.07% 감소하였지만 아이스플랜트 추출물을 처리한 군에서는 TNF-α 단독 처리한 군에 비해 glucose uptake가 261.29, 295.16, 337.09% 증가함을 확인하였다. 이는 아이스플랜트 추출물이 TNF-α에 의해 유도된 인슐린 저항성을 개선하여 세포 내 glucose uptake를 증가시키는 것으로 판단된다.
Fig. 5.
Effects of Mesembryanthemum crystallinum extract (MCE) on glucose uptake in TNF-α-treated 3T3-L1 cells.
Glucose uptake was analyzed by 2-DG. Values are expressed as the mean±SD of at least three independent experiments. #p⟨0.05 relative to control cells; *p⟨0.05 relative to TNF-α-treated cells.
Download Original Figure
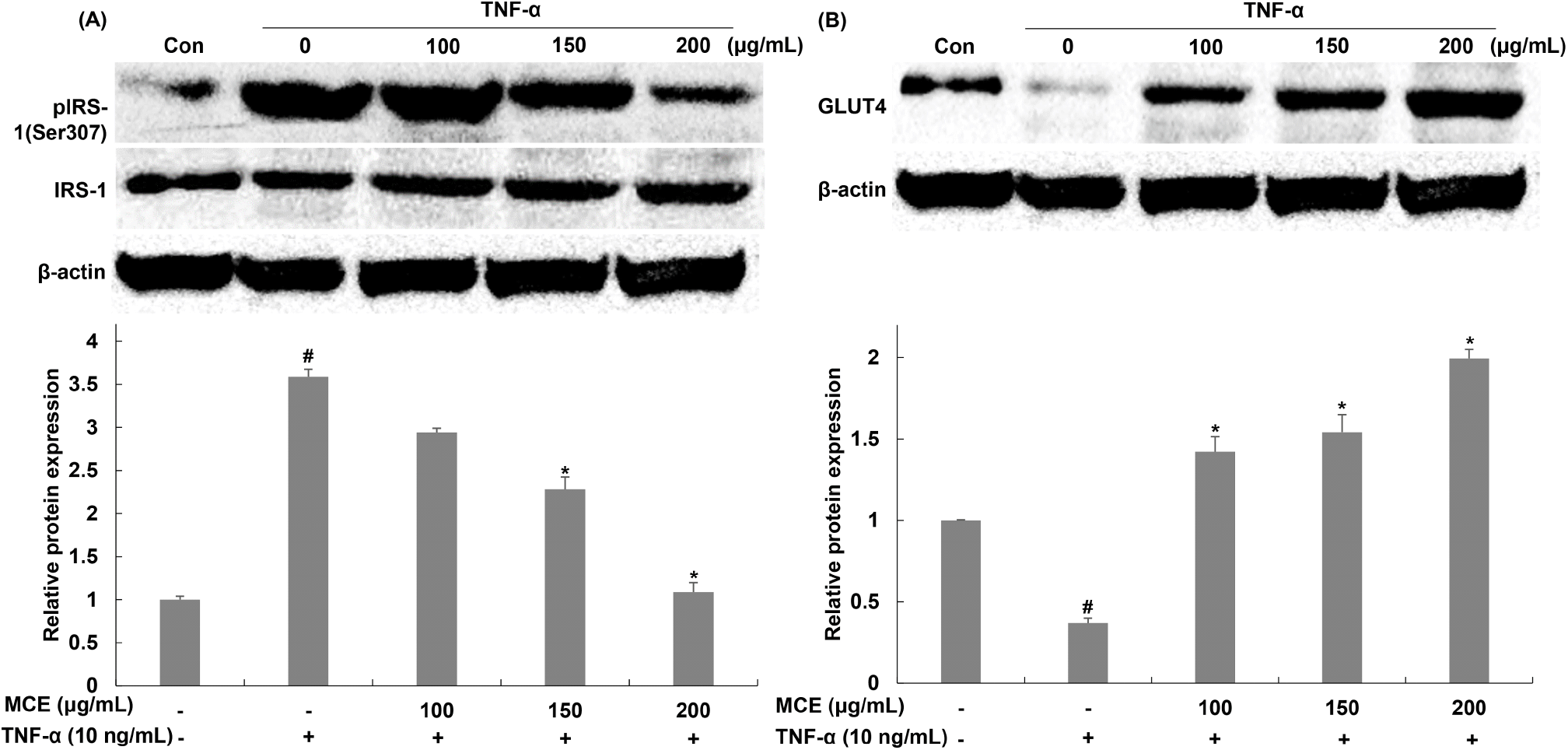
인슐린이 인슐린 수용체에 결합한 후 insulin receptor substrate(IRS)의 tyrosine 잔기들이 인산화된다. 이어서 인산화된 IRS에 의해 PI3K, Akt이 순차적으로 활성화되고 GLUT4는 cytoplasm에서 plasma membrane으로 전위되어 인슐린 자극에 의한 세포 내 glucose의 유입을 매개한다(Schinner 등, 2005). TNF-α에 의해 활성화된 염증 매개 인자들은 IRS의 serine 잔기를 인산화시키고 tyrosine 잔기의 인산화를 억제하여 인슐린 신호전달 기전의 활성화를 억제한다(Aguirre 등, 2000; Antuna 등, 2008; Gao 등, 2002; Taniguchi 등, 2006). 이로 인해 인슐린에 대한 감수성 저하와 함께 인슐린 저항성이 증가하며 세포 내 glucose 유입의 감소가 나타나게 된다(Gustafson 등, 2009; Permana 등, 2006). TNF-α에 의한 인슐린 저항성을 아이스플랜트 추출물이 개선시키는지 확인하기 위해 인슐린 신호전달 인자들의 발현 변화를 확인하였다. 인산화된 IRS-1의 발현을 확인한 결과, TNF-α 단독 처리한 군에서는 인산화된 IRS-1(Ser307)이 무처리군에 비해 376.36% 증가한 것을 확인하였으며, 아이스플랜트 추출물을 처리한 군에서는 TNF-α 단독 처리한 군 대비 2.38, 28.99, 65.81% 감소함을 확인하였다(Fig. 6(A)). GLUT4의 발현을 확인한 결과, TNF-α 단독 처리한 군에서 무처리군에 비해 63.01% 감소하였으며, 아이스플랜트 추출물을 처리한 군에서는 TNF-α 단독 처리한 군 대비 384.60, 416.93, 539.08% GLUT4 발현이 증가함을 확인하였다(Fig. 6(B)). Anusree 등(2018)은 TNF-α에 의한 IRS-1(Ser307)의 인산화가 인슐린 신호전달 경로를 방해하여 인슐린 저항성을 유도함을 보였으며, punicic acid가 IRS-1(Ser307)의 인산화 억제 및 GLUT4 발현을 통해 인슐린 저항성을 개선하여 glucose 유입을 증가시킴을 보였다. 이를 통해서 punicic acid가 인슐린 저항성을 개선함을 보고하였으며 본 연구와 유사한 결과를 보였다. 이러한 결과를 통해 인산화된 IRS-1(Ser307) 발현 억제 및 GLUT4의 발현 증가를 통해 glucose 유입을 증가시키는 것을 확인하였다.
Fig. 6.
Effects of Mesembryanthemum crystallinum extract (MCE) on the expression of pIRS-1 and GLUT4 in TNF-α-treated 3T3-L1 cells.
The protein levels of (A) pIRS-1 (Ser307) and (B) GLUT4 were determined by western blot assay. Values are expressed as the mean±SD of at least three independent experiments. #p⟨0.05 relative to control cells; *p⟨0.05 relative to TNF-α-treated cells.
Download Original Figure
따라서 아이스플랜트 추출물이 TNF-α에 의한 염증 억제와 인슐린 신호전달 경로를 활성화하여 인슐린 저항성을 개선하고 세포 내 glucose 유입을 증가시키는 효과를 가지고 있으며, 비만에 따른 염증과 인슐린 저항성에 의해 유발되는 대사증후군 개선을 위한 기능성 소재로서의 활용 가능성을 보여준다. 더 나아가 기능성 소재 개발을 위해 관련 기작 구명과 함께 동물 실험 및 아이스플랜트 추출물에 함유되어 있는 기능성 물질 분리에 관한 추가적인 연구가 필요할 것으로 판단된다.
감사의 글
본 연구는 중소벤처기업부(중소기업기술정보진흥원)에서 시행한 2022 산학연 Collabo R&D사업-예비연구(S3254319)의 지원에 이루어진 것이며, 연구비 지원에 감사드립니다.
References
Agarie S, Kawaguchi A, Kodera A, Sunagawa H, Kojima H, Nose A, Nakahara T. Potential of the common ice plant,
Mesembryanthemum crystallinum as a new high-functional food as evaluated by polyol accumulation. Plant Prod Sci, 12, 37-46 (2009)


Aguirre V, Uchida T, Yenush L, Davis R, White MF. The c-Jun NH(2)-terminal kinase promotes insulin resistance during association with insulin receptor substrate-1 and phosphorylation of Ser(307). J Biol Chem, 275, 9047-9054 (2000)

,


Aldhahi W, Hamdy O. Adipokines, inflammation, and the endothelium in diabetes. Curr Diab Rep, 3, 293-298 (2003)

,


Antuna-Puente B, Feve B, Fellahi S, Bastard JP. Adipokines: The missing link between insulin resistance and obesity. Diabetes Metab, 34, 2-11 (2008)

,


Anusree SS, Sindhu G, Preetha Rani MR, Raghu KG. Insulin resistance in 3T3-L1 adipocytes by TNF-
α is improved by punicic acid through upregulation of insulin signalling pathway and endocrine function, and downregulation of proinflammatory cytokines. Biochimie, 146, 79-86 (2018)

,


Chae BS. Protective effect of baicalin on the TNF-
α-mediated development of insulin resistance in differentiated 3T3-L1 cells. Nat Prod Sci, 19, 316-323 (2013)

Chen L, Chen R, Wang H, Liang F. Mechanisms linking inflammation to insulin resistance. Int J Endocrinol, 2015, 5084099 (2015)

,

,


Cheng AW, Tan X, Sun JY, Gu CM, Liu C, Guo X. Catechin attenuates TNF-
α induced inflammatory response via AMPK-SIRT1 pathway in 3T3-L1 adipocytes. PLoS One, 14, e0217090 (2019)

,

,


Drira R, Matsumoto T, Agawa M, Sakamoto K. Ice plant (
Mesembryanthemum crystallinum) extract promotes lipolysis in mouse 3T3-L1 adipocytes through extracellular signal-regulated kinase activation. J Med Food, 19, 274-280 (2016)

,


Engin A. The definition and prevalence of obesity and metabolic syndrome. Adv Exp Med Biol, 960, 1-17 (2017)

,


Fantuzzi G. Adiponectin in inflammatory and immune-mediated diseases. Cytokine, 64, 1-10 (2013)

,

,


Fontana L, Eagon JC, Trujillo ME, Scherer PE, Klein S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes, 56, 1010-1013 (2007)

,


Gao Z, Hwang D, Bataille F, Lefevre M, York D, Quon MJ, Ye J. Serine phosphorylation of insulin receptor substrate 1 by inhibitor kappa B kinase complex. J Biol Chem, 277, 48115-48121 (2002)

,


Guilherme A, Virbasius JV, Puri V, Czech MP. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nat Rev Mol Cell Biol, 9, 367-377 (2008)

,

,


Gustafson B, Gogg S, Hedjazifar S, Jenndahl L, Hammarstedt A, Smith U. Inflammation and impaired adipogenesis in hypertrophic obesity in man. Am J Physiol Endocrinol Metab, 297, E999-E1003 (2009)

,


Hanen F, Riadh K, Samia O, Sylvain G, Christian M, Chedly A. Interspecific variability of antioxidant activities and phenolic composition in
Mesembryanthemum genus. Food Chem Toxicol, 47, 2308-2313 (2009)

,


Hotamisligil GS. Inflammation and metabolic disorders. Nature, 444, 860-867 (2006)

,


Hotamisligil GS, Budavari A, Murray D, Spiegelman BM. Reduced tyrosine kinase activity of the insulin receptor in obesity-diabetes. Central role of tumor necrosis factor-alpha. J Clin Invest, 94, 1543-1549 (1994)

,

,


Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: Direct role in obesity-linked insulin resistance. Science, 259, 87-91 (1993)

,


Jack BU, Mamushi M, Viraragavan A, Dias S, Pheiffer C. Comparing the effects of tumor necrosis factor alpha, lipopolysaccharide and palmitic acid on lipid metabolism and inflammation in murine 3T3-L1 adipocytes. Life Sci, 297, 120422 (2022)

,


Kang HK, Song CH. Effects of
Amomum cadamomum Linne extract on TNF-
α-induced inflammation and insulin resistance in 3T3-L1 adipocytes. J Physiol & Pathol Korean Med, 30, 54-60 (2016)


Kang SM, Kim SJ, Nam SH. Inhibitory effect of cell differentiation against 3T3-L1 pre-adipocytes and angiotensin converting enzyme (ACE) activity of ice plant (
Mesembryanthemum crystallinum). J Korean Soc Food Sci Nutr, 46, 1012-1017 (2017)

Kern PA, Saghizadeh M, Ong JM, Bosch RJ, Deem R, Simsolo RB. The expression of tumor necrosis factor in human adipose tissue. Regulation by obesity, weight loss, and relationship to lipoprotein lipase. J Clin Invest, 95, 2111-2119 (1995)

,

,


Kuo JZ, Guo X, Klein R, Klein BE, Genter P, Roll K, Hai Y, Goodarzi MO, Rotter JI, Chen YD, Ipp E. Adiponectin, insulin sensitivity and diabetic retinopathy in latinos with type 2 diabetes. J Clin Endocrinol Metab, 100, 3348-3355 (2015)

,

,


Lee BH, Lee CC, Wu SC. Ice plant (
Mesembryanthemum crystallinum) improves hyperglycaemia and memory impairments in a wistar rat model of streptozotocin-induced diabetes. J Sci Food Agric, 94, 2266-2273 (2014)

,


Lee ES, Park SS, Kim E, Yoon YS, Ahn HY, Park CY, Yun YH, Oh SW. Association between adiponectin levels and coronary heart disease and mortality: A systematic review and meta-analysis. Int J Epidemiol, 42, 1029-1039 (2013)

,


Lee SY, Choi HD, Yu SN, Kim SH, Park SK, Ahn SC. Biological activities of
Mesembryanthemum crystallinum (ice plant) extract. J Life Sci, 25, 638-645 (2015)


Li J, Xue YM, Zhu B, Pan YH, Zhang Y, Wang C, Li Y. Rosiglitazone elicits an adiponectin-mediated insulin-sensitizing action at the adipose tissue-liver axis in otsuka long-evans tokushima fatty rats. J Diabetes Res, 2018, 4627842 (2018)

,

,


Li M, Han Z, Bei W, Rong X, Guo J, Hu X. Oleanolic acid attenuates insulin resistance via NF-
κB to regulate the IRS1-GLUT4 pathway in HepG2 cells. Evid Based Complement Alternat Med, 2015, 643102 (2015)

,

,


Li Y, Goto T, Yamakuni K, Takahashi H, Takahashi N, Jheng HF, Nomura W, Taniguchi M, Baba K, Murakami S, Kawada T. 4-Hydroxyderricin, as a PPARγ agonist, promotes adipogenesis, adiponectin secretion, and glucose uptake in 3T3-L1 cells. Lipids, 51, 787-795 (2016)

,


Luna-Vital D, Weiss M, Gonzalez de Mejia E. Anthocyanins from purple corn ameliorated tumor necrosis factor-
α-induced inflammation and insulin resistance in 3T3-L1 adipocytes via activation of insulin signaling and enhanced GLUT4 translocation. Mol Nutr Food Res, 61, 1700362 (2017)

,


Moller DE. Potential role of TNF-alpha in the pathogenesis of insulin resistance and type 2 diabetes. Trends Endocrinol Metab, 11, 212-217 (2000)


Nam S, Kang S, Kim S, Ko K. Effect of fermented ice plant (
Mesembryanthemum crystallinum L.) extracts against antioxidant, antidiabetic and liver protection. J Life Sci, 27, 909-918 (2017)

Ouchi N, Kihara S, Arita Y, Okamoto Y, Maeda K, Kuriyama H, Hotta K, Nishida M, Takahashi M, Muraguchi M, Ohmoto Y, Nakamura T, Yamashita S, Funahashi T, Matsuzawa Y. Adiponectin, an adipocyte-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway. Circulation, 102, 1296-1301 (2000)

,


Permana PA, Menge C, Reaven PD. Macrophage-secreted factors induce adipocyte inflammation and insulin resistance. Biochem Biophys Res Commun, 341, 507-514 (2006)

,


Rotter V, Nagaev I, Smith U. Interleukin-6 (IL-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin-resistant subjects. J Biol Chem, 278, 45777-45784 (2003)

,


Ruan H, Lodish HF. Insulin resistance in adipose tissue: Direct and indirect effects of tumor necrosis factor-alpha. Cytokine Growth Factor Rev, 14, 447-455 (2003)


Sartipy P, Loskutoff DJ. Monocyte chemoattractant protein 1 in obesity and insulin resistance. Proc Natl Acad Sci USA, 100, 7265-7270 (2003)

,

,


Schinner S, Scherbaum WA, Bornstein SR, Barthel A. Molecular mechanisms of insulin resistance. Diabet Med, 22, 674-682 (2005)

,


Seo JA, Ju JH. Antioxidant and growth inhibitory activities of
Mesembryanthemum crystallinum L. in HCT116 human colon cancer cells. J Nutr Health, 52, 157-167 (2019)


Septembre-Malaterre A, Le Sage F, Hatia S, Catan A, Janci L, Gonthier MP.
Curcuma longa polyphenols improve insulin-mediated lipid accumulation and attenuate proinflammatory response of 3T3-L1 adipose cells during oxidative stress through regulation of key adipokines and antioxidant enzymes. Biofactors, 42, 418-430 (2016)

,


Suganami T, Nishida J, Ogawa Y. A paracrine loop between adipocytes and macrophages aggravates inflammatory changes: Role of free fatty acids and tumor necrosis factor alpha. Arterioscler Thromb Vasc Biol, 25, 2062-2068 (2005)

,


Suganami T, Tanimoto-Koyama K, Nishida J, Itoh M, Yuan X, Mizuarai S, Kotani H, Yamaoka S, Miyake K, Aoe S, Kamei Y, Ogawa Y. Role of the toll-like receptor 4/NF-kappaB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages. Arterioscler Thromb Vasc Biol, 27, 84-91 (2007)

,


Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)

,


Tilg H, Moschen AR. Adipocytokines: Mediators linking adipose tissue, inflammation and immunity. Nat Rev Immunol, 6, 772-783 (2006)

,


Yang YH, Hao YM, Liu XF, Gao X, Wang BZ, Takahashi K, Du L. Docosahexaenoic acid-enriched phospholipids and eicosapentaenoic acid-enriched phospholipids inhibit tumor necrosis factor-alpha-induced lipolysis in 3T3-L1 adipocytes by activating sirtuin 1 pathways. Food Funct, 12, 4783-4796 (2021)

,


Ye R, Holland WL, Gordillo R, Wang M, Wang QA, Shao M, Morley TS, Gupta RK, Stahl A, Scherer PE. Adiponectin is essential for lipid homeostasis and survival under insulin deficiency and promotes
β-cell regeneration. Elife, 3, e03851 (2014)

,

,