1. 서론
비만은 지방세포 수와 크기의 증대 등으로 인해 지방조직이 비정상적으로 증가하여 축적된 상태를 의미하며, 이는 에너지 섭취와 소비의 불균형, 유전적 요인, 식습관, 운동 부족 등으로 인해 발생하게 된다(Spiegelman과 Flier, 1996). 비만은 인슐린 저항성 증가, 지속적인 염증반응, 면역세포 반응성 증가, 지방산 방출 증가 등과 같은 현상을 유도하여 고혈압, 당뇨, 고지혈증, 심혈관계 질환 등과 같은 대사증후군의 원인으로 작용하며 암과 같은 질환의 발생 빈도를 증가시키는 것으로 알려져 있다(Choe 등, 2016; Lee 등, 2005; Kopelman, 2000; Rosen 등, 2009).
지방세포의 비대는 triglyceride의 과도한 축적에 의해 유발되며, 지방세포 수의 증가는 지방전구세포가 지방세포로 분화에 의해 유발된다(Park 등, 2013). 지방전구세포가 지방세포로 분화되는 과정(adipogenesis)은 전사인자들뿐만 아니라 세포에서 분비되는 다양한 adipokine들에 의해 이루어지는 것으로 알려져 있다. 지방세포의 분화과정은 peroxisome proliferator-activated receptor γ(PPARγ), CCATT/enhancer binding protein(C/EBPα) 등과 같은 전사인자에 의해 조절된다(Gregoire 등, 1998; Ntambi와 Kim, 2000; Rosen과 MacDougald, 2006). 이러한 전사인자들은 fatty acid synthase(FAS), adipocyte protein 2(aP2), hormone-sensitive lipase(HSL), adipose triglyceride lipase(ATGL)뿐만 아니라 adipokine인 leptin, adiponectin의 발현 조절을 통해서 중성지방 생성 및 축적, 지방산 산화, 당 대사 등에 관여하며 체내 지방축적 과정에서 중요한 역할을 하는 것으로 알려져 있다(Chawla 등, 1994; Lakota 등, 2012; Lowe 등, 2011; Rosen과 MacDougald, 2006). 따라서 지방세포 분화에 관여하는 전사인자의 발현 조절을 통해 지방세포 분화를 억제하는 것은 비만 예방을 위한 중요한 기전으로 여겨지고 있다(Wang과 Hai, 2015).
꾸지뽕나무(Maclura tricuspidata)는 뽕나무과에 속하는 낙엽교목으로, 한국, 일본, 중국, 러시아 동부 지역 등에 주로 분포하고 있다(Lee, 2006). 예로부터 나뭇잎, 줄기 및 뿌리는 습진, 폐결핵, 만성 통증, 타박상, 관절염, 열매는 강장, 자양, 숙취해소, 간 및 신장보호 등을 위해 사용되었다(Choi 등, 2013; Heo, 1999). 꾸지뽕의 주요 기능성 성분에는 prenylated xanthones, hydroxybenzyl flavonoid glycosides, prenylated isoflavonoids, kaempferol, kaempferol 7-0-β-D-glucopyranoside 등과 같은, 폴리페놀 계통의 플라보넨, 플라콘올, 플라본올 글리코사이드, 플라보논 글리코사이드, 잔톤 등이 있다(An 등, 2006; Han 등, 2009; Kim 등, 1993; Kwon 등, 2014; Lee 등 1994a; Lee 등, 1994b; Park 등, 1992; Zheng 등, 2013). 꾸지뽕의 생리활성에 대해서는 항균, 항염증, 면역증강, 간 보호, 신경보호, 항비만, 항종양 등에 대한 연구 결과가 보고되어 있다(An 등, 2006; Kim 등, 2008; Lee 등, 2009; Lee 등, 2012). 기존의 연구 결과에서는 꾸지뽕나무의 부위별 다양한 생리활성 및 기능성 성분 분석 등에 대한 연구 결과들이 보고되어 있으며, 꾸지뽕 열매 및 잎의 지방세포 분화 억제 효과에 대해서는 보고되었지만 꾸지뽕 가지에 대한 연구는 보고된 바가 없다(Do 등 2011; Kim, 2018; Park, 2018; Park 등, 2021). 따라서 본 연구에서는 에탄올을 이용해 추출한 꾸지뽕 가지 추출물이 3T3-L1 지방전구세포 모델의 분화 및 지방축적에 미치는 영향을 관찰하였다. 본 연구를 바탕으로 꾸지뽕 가지의 지방축적 억제 효과를 확인하고 항비만 기능성 식품 소재로의 가능성을 검토하고자 한다.
2. 재료 및 방법
전라북도 김제에서 직접 채취한 꾸지뽕나무 가지 100 g에 70% 에탄올 300 mL를 가하고 상온에서 1주일간 침지 추출하였다. 여과지(Advantec, Tokyo, Japan)를 이용하여 추출액을 여과한 후 동결건조하였다. 동결건조하여 얻은 분말 상태의 추출물은 −20°C에 보관하며 실험에 사용하였다. 꾸지뽕나무 가지 추출물은 4.75 g을 얻어 약 4.75%의 수율을 나타냈다.
3T3-L1 세포는 American Type Culture Collection (Manassas, VA, USA)에서 분양받아 사용하였다. 10% Bovine serum, 100 unit/mL penicillin, 100 μg/mL streptomycin을 포함하고 있는 Dulbecco’s modified Eagle’s medium(DMEM)(Invitrogen, Waltham, MA, USA) 배지를 사용하여 5% CO2, 37°C 배양기에서 세포를 배양하였다. 세포 분화를 유도하기 위해 seeding한 후, confluent에 도달하면 분화 유도 인자(DMI, 2 mM dexamethsone, 0.5 mM 3-isobutyl-methylxanthine, 1 μg/mL insulin), 10% fetal bovine serum(FBS)이 포함되어 있는 DMEM 배지로 교체하여 배양하였다. 2일 후 1 μg/mL insulin과 10% FBS가 포함된 DMEM 배지로 교체하여 배양하였다. 분화유도 4일째에 10% FBS가 포함된 DMEM 배지로 교체하여 지방세포로 8일 동안 분화시켰다. 추출물은 분화 유도 기간 동안 배지로 각 농도별로 희석하여 처리하였다.
3T3-L1 세포를 96 well plate의 각 well에 분주한 후 추출물을 처리하여 48시간 배양하였다. 배양 후 배지를 제거하고 5 mg/mL 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 용액을 배지로 희석하여 100 μL(최종 농도: 0.5 μg/mL)씩 각 well마다 처리하고 4시간 동안 배양하였다. 생성된 formazan이 제거되지 않게 MTT 용액을 완전히 제거한 다음 각 well에 100 μL dimethyl sulfoxide를 첨가하고 실온에서 10분간 반응시켜 남은 formazan을 완전히 용해하였다. 용해된 formazan은 microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 세포 생존율은 대조군의 평균 흡광도값을 구하여 시료 처리군의 평균 흡광도값에 대한 백분율로 나타내었다.
3T3-L1 세포를 24-well plate에 분주하여 분화 유도가 끝난 후 세포를 PBS로 2회 세척하고, 3% formaldehyde 용액으로 세포를 상온에서 30분 동안 고정하였다. 증류수로 고정된 세포를 3회 세척하고 60% isopropyl alcohol을 5분간 처리 후 완전히 건조하였다. 0.5% oil red O 염색 시약으로 실온에서 30분간 염색하였다. 염색 시약을 제거한 후 증류수로 3회 세척하였다. 증류수를 완전히 건조 시킨 후 100% isopropyl alcohol로 염색된 세포를 용해한 뒤 520 nm에서 microplate reader(Molecular Devices)를 이용하여 흡광도를 측정하였다.
분화 유도가 끝난 후 세포를 회수하여 원심분리(12,000 rpm, 5 min, 4°C)하여 상층액을 제거하였다. Triglyceride 분석은 triglyceride quantification assay kit(Abcam, Cambridge, UK)를 사용하여, 제조사에서 제공한 분석방법에 따라 microplate reader(Molecular Devices)로 흡광도를 측정하여 결과를 얻었다.
분화 유도가 끝난 후 세포 배양액을 회수한 후 free glycerol reagent(Sigma Aldrich, St. Louis, MO, USA)와 반응시켜 측정하였다. 0.8 mL free glycerol reagent에 회수한 배양액 10 μL를 넣어 37°C에서 15분간 incubation시킨 후, microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다.
분화 유도와 추출물 처리가 끝난 후 배지에 생성된 adiponectin 및 leptin 생성량은 enzyme-linked immunosorbent assay kits(Enzo Life Sciences, Farmingdale, NY, USA)를 이용하여, 제조사에서 제공한 분석방법에 따라 microplate reader(Molecular Devices)로 흡광도를 측정하여 결과를 얻었다
세포를 회수하여 PBS로 세척한 후 RIPA buffer(50 mM Tris-HCl, pH 8.0, 150 mM NaCl, 1% NP-40, 0.5% nadeoxycholate, 0.1% SDS)를 처리하고 20분간 4°C에서 용해시켰다. 12,000 rpm, 4°C에서 20분간 원심분리하여 상등액을 회수하고, BCA protein assay kit (Thermofisher, Waltham, MA, USA)를 이용하여 단백질을 정량하고 동량의 단백질을 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)에서 전기영동하였다. 전기영동 후 단백질을 polyvinylidene fluoride membrane(Roche Diagnostics GmbH, Mannheim, Germany)에 전이시키고, everyblot blocking buffer (Bio-Rad, Hercules, CA, USA)를 이용하여 상온에서 10분 동안 blocking시켰다. 1차 antibody를 1:1,000으로 희석하여 4°C에서 하룻밤 동안 반응시켰으며 TBST로 membrane을 3회 세척 후, 2차 antibody를 1:1,000-1:2,500으로 희석하여 상온에서 2시간 반응시켰다. 반응이 끝난 membrane을 TBST로 3회 세척 후 enhanced chemiluminescent substrate(Thermofisher, Waltham, MA, USA)에 반응시켜 membrane에 생성된 protein band를 image reader(Microchemi 4.2, DNR, Neve Yamin, IS)로 확인 후 발현 정도를 분석하였다.
3. 결과 및 고찰
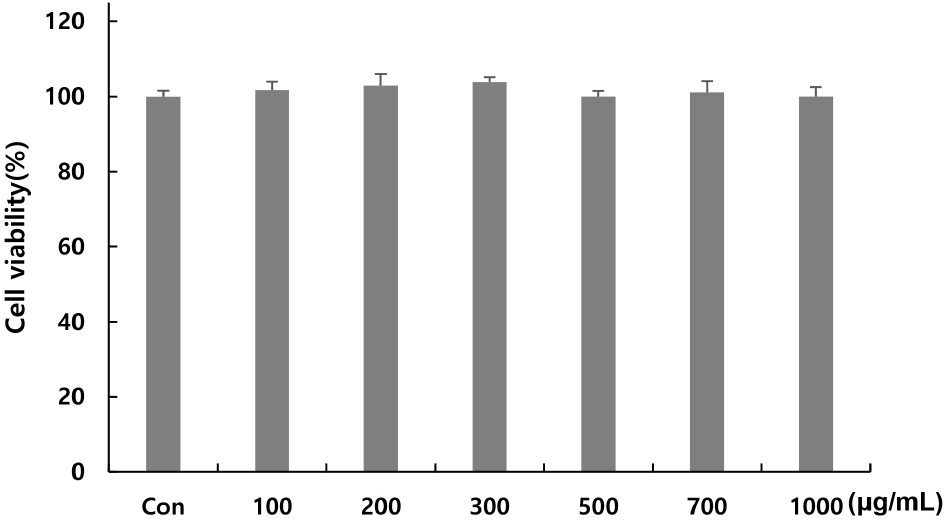
3T3-L1 세포를 이용하여 꾸지뽕 가지 추출물의 항비만 효과를 살펴보기에 앞서, 추출물의 처리농도를 결정하기 위해 MTT assay를 이용하여 3T3-L1 세포에 다양한 농도의 추출물을 처리한 후 세포 생존율을 측정하여 세포독성을 평가하였다. 추출물은 0, 100, 200, 300, 500, 700, 1,000 μg/mL의 농도로 48시간 동안 처리한 결과, 세포 생존율은 101, 102, 103, 100, 101, 100%로 확인되었다(Fig. 1). 세포 생존율에 영향을 미치지 않는 1,000 μg/mL 이하의 농도에서 실시하였다.
Phospholipid monolayer로 둘러싸인 중성지방으로 구성된 지방구는 지방세포의 분화 과정 중에 나타나며, 생성된 지방구는 lipoprotein lipase에 의한 triglyceride 유입과 adipose triglyceride lipase 및 hormone sensitive lipase에 의한 triglyceride 유출에 의해 조절된다(Manickam 등, 2010). Oil red O는 중성지방과 cholesterol만을 특이적으로 염색하고 그 외에 인지질, 유리 지방산 등은 염색되지 않기 때문에, 지방세포의 분화 정도를 확인하기 위한 방법으로 사용된다(McNeel과 Mersmann, 2003). 꾸지뽕 가지 추출물이 3T3-L1 세포가 지방세포로 분화하는 과정에서 세포 내 지방구 생성에 미치는 영향을 알아보기 위해 200, 300, 400 μg/mL 농도로 분화 유도 기간 동안 처리하고, oil red O 염색을 이용하여 지방구 생성 정도를 확인하였다. 꾸지뽕 가지 추출물을 200, 300, 400 μg/mL 농도로 분화과정 동안 처리한 후 확인한 결과, 분화 유도인자만 처리된 control군에 비해 지방구 생성이 약 10, 26, 38% 감소하였다(Fig. 2(A)). 중성지방(triglyceride)은 포도당과 함께 에너지원으로 사용되며, 에너지원으로 사용되고 남은 양은 chylomicron 및 very low density lipoprotein 등에 의해 지방세포에 저장되며 지방세포의 비대를 유발하여 비만의 원인이 된다(Yano 등, 1997). 따라서 본 연구에서는 3T3-L1 세포에 꾸지뽕 가지 추출물을 처리하여 지방세포 분화 과정 동안 생성되는 triglyceride의 생성 억제 효과를 확인하였다. 그 결과 분화 유도인자만 처리된 control군에 비해 꾸지뽕 가지 추출물을 200, 300, 400 μg/mL 농도로 처리한 군에서는 triglyceride 생성이 약 10, 17, 28% 감소하였다(Fig. 2(B)).
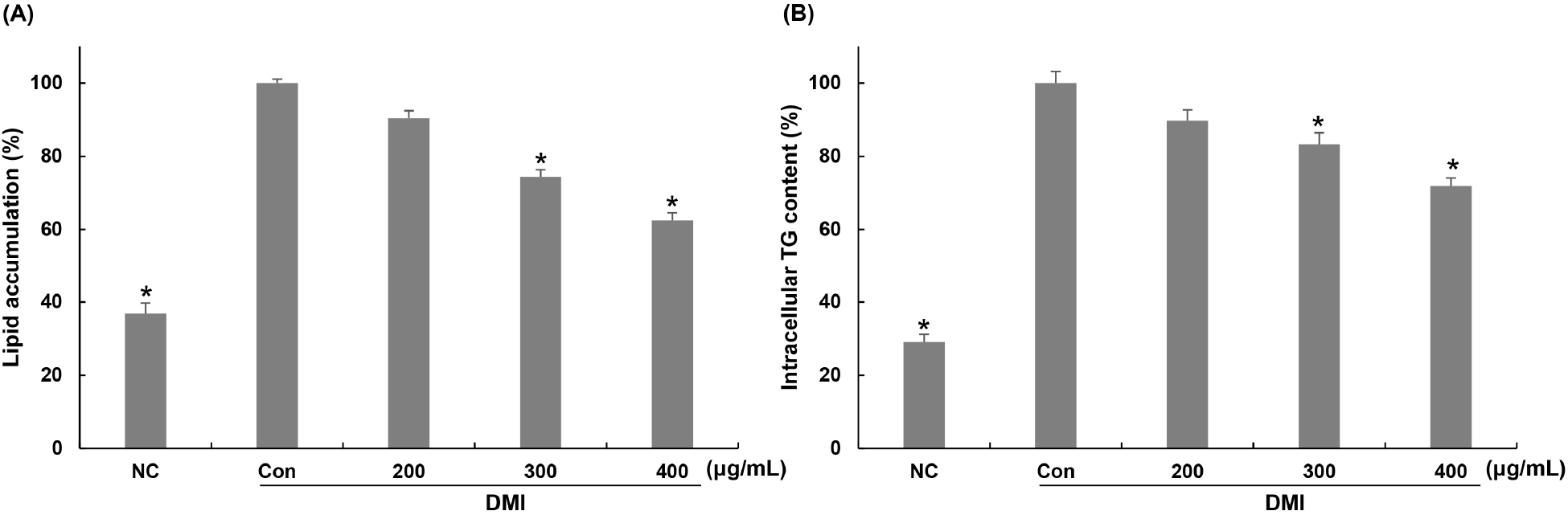
본 결과를 통해 꾸지뽕 가지 추출물이 3T3-L1 세포가 지방세포로의 분화를 억제하며 지방구 생성 및 triglyceride 축적을 감소시킬 수 있음을 확인할 수 있었다. Park 등(2021)은 꾸지뽕 부위별 잎 추출물을 3T3-L1 세포에 처리하여 지방구 및 triglyceride 축적 억제 효과를 측정한 결과, 농도 의존적으로 지방세포 분화를 억제시켜 지방 생성이 감소되었다고 보고하여, 본 연구 결과와 유사한 경향을 보였다.
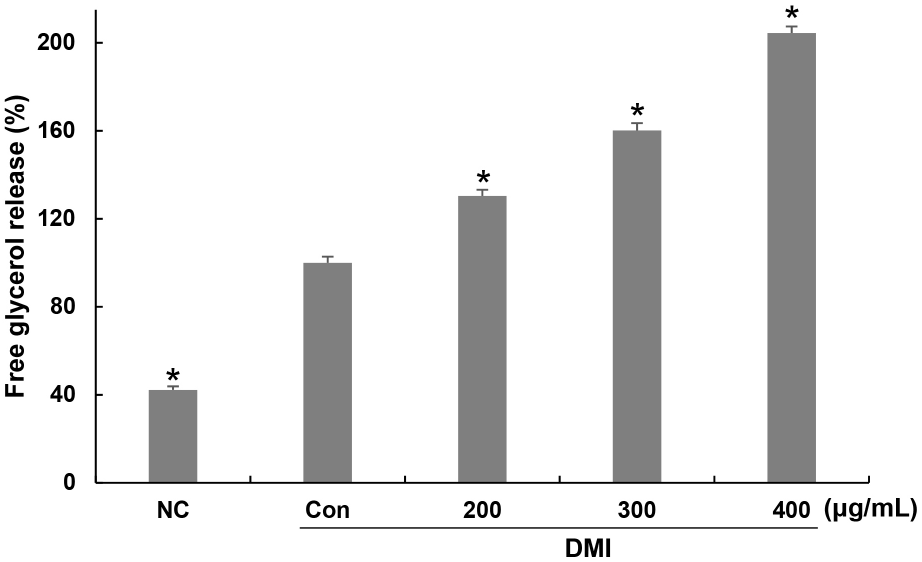
Triglyceride의 분해는 HSL, ATGL과 같은 지방분해에 의해 매개되며, 지방세포 내 지방량을 조절하는 중요한 단계로 여겨지고 있다. 지방세포 내 축적된 지방구에 존재하는 triglyceride는 분해되면 glycerol과 지방산으로 나누어지며, 지방세포 내에서 유리된 glycerol의 함량은 지방구 내 triglyceride의 분해 정도를 간접적으로 나타내는 척도로 여겨지고 있다(Lee 등, 2014). 꾸지뽕 가지 추출물을 200, 300, 400 μg/mL 농도로 분화 과정 동안 처리한 후 배지 내로 분비된 free glycerol의 함량을 확인한 결과, control군에 비해 방출된 free glycerol이 30, 60, 104% 증가하였다(Fig. 3). 일부 연구에서는 시료 처리에 의해 free glycerol 함량이 감소하는 것으로 보고된 바 있으나(You와 Jun, 2012), 본 연구에서는 꾸지뽕 가지 추출물 처리에 의해 free glycerol 함량이 증가된 것으로 나타났다. 이는 꾸지뽕 가지 추출물에 의해 분화 과정 중 지방세포 내에 생성된 triglyceride가 glycerol과 지방산으로 분해되어 free glycerol 증가가 나타난 것으로 보이며, 이러한 결과를 통해 지방세포 내 중성지방의 함량이 감소된 것으로 사료된다. Cha 등(2010)은 수세미오이 메탄올 추출물에 의해 유리된 glycerol 함량 측정 결과, 분화 유도한 control군 대비 높은 함량을 나타냈다고 보고하였으며, 이는 지방세포의 지방구 내 중성지방 분해에 의해 배양액으로 유출되는 glycerol 함량의 증가에 의한 것으로 보고하였다.
지방세포는 사이토카인, 케모카인, 호르몬 유사 인자와 같은 다양한 종류의 아디포카인을 분비하며 식욕, 당 대사, 혈압 등을 조절한다(Wozniak 등, 2009). Adiponectin과 leptin은 비만과 관련된 대표적인 아디포카인으로, 그중 adiponectin은 비만인 경우 정상인에 비해 생성량이 낮으며 체내 내장지방 축적과 반비례 관계를 나타내는 것으로 알려져 있다(Arita 등, 1999). 혈중 adiponectin 농도가 낮을 경우 체지방 증가, 고지혈, 고혈압 등의 질환뿐만 아니라 동맥경화증 및 제2형 당뇨와 같은 대사증후군을 유발하고, 이와 반대로 아디포넥틴 농도가 높으면 고지혈증 및 당뇨와 같은 질환의 발생을 감소시키는 것으로 알려져 있다(Pyrzak 등, 2010). 따라서 본 연구에서는 3T3-L1 세포를 지방세포로 분화시키는 과정 동안에 꾸지뽕 가지 추출물 처리에 의한 배양액 내 adiponectin 생성 변화를 확인하였다. 그 결과, 분화 유도인자를 단독 처리한 control군에서는 adiponectin이 31 ng/mL을 나타냈으며, 꾸지뽕 가지 추출물을 200, 300, 400 μg/mL 농도로 처리한 군에서는 49, 67, 81 ng/mL로 adiponectin 생성이 증가하였으며 각각 63, 73, 83%의 증가율을 나타냈다(Fig. 4(A)).
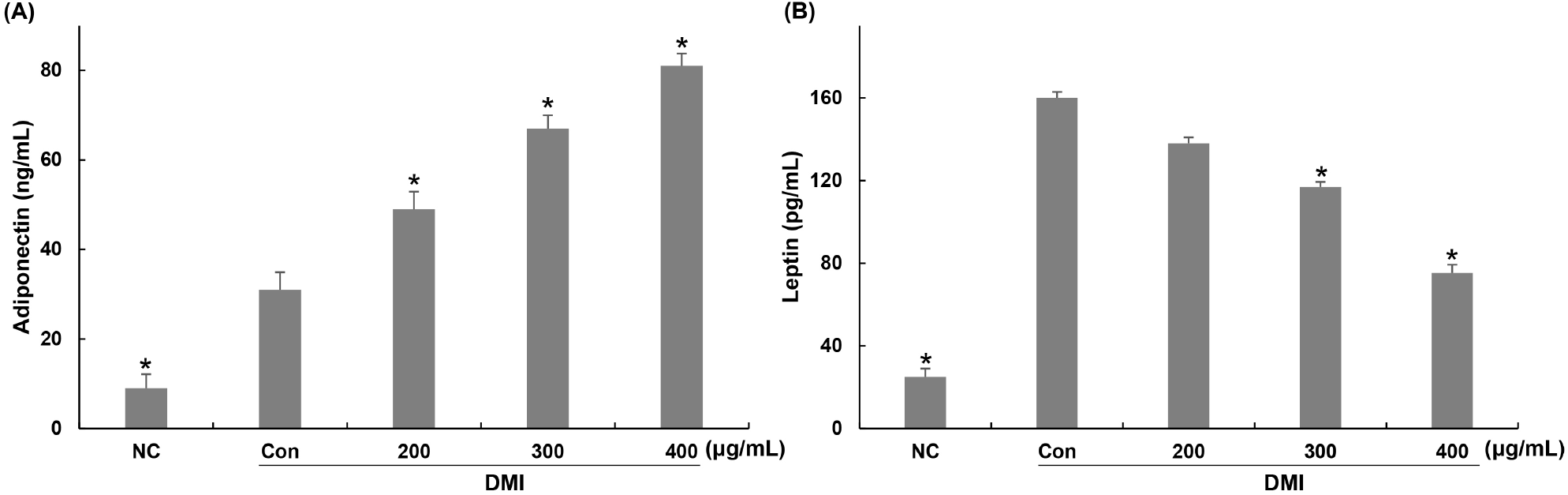
Leptin은 지방조직에서 분비되며 시상하부에 작용하여 식욕을 억제하고 에너지 항상성 및 당대사 등을 조절하여 비만을 조절한다(Caro 등, 1996). 지방세포 내 지방이 축적될수록 leptin 농도가 증가하는 것으로 알려져 있다. 비만인의 경우 leptin 농도가 정상인에 비해 높은 수준으로 나타나므로, leptin은 체지방량을 나타내는 지표뿐만 아니라 항비만 효과를 평가하기 위한 지표로 사용되고 있다(Yang 등, 2004). 따라서 본 연구에서는 3T3-L1 세포를 지방세포로 분화시키는 과정 동안에 꾸지뽕 가지 추출물 처리에 의한 배양액 내 leptin 생성 변화를 확인하였다. 그 결과, 분화 유도인자 단독 처리한 control군에서는 leptin이 160 pg/mL을 나타냈으며, 꾸지뽕 가지 추출물을 200, 300, 400 μg/mL 농도로 처리한 군에서는 138, 117, 75 pg/mL로 leptin 생성이 감소하였으며 각각 14, 27, 53%의 감소율을 나타냈다(Fig. 4(B)). 이는 꾸지뽕 가지 추출물이 분화 과정 동안 adiponectin의 생성 증가 및 leptin 생성 감소에 의해 지방축적 감소에 영향을 미친 것으로 사료되며, 비만뿐만 아니라 대사증후군의 예방 효과가 있을 것으로 기대된다. Kim 등(2014)에 의하면 함초 물 추출물을 분화 과정 동안 처리한 3T3-L1 세포에서 leptin 생성 억제 및 adiponectin 생성 증가 효과를 나타냈으며, 이를 통해 지방구 생성 또한 유의적으로 억제시킴이 보고되어 본 연구와 유사한 결과를 나타내었다.
지방세포 내 지방분해는 HSL, ATGL과 같은 지방분해효소에 의해 중성지방이 유리 지방산과 글리세롤로 가수분해되며 이루어진다(Ducharme 등, 2008; Gaidhu 등, 2010). HSL은 세포 내에 존재하는 중성지방을 분해하여 지방산과 글리세롤을 생성하며 생성된 글리세롤은 세포 밖으로 유리된다(Zechner 등, 2005). ATGL은 중성지방에 특이적으로 작용하는 효소이며 지방분해 첫 단계인 diglyceride의 생성에 관여하는 것으로 알려져 있다(Bamba와 Rader, 2007). 꾸지뽕 가지 추출물이 지방대사에 관여하는 지방분해효소인 HSL, ATGL 발현에 영향을 미치는지 확인하기 위해, 지방세포로 분화를 유도하는 동안 추출물을 처리하고 western blot을 이용하여 HSL, ATGL의 발현 변화를 확인하였다(Fig. 5). 그 결과, 지방전구세포에 비해 분화 유도인자 단독 처리에 의해 지방세포로 분화를 유도한 control군에서는 HSL, ATGL 발현이 현저하게 감소함을 확인하였다. 꾸지뽕 추출물을 200, 300, 400 μg/mL을 분화 과정 동안 처리한 후 확인한 결과, control군에 비해 HSL는 167, 215, 245%, ATGL은 688, 679, 797% 발현이 증가하였다. 이러한 결과들은 free glycerol 생성 증가와 일치하였으며 꾸지뽕 가지 추출물은 지방분해효소인 HSL과 ATGL의 발현을 유도하여 지방분해에 관여하는 것으로 판단된다. Park 등(2019)은 가자, 암라 추출복합물이 HSL, ATGL의 발현을 유도하여 중성지방의 가수분해에 작용함으로써 free glycerol의 생성을 증가시키고 지방축적 억제 효과를 나타낸다고 보고하였으며, 본 연구에도 유사한 결과를 확인할 수 있었다.
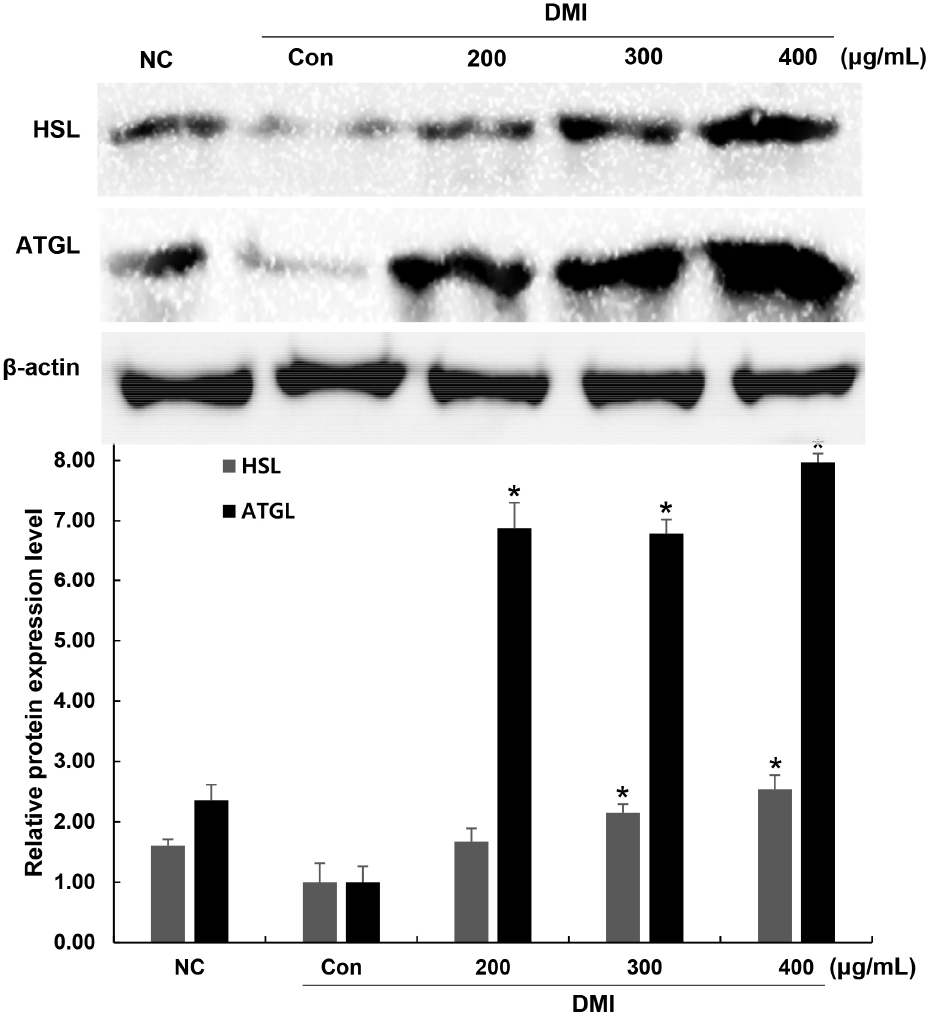
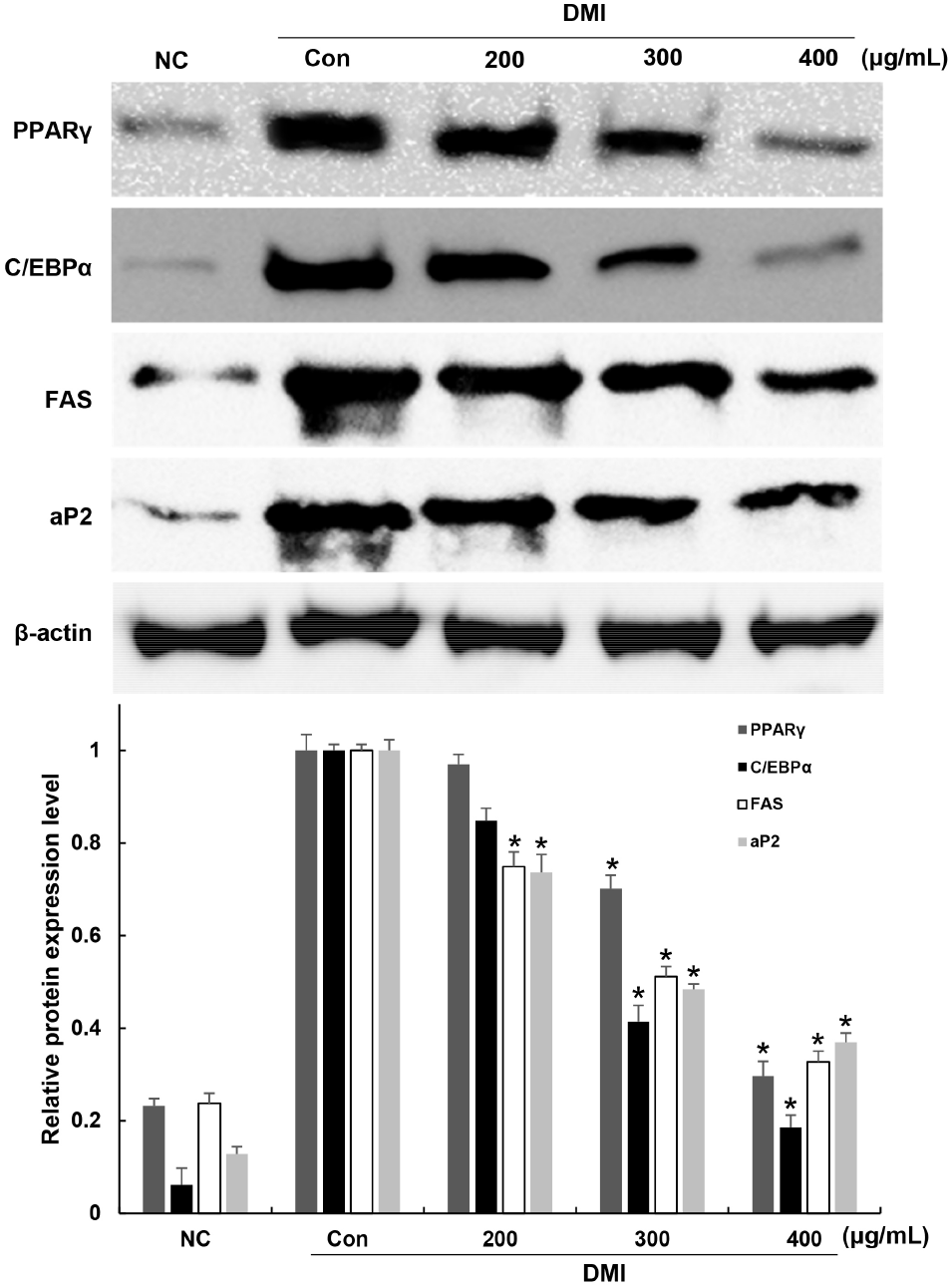
지방전구세포에서 지방세포로 분화하는 과정에는 지방축적에 의한 지방구 생성 증가와 함께, 지방세포 분화와 관련된 transcription factor들의 발현과 adipokine들의 생성 변화가 나타난다. PPARγ와 C/EBPα는 지방세포의 분화 과정을 조절하는 대표적인 전사인자로 알려져 있다. 이러한 전사인자들은 중성지방 합성과 저장에 관여하는 FAS, 지방산의 합성과 이동 및 저장에 관여하는 aP2 등과 같은 유전자들의 발현을 조절하고 지방세포 분화에 관여하며, 지방구와 triglyceride의 생성 및 축적뿐만 아니라 지방대사를 촉진함으로써 지방세포의 비대 및 생성을 초래한다(Hwang 등, 1997; Lakota 등, 2012; Park 등, 2021; Rosen 등, 2009; Tang과 Lane 2012). 이러한 adipogenesis와 관련된 transcription factor들의 발현 조절은 항비만 연구에서 중요한 지표로 여겨지고 있다.
꾸지뽕 가지 추출물이 지방축적에 관여하는 transcription factor 발현에 영향을 미치는지 확인하기 위해 지방세포로 분화를 유도하는 동안 추출물을 처리하고, western blot을 이용하여 PPARγ, C/EBPα, aP2, FAS의 발현 변화를 확인하였다(Fig. 6). 그 결과, 지방전구세포에 비해 분화 유도인자 단독 처리에 의해 지방세포로 분화를 유도한 control군에서는 PPARγ, C/EBPα, aP2, LPL 발현이 현저하게 증가함을 확인하였다. 꾸지뽕 추출물을 200, 300, 400 μg/mL를 분화 과정 동안 처리한 후 확인한 결과, control군에 비해 PPARγ는 3.0, 29.9, 70.3%, C/EBPα는 15, 59, 81%, FAS는 25, 49, 67%, aP2는 26, 52, 63% 발현이 감소하였다. 이러한 결과들은 lipid droplet과 중성지방 축적 억제 결과와 일치하였다. 따라서 꾸지뽕 가지 추출물은 3T3-L1 지방전구세포에서 adipogenic transcription factor로 중추적인 역할을 하는 PPARγ와 C/EBPα의 발현을 효과적으로 억제시킴으로써, aP2, FAS와 같은 지방산 합성과 전달에 관여하는 유전자의 발현을 억제시키며 지방세포 내 지방축적 억제 효과를 나타내는 것으로 여겨진다.
비만은 체내 지방이 과도하게 축적된 상태를 의미한다. 이러한 과도한 지방축적은 지방전구세포에서 지방세포로의 분화를 통해 일어나므로 지방세포 분화 억제에 관한 연구는 비만 예방에 있어 중요한 부분을 차지한다. 이상의 결과를 종합하면 꾸지뽕 가지 추출물은 3T3-L1 세포 내 PPARγ, C/EBPα의 발현 조절을 통해서 이들 전사인자들의 타겟 유전자인 FAS, aP2, leptin, adiponectin의 발현을 조절하여 지방세포의 분화 및 지방축적을 억제할 뿐만 아니라 HSL, ATGL의 발현을 증가시킴으로써 지방분해를 촉진하여 지방축적을 억제시키는 것으로 판단된다. 그러나 지방세포 분화 및 지방축적을 나타내는 여러 가지 기전이 있으므로 다른 작용기전과 관련된 신호전달체계에 관한 연구는 더 진행되어야 할 것으로 여겨지며, 본 연구 결과를 통해서 꾸지뽕 가지 추출물의 항비만 소재로서 가능성에 대한 기초자료로 이용될 수 있을 것으로 기대한다.
4. 요약
본 연구에서는 꾸지뽕(M. tricuspidata) 가지 추출물이 지방전구세포가 지방세포로 분화하는 과정에서 미치는 영향을 확인하여 항비만 소재로서 이용 가능성을 확인하였다. 세포독성을 확인하기 위해 최대 1,000 μg/mL 농도까지 세포에 처리하여 확인한 결과 세포 독성을 유발하지 않는 것으로 확인되었다. Oil red O 염색을 통해 지방구 생성이 감소함을 확인하였으며 triglyceride 생성 역시 감소가 확인되었다. 비만과 관련된 대표적인 adipokine으로 알려진 leptin과 adiponectin의 생성에 미치는 영향을 확인한 결과, 꾸지뽕 가지 추출물에 의해 leptin의 생성은 감소하였으며 adiponectin의 생성은 증가하였다. 꾸지뽕 가지 추출물의 지방세포 분화 및 지방축적 억제 효과는 PPARγ, C/EBPα, FAS, aP2의 발현 억제와 관련 있는 것으로 확인되었다. 또한, free glycerol의 함량이 증가되었으며, triglyceride를 지방산과 glycerol로 분해하는 지방분해효소인 HSL과 ATGL의 발현이 증가하였다. 이러한 결과들을 통해 꾸지뽕 가지 추출물은 adipogenesis와 관련된 전사인자의 발현 및 지방분해효소의 발현을 억제하여 지방세포의 분화 및 지방축적을 억제하였으며, 이를 통해 항비만 효과를 나타내는 것으로 판단된다. 따라서 꾸지뽕 가지 추출물은 항비만 효과를 가진 기능성 식품 소재로서의 활용 가치가 있는 것으로 판단되며, 보다 명확한 항비만 효능을 확인하기 위해서는 추후 유용 성분 분리, 작용기전 및 동물 실험 등에 대한 연구가 필요할 것으로 생각된다.
