1. 서론
비알코올성 지방간(non-alcoholic fatty liver disease)은 간 조직 내 지방이 과도하게 축적된 상태로 단순 간지방증에서 지방간염 및 간경변증으로 진행되며 비만, 당뇨 및 대사증후군과 밀접한 관계가 있다(Younossi 등, 2016). 특히, 과도한 탄수화물 섭취는 스테롤 조절 요소 결합 단백질(sterol regulatory element-binding proteins, SREBP)을 활성화함으로써 acetyl-coA carboxylase(ACC)로부터 유리 지방산(free fatty acid, FFA) 합성을 촉진하는 것으로 알려져 있다(Cohen 등, 2011). FFA는 간 조직 내에서 중성지방(triglyceride)으로 축적되어 비알코올성 지방간 질환을 유발하며, 과도한 지방 및 지방산 합성은 tumor necrosis factor-α(TNF-α)와 같은 전염증성 사이토카인을 분비하여 인슐린 수용체의 신호전달을 억제함으로써 인슐린 저항성을 초래한다(Kitade 등, 2017; Saponaro 등, 2015). 인슐린 저항성은 지방 조직에서 adipose triglyceride lipase(ATGL)에 의한 지방분해를 촉진하고 간 조직 내 지방산 유입을 증가시켜 지방축적을 일으킨다(Zhai 등, 2010). 이러한 비정상적인 지방축적은 toll-like receptor-4(TLR4) 신호 경로를 활성화하여 nuclear factor kappa B(NF-κB)로부터 interleukin 1 beta(IL-1β), interleukin 6(IL-6) 및 TNF-α와 같은 전염증성 사이토카인의 전사를 유도하여 염증 반응을 일으키고 지방간염을 유발하는 것으로 알려져 있다(Musso 등, 2018). 따라서, 간 조직 내 지방축적을 억제하여 비알코올성 지방간 질환 개선에 도움을 주는 소재 개발 연구가 필요하다.
호두(Juglans regia)는 전 세계에서 널리 재배되는 작물로, 필수지방산인 α-리놀렌산 및 γ-토코페롤과 같은 비타민 E가 풍부한 것으로 알려져 있다(Ros 등, 2018). α-리놀렌산은 음식을 통해서만 섭취할 수 있으며 체내에서 eicosapentaenoic acid(EPA) 및 docosahexaenoic acid (DHA)와 같은 오메가-3 지방산으로 전환되어 혈중 콜레스테롤 수치를 감소시킨다(Kim 등, 2014). 또한, 비타민 E는 지질 과산화로 인한 lipid peroxyl radical (LO2•)을 소거하여 항산화 효과를 나타내는 것으로 알려져 있다(Niki, 2014). 특히, 호두의 주요 폴리페놀 성분으로 알려진 엘라지탄닌(ellagitannin)은 체내에서 가수분해되어 엘라그산(ellagic acid)을 방출하며, 항산화, 항염증 및 항암 효과와 같은 생리활성을 가지는 것으로 보고되고 있다(Landete, 2011). 호두의 영양성분은 원산지 및 품종별로 차이가 있으며, 사전 연구를 통해 김천 1호는 김천시에서 생산된 3개 품종(김천 1호, 금곡, 금릉) 및 국내에 수입되는 중국산 호두보다 우수한 총토코페롤 함량을 나타내었고 다양한 polyunsaturated fatty acid(PUFA)를 함유한 것을 확인하였다(Kim 등, 2020). 반면, 국내 총호두 생산량(1,100톤)은 국내 전체 호두 소비량(14,000톤)의 약 8% 수준으로, 국내에서 유통되는 호두의 상당수가 수입되고 있어 국내산 호두의 경쟁력이 감소하고 있다(Oh 등, 2020). 따라서 수입산 호두를 대체하기 위한 지속적인 국내 산업 규모 확대 및 다양한 생리활성 연구를 통한 국내산 호두 품종의 산업적 가치 평가가 필요하다.
본 연구는 국내에서 호두 생산량이 가장 많은 김천시의 호두 품종 중 김천 1호의 항당뇨 활성을 확인하였고, 이를 이용하여 간세포에서 과산화수소(hydrogen peroxide, H2O2) 및 고당(high glucose)으로 유도된 독성에 대한 세포 보호 효과를 측정하였다. 또한, oleic acid를 처리하여 지방축적이 유도된 간세포에서 지방축적 억제 효과를 평가하고, 지방 생성에 관여하는 인자들의 발현을 측정하여 비정상적인 체내 지질 대사를 개선하는 건강기능식품 개발을 위한 호두의 이용 가능성을 확인하고자 연구를 진행하였다.
2. 재료 및 방법
본 연구에 사용된 호두(Juglans regia)는 경상북도 김천시에서 2018년에 재배된 김천 1호 품종의 호두를 구매하여 이용하였다. 동결건조기(Operon, Gimpo, Korea)로 호두의 견과를 동결건조하고 분쇄하여 −20°C에서 냉동 보관하였다. 동결건조된 시료 2 g에 에탄올 용매 100 mL를 각각 0%, 20%, 40%, 60%, 80%, 95% 농도로 가하여 환류 냉각하에 40°C에서 2시간 동안 추출하였다. 추출물은 No. 2 여과지(Whatman PLC, Kent, UK)로 여과한 뒤 회전진공농축기(N-N series, Eyela Co., Tokyo, Japan)를 이용하여 농축하였다. 농축된 추출물은 동결건조기(Operon)를 이용하여 동결건조하고 −20°C에서 냉동 보관하여 실험에 사용하였다.
α-Amylase 억제 활성을 측정하기 위해 0.02 M sodium phosphate buffer(pH 6.9)와 시료 및 0.1 mg/mL α-amylase를 혼합하여 37°C에서 10분간 반응시킨 후, 1% starch를 가하여 같은 조건에서 10분간 반응시켰다. 반응물에 3,5-dinitrosalicylic acid(DNS)를 가하여 100°C 항온수조에서 5분간 발색시킨 후 540 nm 파장에서 흡광도를 측정하였다.
α-Glucosidase 억제 활성은 0.1 M sodium phosphate buffer(pH 6.9), 시료 및 0.5 unit/mL α-glucosidase를 혼합하여 10분간 반응시킨 후 기질로 3 mM 4-nitrophenyl-α-D-glucopyranoside를 가하고 5분간 반응시켜 마이크로플레이트 판독기(Epoch 2, BioTek, Winooski, VT, USA)를 이용하여 405 nm 파장에서 흡광도를 측정하였다.
최종당화산물 생성 억제 활성을 측정하기 위해 0.2 M phosphate buffer(pH 7.4)에 0.02% sodium azide, 50 mg/mL bovine serum albumin(BSA), 1.25 M fructose 및 시료를 혼합하여 37°C에서 3일간 반응시킨 후, 96-well black plate에 100 μL씩 분주하여 형광광도계(fluorometer, Infinite F200, TECAN, Mannedorf, Swiss)를 이용하여 형광강도(excitation: 360 nm, emission: 430 nm)를 측정하였다.
본 연구에 사용된 간세포는 인간의 간 조직에서 유래한 HepG2 세포로, 한국세포주은행(KCLB-88065, Korean Cell Line Bank, Seoul, Korea)에서 구매하여 이용하였다. HepG2 세포는 37°C, 5% CO2 조건에서 10% fetal bovine serum, 50 unit/mL 페니실린 및 100 μg/mL 스트렙토마이신이 포함된 Dulbecco’s modified Eagle’s medium(DMEM) 배지를 이용하여 배양하였다.
간세포에 대한 보호 효과는 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazoliumbromide(MTT) 분석법을 이용하여 측정하였다. 96-well plate에 HepG2 세포를 1×104 cells/well로 분주하여 24시간 동안 배양하였다. H2O2에 대한 간세포 보호 효과를 측정하고자 세포에 시료를 처리하여 24시간 동안 배양하고, 200 μM H2O2를 처리하여 3시간 동안 배양하였다. 또한, 고당에 대한 간세포 보호 효과를 측정하고자 세포에 시료를 처리하여 3시간 동안 배양하고 50 mM glucose를 처리하여 24시간 동안 배양하였다. 이후, 시료 및 H2O2 또는 고당을 처리한 세포에 MTT 시약을 처리하여 3시간 동안 반응시킨 후 DMSO를 가하여 반응을 종결시키고 마이크로플레이트 판독기(Epoch 2, BioTek)를 이용하여 570 nm(determination)와 655 nm(reference)에서 흡광도를 측정하였다.
HepG2 세포에서 H2O2 및 고당 처리로 인한 산화 스트레스를 측정하기 위해 2’,7’-dichlorofluorescein diacetate (DCF-DA)를 이용하였다. 96-Well black plate에 HepG2 세포를 1×104 cells/well로 분주하여 24시간 동안 배양하였다. 이후, 세포에 시료를 처리하여 24시간 동안 배양한 후 200 μM H2O2를 처리하고 3시간, 50 mM glucose를 처리하고 24시간 동안 배양하였다. 배양한 세포에 DCF-DA를 처리하여 50분 동안 반응시킨 후 형광광도계(fluorometer, Infinite F200)를 이용하여 형광강도(excitation: 485 nm, emission: 535 nm)를 측정하였다.
간세포에 영향을 미치는 시료의 최소 농도를 확인하기 위하여 MTT assay를 이용하였고 oil red O 염색법을 이용하여 간세포에서의 지방축적 억제 효과를 분석하였다. 24-Well plate에 HepG2 세포를 1×105 cells/well로 분주하여 24시간 동안 배양하고 시료를 처리하여 24시간 동안 배양하였다. 이후, 500 μM oleic acid가 첨가된 DMEM 배지로 교체하고 12시간 동안 배양하여 지방축적을 유도하고, 10%(v/v)의 formalin으로 1시간 동안 실온에서 고정하였다. 고정된 세포를 3.5 mg/mL의 oil red O를 이용해 10분 동안 실온에서 염색하였고, 전자현미경(CKS41, Olympus, Tokyo, Japan)을 이용하여 이미지를 얻어내었다. 또한, 간세포 내 지방축적 수준을 확인하기 위해 100% isopropanol을 가하여 세포 내 염색된 oil red O를 녹여낸 후, 96-well plate에 옮겨 마이크로플레이트 판독기(Epoch 2, BioTek)를 이용하여 500 nm의 파장에서 흡광도를 측정하였다.
Oleic acid를 처리한 HepG2 세포를 이용하여 지방 합성에 관여하는 단백질의 발현을 측정하였다. HepG2 세포는 1% protease inhibitor가 함유된 RIPA buffer를 이용하여 균질화한 후, 13,000 × g에서 원심분리하여 얻어낸 상등액을 단백질 정량을 통해 동일한 함량으로 맞추었다. 이를 8% sodium dodecyl sulfate-polyacrylamide gel (SDS-PAGE)을 통해 단백질을 분리하여 polyvinylidene difluoridemembrane(Millipore, Billerica, MA, USA)으로 이동시키고, 5% skim milk(Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하여 blocking하였다. 이후, 4°C에서 12시간 동안 membrane을 1:1,000으로 희석한 1차 항체와 반응시킨 다음, 상온에서 1:5,000으로 희석한 2차 항체와 1시간 동안 반응시켰다. 마지막으로 membrane을 ECL(ProNATMECL Ottimo, TransLab, Daejeon, Korea) 시약과 반응시켜 iBrightTM CL1000 Imaging System (iBright Imager, Thermo Fisher, Waltham, MA, USA)을 통해 단백질 발현을 측정하였다.
3. 결과 및 고찰
체내에서 α-amylase는 음식을 통해 섭취한 탄수화물의 α-D-(1-4)glycoside 결합을 올리고당으로 분해한다. 분해된 올리고당은 소장 융모막에 존재하는 α-glucosidase에 의해 포도당과 같은 흡수 가능한 형태의 단당류로 분해된다(Lordan 등, 2013). 특히, 고탄수화물 식이로 인해 간세포 내 과도하게 흡수된 포도당은 지방 합성의 기질로 작용하여 지방축적을 일으키는 것으로 알려져 있다(Ameer 등, 2014). 따라서, 호두 추출물의 α-amylase 및 α-glucosidase 억제 활성을 측정하여 탄수화물 분해 및 체내 단당류 흡수 억제에 관한 연구를 진행하였다. 에탄올 농도별 호두 추출물의 α-amylase 억제 활성을 측정한 결과는 Fig. 1(A)와 같다. 80% 에탄올 추출물 20 μg/mL 농도에서 47.61%의 억제 활성을 보였으며, acarbose는 100 μg/mL 농도에서 91.37%의 억제 활성을 나타내었다. 이어서 에탄올 농도별 호두 추출물의 α-glucosidase에 대한 억제 활성은 Fig. 1(B)와 같다. 80% 에탄올 추출물은 1 μg/mL 농도에서 76.10%의 억제 활성을 나타내었고, 이는 200 μg/mL 농도에서 50.32%의 억제 활성을 갖는 acarbose보다 우수하였다.
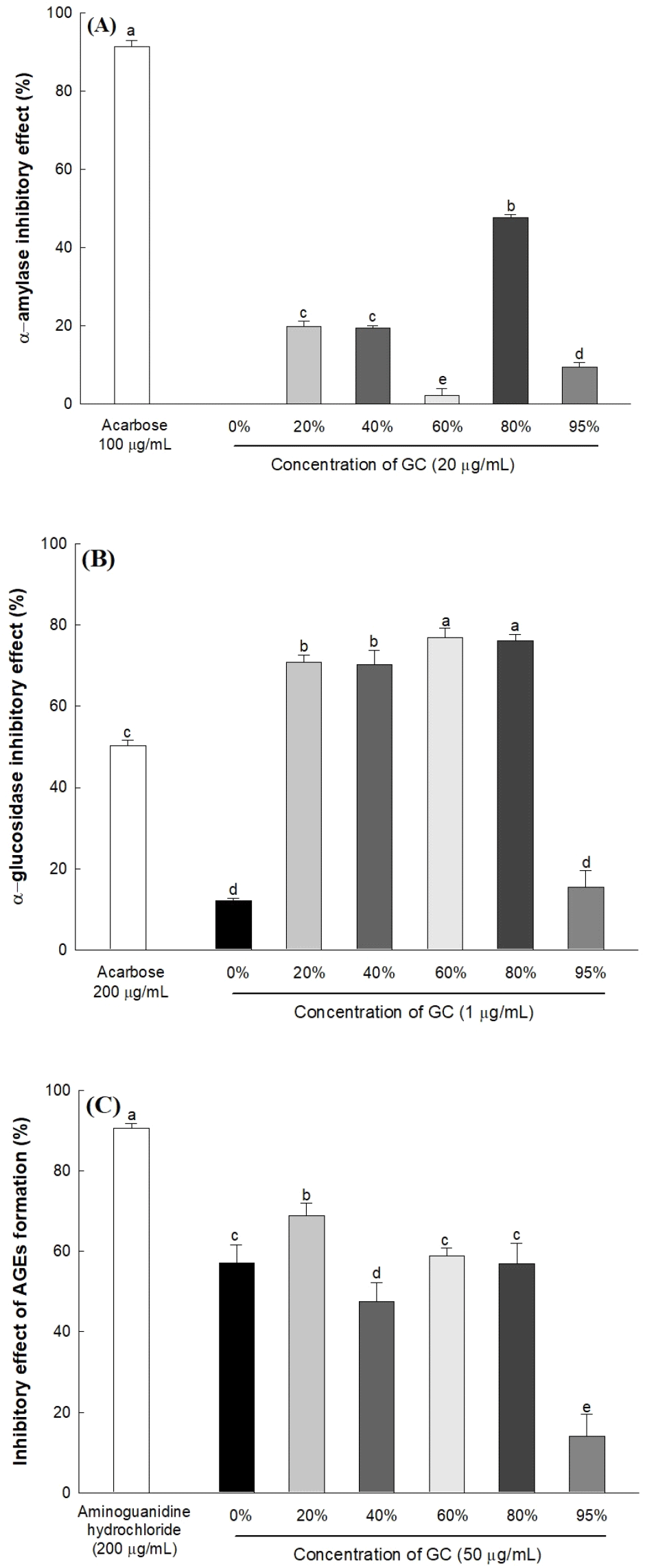
체내에서 탄수화물을 단당류로 분해하는 과정에 관여하는 α-amylase 및 α-glucosidase의 활성 억제를 통해 당 흡수를 제한함으로써 간 조직 내 지방축적을 억제할 수 있는 것으로 알려져 있다(Kim 등, 2018). 본 실험에서 양성 대조군으로 사용된 acarbose는 포도당의 흡수를 감소 및 지연시키는 당뇨병 치료제로 알려져 있다. 하지만 장기간 acarbose 복용 시 과도한 α-amylase 억제로 인해 소화되지 않은 탄수화물이 장에 축적되어 설사 및 복부팽만과 같은 여러 부작용이 보고되어, 이를 대체하기 위한 소재 개발 연구가 필요하다(Oboh 등, 2016). 특히, 본 실험에서 호두 추출물은 acarbose보다 낮은 α-amylase 억제 활성을 나타냈으나, acarbose보다 낮은 농도에서 우수한 탄수화물 소화효소 억제 활성을 갖는 천연소재라는 점에서 이상적인 항당뇨 기능성 소재로 이용 가능할 것으로 판단된다. 또한, Les 등(2018)의 연구에서 엘라그산은 acarbose보다 강력한 α-glucosidase 억제 활성을 나타내었으며, Moon 등(2020)은 정성분석을 통해 엘라지탄닌 및 엘라그산을 김천 1호 호두의 주요 생리활성 물질로 보고하였다. 따라서, 본 실험에서 호두 추출물이 갖는 강력한 α-glucosidase 억제 활성은 김천 1호 호두에 함유된 엘라그산에서 기인한 것으로 추측된다.
과도한 탄수화물 및 지방 섭취로 인해 체내에 축적된 환원당과 단백질의 비효소적 당화 반응으로 형성된 최종당화산물은, reactive oxygen species(ROS)를 생성하여 산화 스트레스를 유발하는 것으로 알려져 있다(Singh 등, 2014). 비가역적으로 생성된 최종당화산물은 잘 분해되지 않고 체내에 축적되어, 인슐린을 합성하는 췌장 β 세포를 손상시키고 당뇨병 합병증을 유발하는 것으로 알려져 있다(Nowotny 등, 2015). 따라서, 에탄올 농도별 호두 추출물의 최종당화산물 생성 억제 활성을 측정한 결과는 Fig. 1(C)와 같다. 20% 에탄올 추출물과 80% 에탄올 추출물은 각각 50 μg/mL 농도에서 68.85%와 57.01%로 우수한 억제 활성을 나타내었고, 최종당화산물 억제제로 알려진 aminoguanidine은 200 μg/mL 농도에서 90.62%의 억제 활성을 나타내었다.
본 실험에서 양성 대조군으로 사용된 aminoguanidine은 비효소적 당화 반응의 중간 생성물인 methylglyoxal 및 glyoxal과 같은 dicarbonyl 화합물과 반응하여 최종당화산물 생성을 억제하는 것으로 알려졌으나, 임상 시험에서 안전성 문제 및 부작용이 보고되어 사용이 중지되었다(Thronalley, 2003). 따라서, 안전하고 우수한 효능을 지닌 소재 개발을 위한 천연물 유래 성분의 기능성 연구가 필요하다. 천연물에 함유된 폴리페놀은 당화 과정에서 ROS 및 최종당화산물의 생성을 억제하는 것으로 알려져 있다(Yeh 등, 2017). 특히, Chao 등(2010)의 연구에서 엘라그산은 당뇨병 쥐의 신장에서 폴리올 경로(polyol pathway)의 활성을 억제하여 fructose 수치를 감소시킴으로써 최종당화산물 생성을 억제하였다. 또한, 과일 및 견과류 등에서 주로 발견되는 비타민 E는 자유 라디칼을 소거하여 단백질의 당화 반응을 방지함으로써 최종당화산물 생성을 억제하는 것으로 알려져 있다(Song 등, 2021). Fukuda 등(2003)에 의하면 호두는 엘라그산과 같은 폴리페놀 화합물이 풍부하며, 김천 1호 호두는 우수한 함량의 토코페롤을 함유하는 것으로 나타났다(Kim 등, 2020). 따라서, 호두 추출물이 갖는 최종당화산물 억제 활성은 엘라그산 및 토코페롤과 같은 천연 화합물에 의한 것으로 판단된다. 이후의 실험은 최종당화산물 생성 억제 활성과 더불어 가장 높은 α-amylase 및 α-glucosidase 억제 활성을 나타낸 80% 에탄올 추출물(GC)을 선별하여 진행하였다.
간세포 내에서 대사과정 중 발생하는 H2O2, 초과산화음이온(superoxide anion, O2−), 하이드록실 라디칼(hydroxyl radical, •OH) 등과 같은 ROS는 화학적 반응성이 높아 체내에서 산화 손상을 일으키며, 과도한 당 흡수로 인한 포도당의 자동산화 및 비효소적 당화 반응은 ROS 생성을 증가시켜 산화 스트레스를 유발하는 것으로 알려져 있다(Park 등, 2016). 특히, 간세포에서 과도한 ROS는 c-Jun N-terminal kinases(JNK) 및 p38 kinase(p38K)를 활성화하여, 염증 반응 및 세포 사멸을 유도하여 간 기능의 저하를 초래한다(Kim 등, 2006). 따라서, HepG2 세포에서 H2O2와 고당으로 유도된 산화 스트레스에 대한 GC의 보호 효과를 확인하기 위해 MTT 분석법을 이용하여 세포 생존율을 측정하였고 결과는 Fig. 2(A), (B)와 같다. H2O2와 고당으로 유도된 HepG2 세포에서 각각 정상 대조군(100%) 대비 89.72% 및 85.09%의 생존율을 나타내었고, 양성 대조군으로 vitamin C를 처리한 세포에서는 각각 107.33%, 89.53%의 생존율을 나타내었다. 특히, GC는 50 μg/mL 농도에서 각각 118.39%, 102.55%의 세포 생존율을 나타내 우수한 보호 효과를 확인하였다.
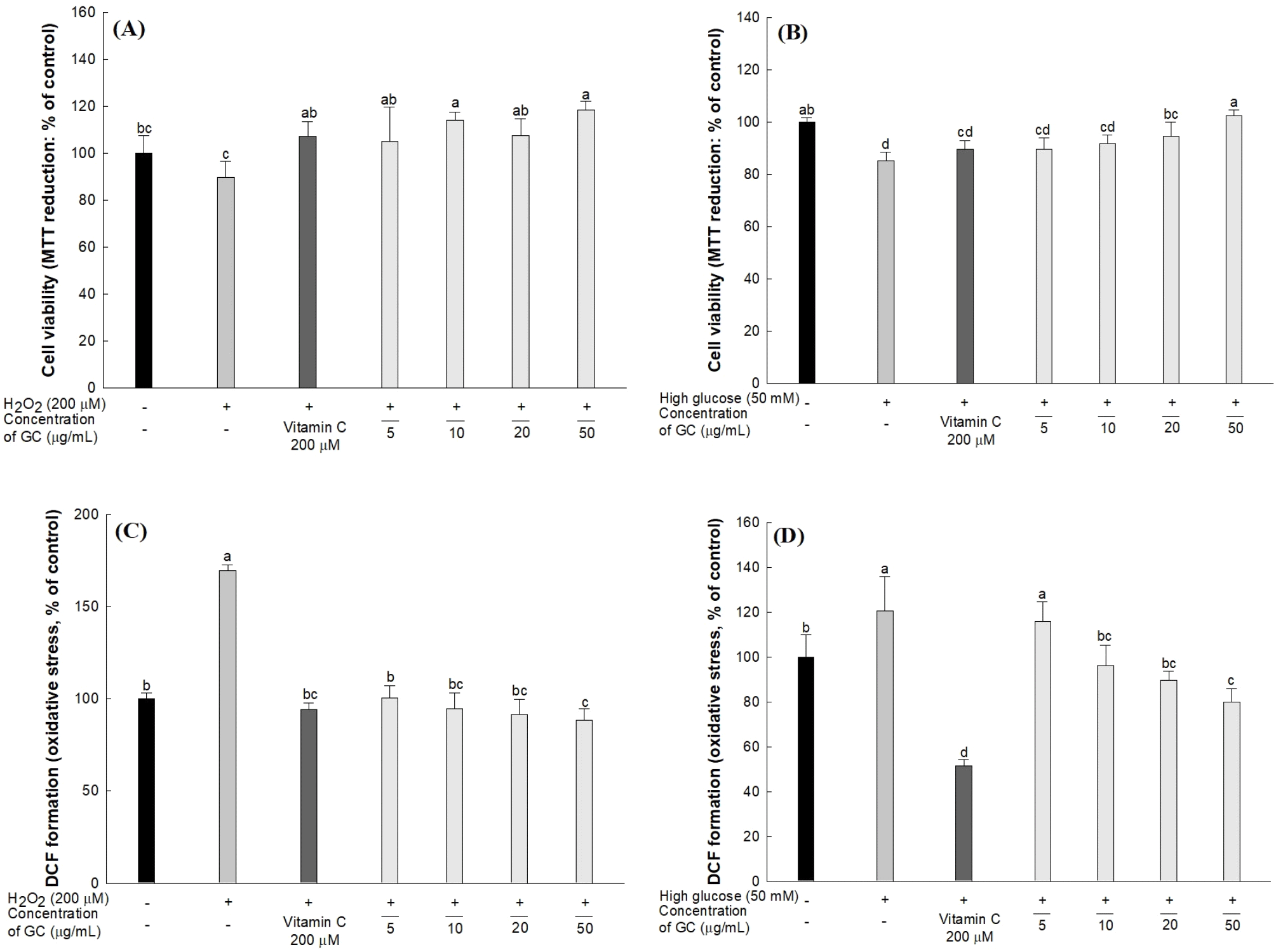
이어서 DCF-DA 분석법을 이용하여 HepG2 세포에서 H2O2와 고당으로 유도된 산화 스트레스에 의해 생성된 ROS에 대한 GC의 저해 활성을 측정한 결과는 Fig. 2(C), (D)와 같다. H2O2와 고당으로 유도된 HepG2 세포의 ROS 함량은 각각 169.43%, 120.63%로, 정상 대조군(100%)보다 약 69.43%, 20.62% 정도 ROS의 함량이 증가하였으나, 양성 대조군인 vitamin C를 처리하였을 때 각각 94.33%, 51.40%로 H2O2 및 고당 처리로 인해 증가한 ROS 함량을 감소시켰다. 특히, GC 처리는 50 μg/mL 농도에서 각각 88.41%, 79.94%로 우수한 ROS 저해 활성을 나타내었다.
식품에 존재하는 페놀성 화합물은 자유 라디칼을 소거하여 ROS를 제거함으로써 산화 스트레스로부터 세포를 보호하는 것으로 알려져 있다(Park 등, 2014). 특히, 김천 1호 호두는 엘라그산 및 토코페롤과 같은 페놀성 화합물이 풍부하며, 우수한 라디칼 소거 및 지질 과산화 억제 활성과 철 환원력을 갖는 것으로 보고되고 있다(Kim 등, 2020; Moon 등, 2020). Ding 등(2019)의 연구에서 엘라그산은 고당을 처리한 HepG2 세포에서 ROS 생성과 지질 과산화를 억제하였으며, α- 및 γ-토코페롤은 고지방식이 마우스의 간 조직에서, lipopolysaccharide(LPS)로 유도된 산화 스트레스로 인한 염증 반응을 억제함으로써 간 보호 효과를 나타내었다(Chung 등, 2010). 이러한 결과를 통해 GC는 엘라그산 및 토코페롤과 같은 페놀성 화합물의 항산화 활성에 의해 H2O2 및 고당으로 유도된 ROS가 제거되어 간세포 보호 효과를 나타낸 것으로 추측된다.
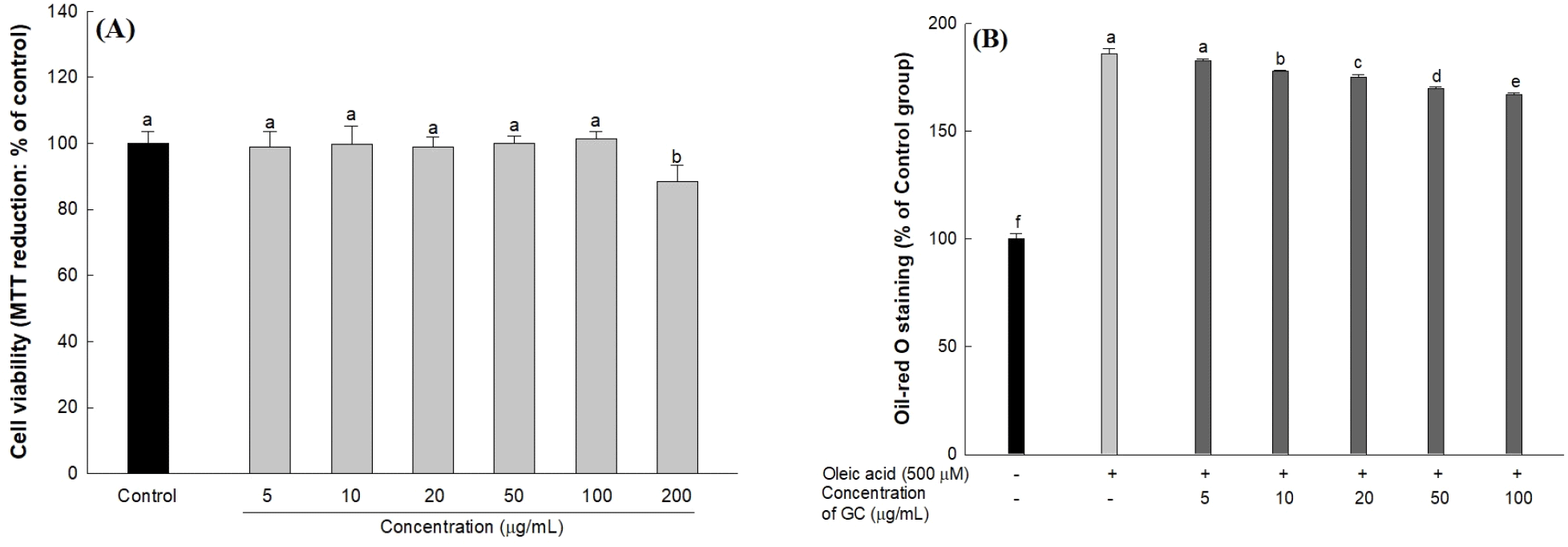
세포 내 에너지 항상성을 조절하는 AMP-activated protein kinase(AMPK)는 AMP/ATP 비율이 증가할 때 에너지 소비를 감소시키기 위해 catalytic subunit에 위치한 Thr172의 인산화를 통해 활성화된다(Viollet 등, 2010). p-AMPK는 에너지 항상성을 유지하기 위해 간세포에서 fatty acid synthase(FAS)의 전사 인자인 SREBP-1과, 콜레스테롤 합성에 관여하는 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase(HMGCR)의 전사 인자인 SREBP-2의 발현을 하향 조절하여 지방산과 콜레스테롤 합성을 억제하는 것으로 알려져 있다(Li 등, 2011). 하지만 간세포 내 과도한 oleic acid로 인해 생성되는 malonyl-CoA는, carnitine palmitoyl transferase-1(CPT-1)의 활성을 억제하여 지방산의 β-산화를 감소시키고 AMPK의 활성화를 억제하여 지방 생성과 관련된 효소들의 발현을 증가시킴으로써 간세포 내 지방축적을 유도한다(Lee 등, 2020). 따라서, oil red O 염색법을 이용하여 oleic acid로 지방축적이 유도된 HepG2 세포에서 호두 추출물의 지방축적 억제 효과를 평가하고, 지질 대사 관련 인자들의 발현을 측정하였다(Fig. 3). HepG2 세포에서 GC가 세포 독성에 영향을 미치는 최소 농도를 평가하기 위해 세포 생존율을 측정하였고(Fig. 3(A)), 세포 독성을 나타내지 않은 100 μg/mL 농도 이내에서 지방축적 억제 활성을 평가하였다. Oleic acid로 지방축적이 유도된 HepG2 세포는 정상 대조군(100%)과 비교하여 지방축적이 약 1.83배 증가하였고 GC는 100 μg/mL 농도에서 oleic acid를 처리한 그룹에 비해 약 10.21%의 지방축적 억제 효과를 나타냈으며, 처리 농도가 증가함에 따라 지방 세포 내 지방 함량 수준이 유의적으로 감소하였다(Fig. 3(B)). 또한, oleic acid를 처리하여 지방축적을 유도한 HepG2 세포를 oil red O로 염색하여 현미경을 통해 관찰한 이미지는 Fig. 3(C)에 표시하였고, 시료의 농도가 증가할수록 염색된 지방 세포의 수준이 감소하는 것을 확인하였다.
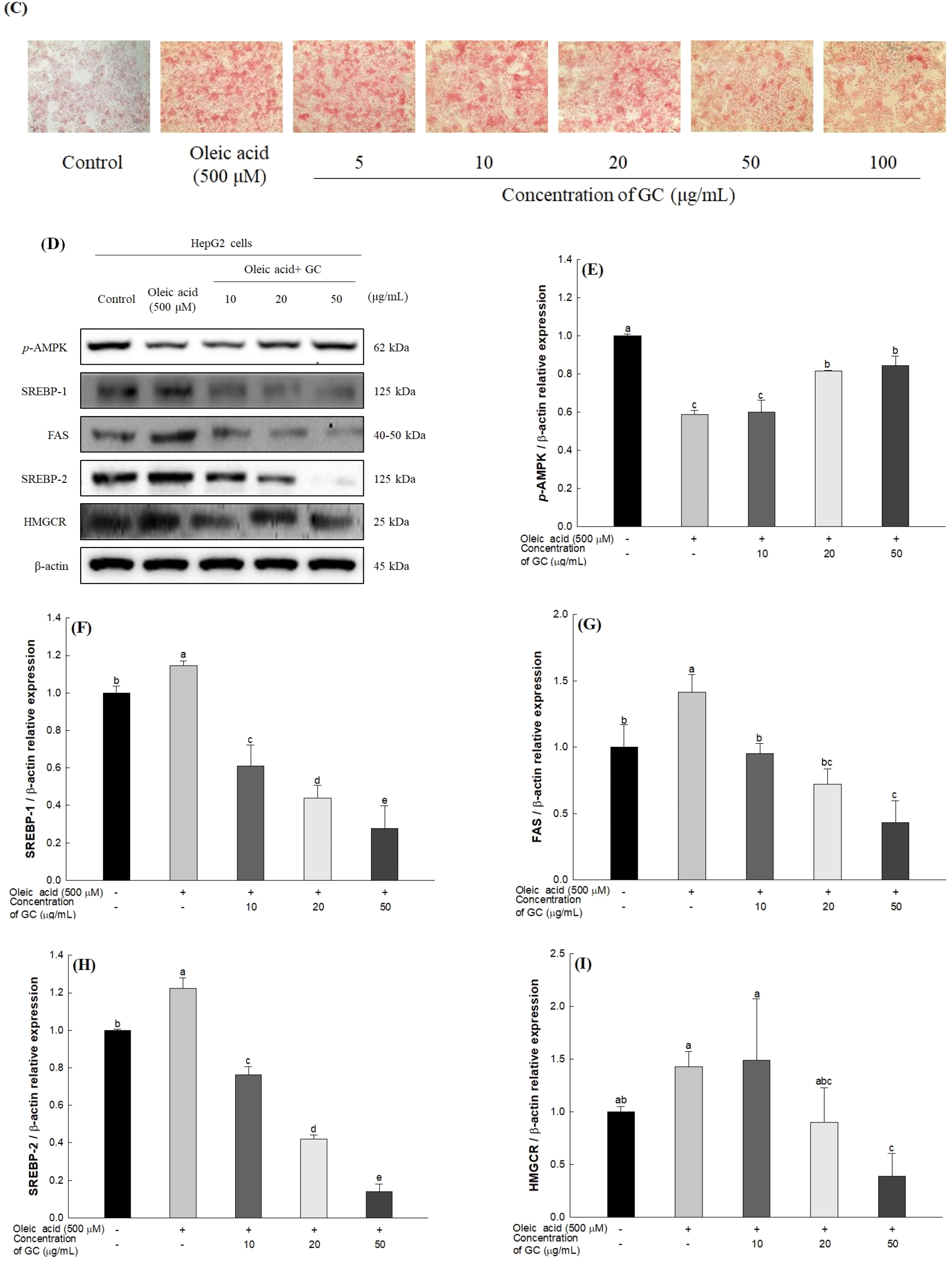
Oleic acid로 지방축적이 유도된 HepG2 세포에서 지질 대사 관련 인자들의 발현을 측정한 결과는 Fig. 3(D)와 같다. Oleic acid를 처리한 그룹에서 p-AMPK 발현은 정상 대조군(100%)과 비교하여 0.59배 감소하였고, SREBP-1, FAS, SREBP-2, HMGCR 발현은 각각 1.15, 1.42, 1.22, 1.43배 증가하였다. 반면, GC 처리는 oleic acid를 처리한 그룹과 비교하여 50 μg/mL 농도에서 oleic acid 처리로 인해 감소한 p-AMPK 발현을 1.44배 증가시켰다. 또한, SREBP-1, FAS, SREBP-2, HMGCR 발현은 50 μg/mL 농도의 GC를 처리하였을 때 oleic acid를 처리한 그룹과 비교하여 각각 0.24, 0.30, 0.12, 0.27배 감소하였다.
본 실험에 사용된 김천 1호 호두는 엘라그산 및 엘라그산 유도물질과 다양한 PUFA를 풍부하게 함유하고 있다(Kim 등, 2020; Moon 등, 2020). 특히, 엘라그산은 당뇨병 쥐의 간 조직에서 AMPK를 활성화하여 SREBP-1, FAS, SREBP-2, HMGCR의 발현을 하향 조절함으로써 지방 생성을 억제하였다(ALTamimi 등, 2022). 또한, Sun 등(2020)에 의하면 호두에서 유래한 PUFA는 당뇨병 쥐의 간 조직에서 SREBP-1 및 FAS 발현을 억제함으로써 간 및 혈장 triglyceride 수치를 감소시켰으며, Yang 등(2014)은 3T3-L1 세포에서 호두 껍질 추출물이 지방 세포 분화 및 지방 생성을 억제하는 것으로 보고하였다. 마찬가지로 GC는 oleic acid로 지방축적이 유도된 HepG2 세포에서 AMPK를 활성화하여, 지방 생성 및 콜레스테롤 합성과 관련된 인자들의 발현을 하향 조절함으로써 지방축적을 억제하였다. 이러한 결과는 GC에 함유된 엘라그산 및 PUFA에 의해 AMPK가 활성화되어 비정상적인 지질 대사가 개선된 것으로 추측된다. 따라서, GC는 비정상적인 지질 대사를 개선함으로써 비알코올성 지방간 질환 개선에 도움을 주는 소재로써 이용 가능할 것으로 판단된다.
