Article
Inulin 분해효모 Wickerhamomyces anomalus JS01과 Saccharomyces cerevisiae KMBL7001의 혼합발효에 의한 돼지감자(Helianthus tuberosus L.)를 첨가한 약주의 발효 특성
최준수
1
, 최규택
1
, 김찬우
1
, 이새벽
1,2,*
, 박희동
1,2,*
Fermentation characteristics of yakju supplemented with Jerusalem artichoke (Helianthus tuberosus L.) and co-fermented by inulin-degrading yeast Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001
Jun-Su Choi
1
, Kyu-Taek Choi
1
, Chan-Woo Kim
1
, Sae-Byuk Lee
1,2,*
, Heui-Dong Park
1,2,*
1School of Food Science and Biotechnology, Kyungpook National University, Daegu 41566, Korea
2Institute of Fermentation Biotechnology, Kyungpook National University, Daegu 41566, Korea
Citation: Choi JS, Choi KT, Kim CW, Lee SB, Park HD. Fermentation characteristics of yakju supplemented with Jerusalem artichoke (Helianthus tuberosus L.) and co-fermented by inulin-degrading yeast Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001. Korean J Food Preserv, 29(5), 800-812 (2022)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: May 11, 2022; Revised: Jun 16, 2022; Accepted: Jul 01, 2022
Published Online: Aug 31, 2022
4. 요약
본 연구에서는 누룩에서 분리된 inulinase 효소활성이 우수한 non-Saccharomyces 균주와 탁·약주 발효력이 뛰어난 S. cerevisiae를 이용하여 돼지감자 혼합발효 약주를 제조한 후, 발효 특성과 이화학적 주질 특성을 알아보았다. 최종 선발된 W. anomalus JS01 균주의 inulinase 효소활성은 72시간 배양 시, 538.14 Unit/mL로 측정되었다. 선발된 균주를 이용하여 돼지감자 약주 제조 시 8일차에, pH는 대조구 3.57, 혼합발효 3.37로 확인되었으며, 생균수는 S. cerevisiae KMBL7001의 경우, 단독 및 혼합발효에서 각각 8.26 log CFU/mL, 8.29 log CFU/mL로 확인되었으나, 혼합발효구에서 W. anomalus JS01은 관찰되지 않았다. 또한, 발효 종료 시점에 환원당 함량은 0.27-0.29%, 알코올 함량은 14.8-15%로 대조구와 유사하게 측정되었다. 유리당의 경우, 혼합발효구에서 inulin은 대조구 대비 약 45% 정도 잔존하였으며, sorbitol은 단독발효구에서 더 높은 함량을 보였다. 유기산의 함량은 두 시료구 모두에서 citric acid > lactic acid > succinic acid > malic acid > acetic acid 순으로 나타났으며, acetic acid 외의 시료 간의 유의적인 차이는 없었으나 대조구 대비, 혼합발효구에서 acetic acid를 제외한 유기산 4종에 대해 다소 높은 함량을 보였다. 아미노산 함량에서는 혼합발효구가 대조구보다 전반적으로 높거나 유사하였다. 관능평가는 샘플들 간의 유의한 차이는 없었으나 모든 분석항목 혼합발효구의 기호도가 높게 평가되었다. 따라서 돼지감자가 inulin과 fructooligosaccharide와 같은 기능성 물질을 다량 함유하고 있음을 고려할 때, 돼지감자 첨가 약주 제조 시 S. cerevisiae KMBL7001과 inulin 분해 효모 W. anomalus JS01을 혼합발효하는 것이 돼지감자의 기능성 성분을 활용한 고품질 기능성 약주를 제조하는 데 도움을 줄 수 있을 것으로 사료된다.
Abstract
Jerusalem artichoke (JA, Helianthus tuberosus L.) is a promising functional food material. JA consists of inulin and fructo-oligosaccharide which are indigestible carbohydrates in human. Previous research has develop various food products supplemented with JA, however no studies have involved yakju (Korean traditional rice wine) using JA because Saccharomyces cerevisiae cannot utilize inulin. We isolated several inulin-degrading non-Saccharomyces yeasts using nuruk (a traditional Korean fermentation starter). The isolate with the highest inulinase activity was Wickerhamomyces anomalus JS01 with 538.14 Unit/mL after 72 hours of incubation. To identify whether the inulin-degrading non-Saccharomyces yeast could improve yakju quality, W. anomalus JS01 and S. cerevisiae KMBL7001 were co-fermented to produce yakju supplemented with JA. We investigated the fermentation characteristics. At the completion of the fermentation process, the yakju co-fermented with W. anomalus JS01 and S. cerevisiae KMBL7001 (co-fermented yakju) had similar fermentation characteristics including pH, reducing sugar, alcohol, and organic acid contents compared to yakju fermented with S. cerevisiae KMBL7001 (control yakju). Moreover, co-fermented yakju had higher total amino acid contents compared with the control yakju. The W. anomalus JS01 digested some inulin into fructose which was fermented. Conversely, the control wine did not ferment any inulin during fermentation. As a result of the sensory evaluation, the co-fermented yakju obtained higher scores in all the sensory categories, suggesting that supplementing with JA and utilizing inulin-degrading yeast could improve yakju quality.
Keywords: yakju; Jerusalem artichoke; co-fermentation; Wickerhamomyces anomalus JS01; Saccharomyces cerevisiae KMBL7001
1. 서론
오늘날 현대인의 식습관이 고열량 식단으로 변화됨에 따라, 영양의 역할이 신체의 성장 및 발달과 생명유지라는 기본적인 역할 외에 건강 유지 및 질병 예방과 같은 부가적인 측면까지 확대되고 있다(Shin 등, 2012). 성인병과 같은 비전염성 질병은 신경계, 대사 및 퇴행성 장애의 주요 원인으로 증가하여 전 세계적으로 고려해야 할 문제로 대두되고 있으며, 이에 프리바이오틱스(prebiotics)를 이용한 저열량 식이에 대한 연구가 활발히 진행되고 있다(Cunningham 등, 2021). 난소화성 식이섬유인 이눌린(inulin)은 인체 내에 흡수되지 않아 칼로리가 낮으며 과당 중합체이기 때문에 단맛을 내는 감미료로 쓰일 수 있어, 저열량 식이요법에 충족하는 물질이다(Shin 등, 2012). 기능성 올리고당 중의 하나인 프락토올리고당(fructooligosaccharides, FOS)은 산업적으로 이눌린을 효소로 가수분해하거나 설탕을 녹인 당액에 전이효소(β-fructofuranosidase)를 사용하여 제조하며, GF2 (1-kestose), GF3(nystose), GF4(fructofuranosylnystose) 등은 유익균 증식 및 유해균 억제, 배변활동 개선, 칼슘 흡수에 도움이 되는 기능성분이다(Costa 등, 2015; Ibrahim, 2018).
돼지감자(Helianthus tuberosus L.)는 북아메리카가 원산지인 국화과 해바라기속 다년생 식물로서, 뚱딴지, 국화감자 또는 생약명으로 국우라고 한다(Park 등, 2013). 또한, 한국의 기후 조건에 잘 맞아서 한국 전 지역에 자생하고 있으며, 서리와 병충해에 대한 저항성이 강하고 토질에 관계없이 야생에서 잘 자라기 때문에 전 세계적으로 널리 재배되고 있다(Lee, 2016; Slimestad 등, 2010). 돼지감자에 다량 함유되어 있는 이눌린은 전분과 유사한 다당류이며, β-2, 1 결합으로 연결된 D-fructose 단위의 중합체로, 말단기에 하나의 D-glucose가 fructose 사슬에 연결되어 있는 구조이다(Kalyani Nair 등, 2010). 이눌린은 인간의 위에서 소화되지 않고 대장으로 들어가 장내 미생물 균총에 의하여 발효되므로 혈당의 수치와 인슐린(insulin)의 분비 자극에 영향을 미치지 않으며, 대변의 빈도 및 양을 증가시켜 장기능을 개선시킨다(Kalyani Nair 등, 2010). 또한, 이눌린이 풍부한 돼지감자는 민간요법으로 당뇨병 및 류머티즘 치료에 많이 사용되고, 여러 가지 기능성 물질들이 존재하므로 암 예방 등의 건강 증진에도 효과가 있다(Shao 등, 2020; Yuan 등, 2012). 하지만, 돼지감자는 수분함량이 높고 쉽게 변질되는 특성 때문에 장기간 보관하기가 힘들고, 독특한 향과 아린 맛을 가지므로 생과로 돼지감자를 먹기보다는 가공용으로 개발할 필요가 있다(Jung과 Shin, 2016; Kim과 Hwang, 2021). 현재까지 돼지감자를 가공용 식품 제조에 적용한 연구로는 돼지감자 식혜(Kim과 Hwang, 2021), 돼지감자 차(Hwang, 2019), 돼지감자 설기떡(Hwang, 2021), 돼지감자 첨가 발효유(Park 등, 2019), 돼지감자 분말 첨가 묵(Kim 등, 2015) 등이 있으며, 항산화, 항당뇨 등 기능성 식품소재로서 다양한 가능성이 보고되고 있으나, 돼지감자를 탁·약주 제조에 활용한 연구는 이루어지지 않은 실정이다. 따라서, 돼지감자의 주요한 고분자 당인 이눌린을 주류 발효의 소재로 이용하여 약주 제조에서 기능성 물질로서의 가능성 및 특성을 확인할 필요가 있다.
일반적으로 한국의 전통주 발효에 많이 이용되고 있는 탁·약주 효모는 Saccharomyces cerevisiae로, 에탄올 생성능이 높고 생존력이 강하다는 특징이 있다(Choi 등, 2018). 하지만 S. cerevisiae의 경우, 이눌린 분해력이 없기 때문에 직접 돼지감자를 알코올 발효에 이용하기는 어려운 점이 있다(Kurtzman과 Fell, 1998). 이것을 해결하기 위해, 이눌린 분해효소인 inulinase에 의해 다양한 분자 단위의 과당을 생성한다면 미생물은 이를 이용하여 에탄올을 생성할 수 있을 것이다(Kumar 등, 2018). Inulinase는 이눌린의 β-2, 1 결합을 표적으로 하는 프룩토푸라노실(fructofuranosyl) 가수분해효소로서, 사람의 소화액에 존재하지 않지만 광범위한 미생물에 의해 생성될 수 있으므로 inulinase 생산이 가능한 non-Saccharomyces 효모와 알코올 생성효모와의 혼합발효를 통해, 돼지감자의 이눌린 사용과 알코올 발효를 동시에 가능하게 할 수 있다(Kango와 Jain, 2011; Liu 등, 2013). 또한, 이러한 non-Saccharomyces 균주와 S. cerevisiae의 혼합발효는 향미성분의 증진을 도모하여 약주 제조 시 관능적으로 긍정적인 영향을 줄 수 있다(Park 등, 2021). 따라서, 본 연구에서는 누룩에서 inulinase 효소활성이 우수한 균주를 분리 후 선별하여 선발된 non-Saccharomyces 균주와 탁·약주에서 알코올 발효력이 뛰어난 S. cerevisiae를 이용하여 돼지감자를 첨가한 혼합발효 약주를 제조하였다. 이를 통해, 이눌린과 프락토올리고당 등 기능성 물질들을 함유하는 고품질의 약주를 만들고자 하였으며, pH, 생균수, 환원당, 알코올 등 발효 특성 변화와 유리당, 유기산, 아미노산 등 이화학적 주질 특성을 조사하여 돼지감자 첨가 약주의 상품화 가능성을 알아보고자 하였다.
2. 재료 및 방법
2.1. 균주의 선별 및 분리
Inulinase 생성 효모의 선택배지는 0.17% YNB(yeast nitrogen base) without amino acid and ammonium sulfate(Difco, Becton, Dickinson and Company, MD, USA)에 0.2% ammonium sulfate(Duksan, Ansan, Korea)와 유일 탄소원으로 1.0% inulin(Wako Chemicals, Osaka, Japan)을 첨가한 YNB(YNB-1.0% inulin) 배지를 사용하였다. Inulinase를 생산하는 효모의 분리를 위한 시료는 300 sp(당화력 Saccharogenic power, SP) 이상의 당화력을 가진 개량누룩(Soyulgok, Songhak Gokja, Kwangju, Korea)을 사용하였다. 구체적으로는 개량누룩을 막자사발로 마쇄한 후 YNB-1.0% inulin 액체배지에 5%(w/v) 농도로 현탁하고 30°C, 150 rpm에서 하룻밤 동안 배양한 다음, 그 배양액을 멸균 식염수로 적절하게 희석 후 YNB-1.0% inulin 고체배지에 도말하여 30°C, 5일간 배양한 후, 집락을 형성하는 균주를 선별 분리하였다. 분리한 균주를 대상으로 inulinase 효소활성을 조사하여, 활성이 가장 우수한 균주를 돼지감자 첨가 혼합발효 약주제조용 균주로 최종선발하였다.
2.2. Inulinase 효소 활성 측정
액체배지(1.7% YNB w/o amino acid & ammonium sulfate, 1% yeast extract, 1% inulin)에 1차 선별 분리한 효모 집락(colony)을 1백금이(loop) 접종하여 150 rpm, 72시간 동안 배양하면서, 분광광도계(UV-1601, Shimazu, Kyoto, Japan)로 효모의 생육도를 600 nm에서 측정하였다. Inulinase 효소활성의 측정은 상기 배양액을 원심분리(9,447 ×g, 10 min)한 후, 상등액을 취하여 이를 조효소액으로 하고, 효소액 0.4 mL에 기질액(5% inulin/100 mM acetate buffer, pH 5.0) 0.1 mL를 넣고 50°C, 30분 반응시킨 후 100°C, 10분간 열처리하여 반응을 멈춘 다음, DNS(3,5-dinitrosalicylic acid)법으로 생성된 환원당을 정량하였다(Ahmed, 2004). Inulinase 1 unit은 사용된 조건 분석하에서 fructose 1 μg을 생성하는 효소의 양으로 환산하였다(Hu 등, 2012).
2.3. 분리 효모의 동정
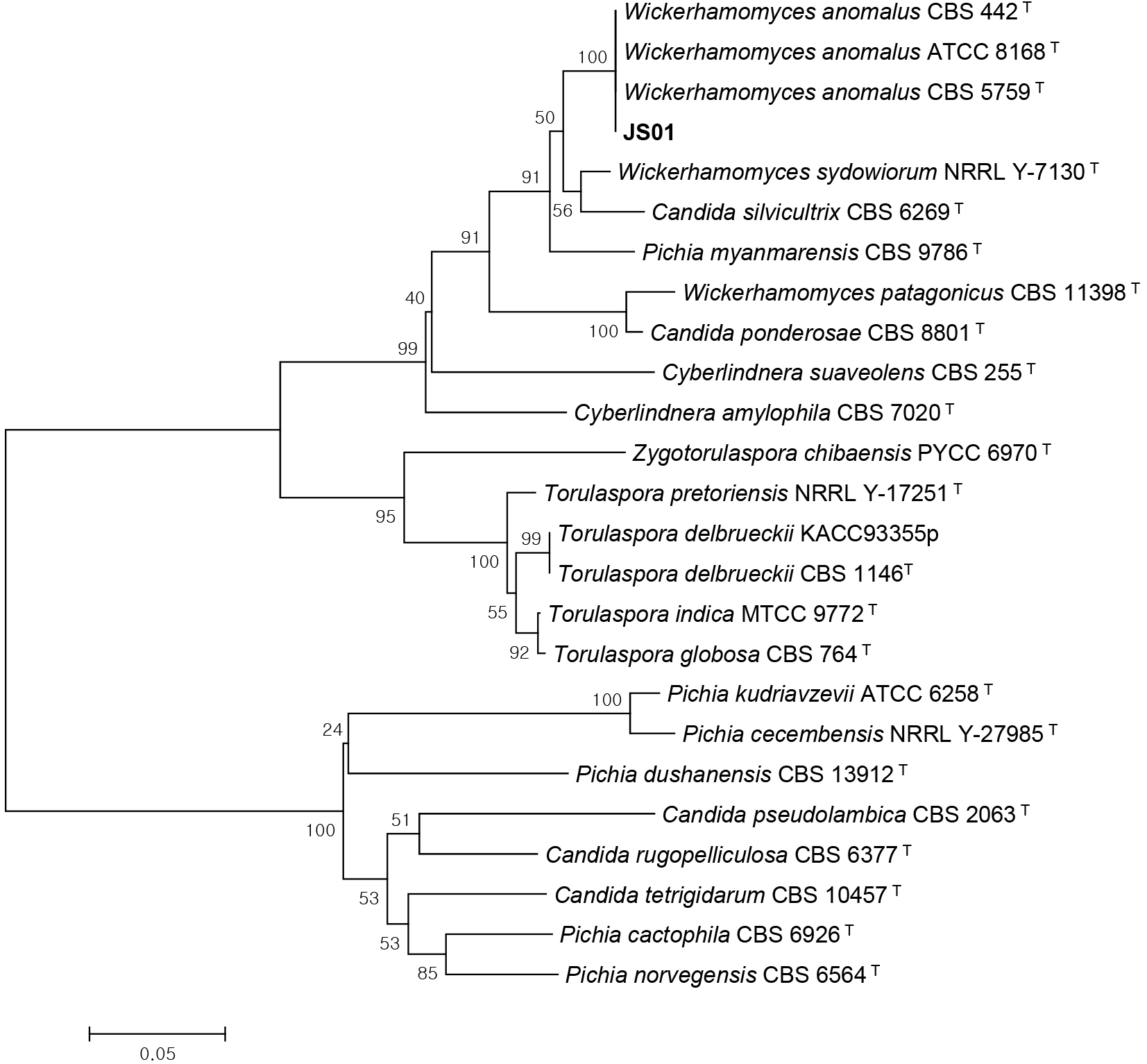
분리균주의 ITS 영역을 증폭하기 위하여 효모의 rDNA sequence를 기초로 하여 ITS1(5'-TCCGTAGGTGAACC TGCGG-3')과 ITS4(5'-TCCTCCGCTTATTGATATGC-3')를 primer로 사용하였다. ITS I-5.8S rDNA-ITS II 영역의 뉴클레오티드 서열을 기초로 분리된 균주의 동정은 염기서열분석(Solgent Co., Ltd., Daejeon, Korea)을 이용하였으며, 균주의 ITS 영역 DNA 염기서열의 상동성 검사는 GenBank의 database에 등록된 정보를 대상으로 DDB/NCBI/Gene Bank database의 BLAST program을 이용하여 비교하였다. 각 염기서열의 상동성은 BioEdit(version 7.2)를 사용하여 병렬로 정렬 및 편집하였고, 계통수(phylogenetic tree)는 MEGA6(molecular evolutionary genetics analysis version 6) 프로그램을 이용하여 Kimura two-parameter model과 neighbor-joining method에 의거하여 작성하였다(Tamura 등, 2013).
2.4. 돼지감자 첨가 약주의 실험재료 및 사용 균주
약주 제조를 위해 사용된 쌀은 2019년에 생산된 백진주 품종(Hwaseong, Korea)을 구입하여 사용하였다. 입국은 ㈜조은곡식(Choeun-Goksik Co., Ltd., Hwaseong, Korea)에서 생산된 쌀입국(Aspergillus luchuensis, sp 60)을 사용하였고, 양조 용수는 시판 생수(Samjung Water Co., Ltd., Ulsan, Korea)를 구입하여 사용하였다. 본 연구에 사용한 효모는 상기 실험에서 선발된 inulin 분해효모 Wickerhamomyces anomalus JS01(KACC 93354p)과 약·탁주용으로 발효력이 우수한 Saccharomyces cerevisiae KMBL7001(KACC 93363p)을 이용하였다. 돼지감자는 2018년 3월 경북 김천시 구성면의 재배 농가에서 생산한 것을 구입하여 이용하였으며 돼지감자를 동결건조로 분말화하여 약주 제조에 사용하였다. 돼지감자 100 kg에 증류수 500 L를 가하여 파쇄한 다음 여과하여 고형물을 제거하고 얻은 돼지감자 슬러리를 -70°C에서 급속 동결한 다음 소규모 산업용 동결건조기(Industrial Vacuum Freeze Dryer, SFDTS10K, Samwon ENG, Incheon, Korea)로 동결건조하여 건조분말을 제조하였다.
2.5. 돼지감자 첨가 혼합발효 약주의 제조
약주 제조 시 균주의 혼합 발효 특성을 알아보기 위하여 6 L의 발효조에 입국 600 g과 물 1 L를 첨가하고 각각 미리 배양한 S. cerevisiae KMBL7001과 W. anomalus JS01을 1:1로 하여 총원료 대비 5%(w/w)를 동시에 접종하였으며, 2일 뒤 2단 담금으로 증자한 고두밥 1,020 g, 돼지감자분말 180 g, 물 1.8 L를 첨가하여 20°C에서 발효를 진행하였으며, 알코올 발효가 최대치에 달하여 변화가 관찰되지 않을 때 발효를 종료하였다(Park 등, 2021). 대조구인 S. cerevisiae 단독발효구의 경우, 효모 S. cerevisiae KMBL7001을 총원료 대비 5%(w/w)를 접종한 것을 제외하고, 상기 혼합발효 약주 제조와 동일하게 진행하였다. 발효가 종료된 술덧은 4°C, 4,973 ×g로 10분간 원심분리(Supra 22K, Hanil Science Industrial Co., Seoul, Korea)한 후 얻은 상등액을 filter paper(No.2, Advantec Co. Ltd., Tokyo, Japan)로 여과하여 약주로 사용하였다.
2.6. 돼지감자 첨가 혼합발효 약주의 발효 특성 분석
돼지감자 첨가 혼합발효 약주의 발효 특성 분석은 발효 중인 약주를 4°C, 4,973 ×g로 10분간 원심분리(Supra 22K, Hanil Science Industrial Co.)한 후 얻은 상등액을 시료로 사용하였다. pH는 pH meter(SevenEasy S20, Mettler Toledo, OH, USA)를 이용하여 측정하였다.
생균수 측정은 원심분리하지 않은 약주 술덧 시료를 멸균 초순수로 적절히 희석하여 YPD(1% yeast extract, 2% peptone, and 2% glucose) 고체배지에 도말한 다음 30°C에서 2일간 배양하여 형성된 효모의 집락(colony)을 계수하여 colony forming unit(CFU/mL)으로 나타내었다. 집락수 계산은 확산집락이 없고 1개 평판당 15-300개의 집락을 생성한 평판을 택하여 집락수를 계산하는 것을 원칙으로 하였다. 환원당 함량은 3,5-dinitrosalicylic acid(DNS)법을 변용하여 비색 정량법에 따라 측정하였다(Ahmed, 2004). 즉, 시료 0.3 mL에 DNS 시약 1 mL를 첨가하여 95°C에서 5분간 중탕한 다음 실온에서 방랭 후 증류수로 7 mL가 되도록 정용한 다음, 분광광도계(UV-1601, Shimazu)를 이용하여 550 nm에서 흡광도를 측정하였으며, 상기 방법을 이용하여 포도당(glucose)을 표준물질로 사용하여 작성한 표준곡선으로부터 환원당 함량을 환산하였다. 알코올 함량은 국세청 주류분석 규정을 이용하여 분석하였다(National Tax Service Liquors License Support Center, 2014). 원심분리한 시료를 15°C에서 검정한 후 100 mL 메스플라스크에 취하여 증류 플라스크로 옮기고 15 mL의 증류수로 2회 세척한 후 세척액과 합친 다음 메스플라스크를 받는 용기로 한 뒤 증류하여 70 mL가 되면 증류를 중지하였다. 여기에 증류수를 첨가해 100 mL 획선까지 채운 후 잘 혼합하여 균일하게 하고, 주정계(Dongmyeong, Seoul, Korea)로 알코올 농도를 측정하여 Gay-Lussac의 주정 환산표를 이용하여 15°C로 보정하여 알코올 함량을 측정하였다.
2.7. 돼지감자 첨가 혼합발효 약주의 주질의 특성 분석
돼지감자 첨가 혼합발효 약주의 주질 특성 분석은 20°C에서 8일간 발효 후, 발효가 종료된 술덧 약주의 일부를 취하여 4°C, 4,973 ×g로 10분간 원심분리(Supra 22K, Hanil Science Industrial Co.)한 후 얻은 상등액을 시료로 이용하였다. 유리당 및 유기산 함량은 고성능 액체 크로마토그래피(HPLC, 600E, Waters Co., Milford, MA, USA)를 사용하여 분석하였다(Table 1). 유리당과 유기산 표준용액을 조제 후 분석한 peak area로 작성한 검량선으로 함량을 정량하였다(Lee, 2019). 아미노산은 6 N HCl을 가하여 질소 감압하에서 110°C, 24시간 동안 가수분해된 시료 가수분해물을 amino acid autoanalyzer(Hitachi, L-8900 Model, Tokyo, Japan)로 분석하였다. 분석 결과물은 18종의 아미노산 표준품의 retention time과 비교하고, 함량은 peak의 면적으로 환산하였다(Weng, 2014).
Table 1.
Condition of HPLC for analyzing free sugar and organic acid contents
|
Parameters |
Condition |
|
Free sugar |
Organic acid |
|
Instrument |
HPLC (HPLC 600E, Waters Co., Milford, MA, USA) |
HPLC (HPLC 600E, Waters Co., Milford, MA, USA) |
|
Column |
Sugar-Pak I column (6.5×300 mm, Waters, Milford, MA, USA) |
PL Hi-Plex H column (7.7×300 mm, Agilent Technologies, Santa Clara, CA, USA) |
|
Flow rates |
0.5 mL/min |
0.6 mL/min |
|
Column oven |
90°C |
65°C |
|
Mobile phase |
0.001 M Ca-ethylenediaminetetraacetic acid (Ca-EDTA, Sigma Chemical Co., St. Louis, MO, USA) buffer |
0.005 M sulfuric acid (Duksan, Ansan, Korea) |
Download Excel Table
2.8. 관능검사
약주의 관능검사는 약·탁주에 관한 강의를 수강하고 관능검사에 대한 교육을 받은 경북대학교 식품공학부 대학원생 16명을 대상으로 평가 기준 및 목적을 숙지시킨 후 이중맹검사법(double blind test)으로 수행하였다. 본 관능검사는 색, 향, 단맛, 신맛 및 종합적 기호도를 항목으로 하였으며 7점 척도법으로 진행하였다. 본 실험의 관능검사는 경북대학교 생명윤리심의위원회(Institutional Review Board, IRB)의 심의 후 승인번호(2020-0075)를 받아 진행하였다.
2.9. 통계처리
모든 데이터는 3회 이상 반복 실험을 진행한 후, 결과값을 평균±표준편차로 표시하였다. 통계분석프로그램으로 SAS program(9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 student t-test, 분산분석(ANOVA), Duncan의 다중범위검증(Duncan’s multiple range test)을 수행하여 유의성을 검증하였다(p⟨0.05).
3. 결과 및 고찰
3.1. Inulinase 생산 효모의 분리 및 동정
Inulinase 생산 효모의 선별을 위하여 누룩 배양액을 YNB-1.0% inulin 고체배지에 도말하여 30°C, 5일간 배양 후, 9종의 균주를 1차 분리하였다. 분리균주 중 효소활성이 우수한 균주를 선정하기 위해 inulinase 효소활성 측정용 액체배지(1.7% YNB w/o amino acid & ammonium sulfate, 1% yeast extract, 1% inulin)에 접종한 후 30°C, 150 rpm, 72시간 배양하면서 생육도 및 효소활성을 측정하였다(Table 2). 9종의 분리 균주 중 4종이 효소활성에서 두드러진 차이를 보였다. 분리 균주의 생육도와 효소활성이 비례하지는 않았으며, inulinase 효소활성은 72시간 배양 시, JS01, JS02, JS03, JS09에서 각각 538.14, 512.15, 245.83, 484.52 Unit/mL로 측정되었다. 효소활성이 가장 높은 JS01은 W. anomalus CBS 442 표준균주와 100%의 상동성을 보였다(Fig. 1). 따라서, 본 연구에서는 inulinase 효소활성이 가장 높게 측정된 W. anomalus JS01(KACC 93354p)과 약·탁주용으로 발효력이 우수한 S. cerevisiae KMBL7001(KACC 93363p)을 돼지감자 약주 발효에 이용하였다.
Table 2.
Changes in the cell growth and inulinase activity of various isolated yeasts in the YNB-inulin medium
|
Isolated yeast |
Cell growth (OD 600) |
Enzyme activity (Unit1)/mL) |
|
0 h |
72 h |
0 h |
72 h |
|
JS01 |
0.38±0.082)C3)b4)
|
13.50±0.00Aa
|
|
38.71±2.27Bb
|
538.14±0.25Aa
|
|
JS02 |
0.26±0.09BCb
|
9.92±0.06Ba
|
|
51.88±5.14Ab
|
512.15±3.20Ba
|
|
JS03 |
0.15±0.12Cb
|
8.97±0.07Da
|
|
38.71±1.28Bb
|
245.83±5.70Da
|
|
JS04 |
0.15±0.08Cb
|
7.95±0.33Fa
|
|
38.26±0.64Bb
|
72.31±3.85Fa
|
|
JS05 |
0.16±0.02Cb
|
8.37±0.17Ea
|
|
33.72±0.84Ba
|
36.44±3.90Ha
|
|
JS06 |
0.12±0.04Cb
|
2.74±0.14Ia
|
|
24.80±3.21Cb
|
37.35±1.65Ha
|
|
JS07 |
0.39±0.16Bb
|
5.76±0.18Ga
|
|
33.26±5.78Bb
|
101.82±9.63Ea
|
|
JS08 |
0.23±0.00BCb
|
4.52±0.16Ha
|
|
25.09±2.57Cb
|
55.51±1.20Ga
|
|
JS09 |
0.57±0.05Ab
|
9.44±0.12Ca
|
|
33.26±0.54Bb
|
484.54±5.28Ca
|
Download Excel Table
Fig. 1.
Phylogenetic tree based on the ITSI-5.8S-ITSII sequence of Wickerhamomyces anomalus JS01.
Download Original Figure
3.2. 돼지감자 첨가 혼합발효 약주의 발효 특성
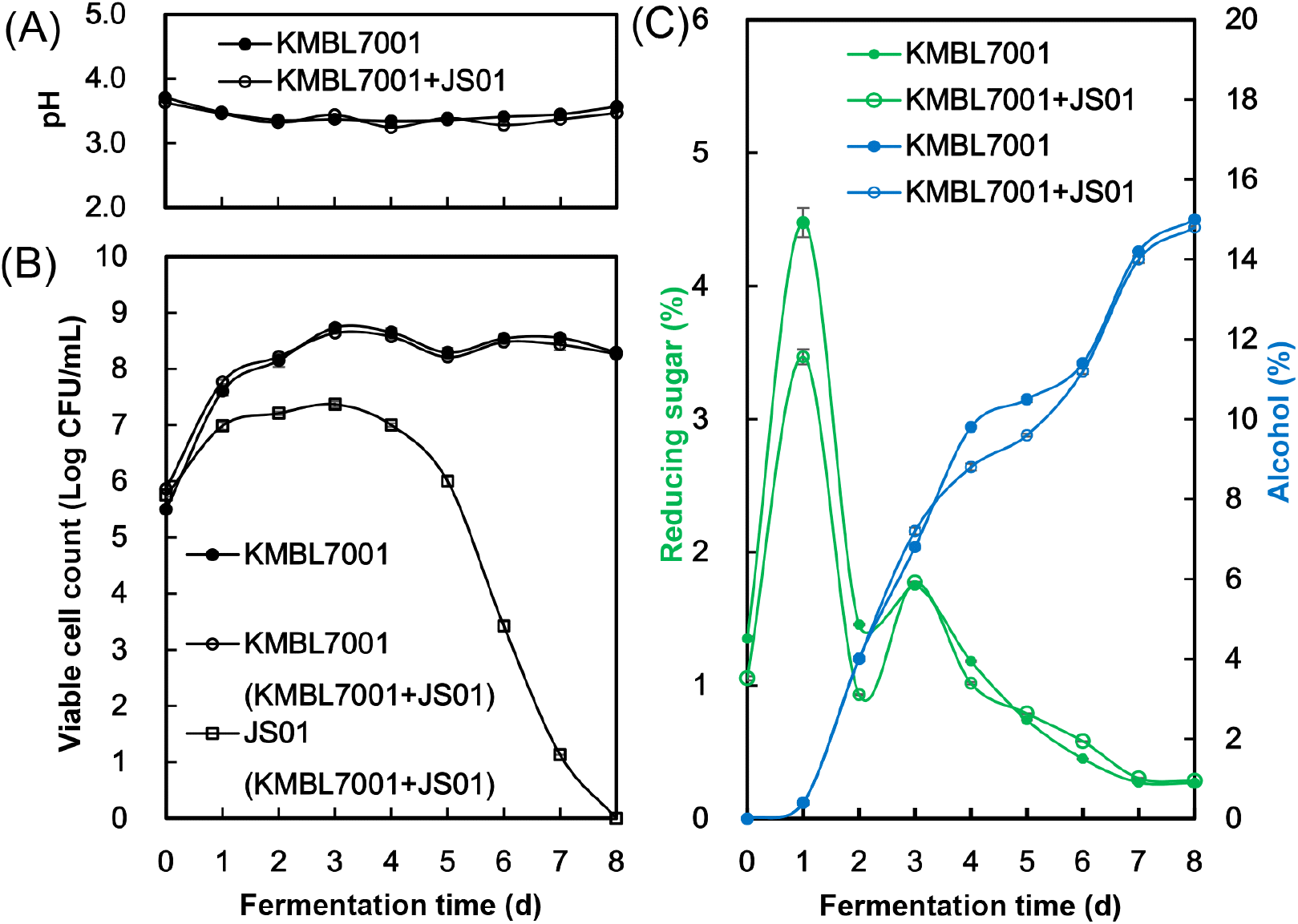
효모의 혼합발효에 따른 돼지감자 약주 발효 시 pH, 생균수, 환원당, 알코올의 변화는 Fig. 2와 같다.
Fig. 2.
Profiles of the pH (A), viable cell count (B), reducing sugar and alcohol (C) during the fermentation of yakju supplemented with Jerusalem artichoke co-fermented by Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001.
Download Original Figure
3.2.1. pH
pH는 발효 0일차 3.63-3.71에서 백국균의 활성으로 인해 발효 1일차에는 3.46-3.48, 발효 2일차에 3.32-3.36까지 감소하고, 2단 담금 시기인 3일차에 3.37-3.44로 다소 증가하였으며, 종료시점인 8일차에 대조구 3.57, 혼합발효 3.37로 확인되었다. 특히, 발효 8일차까지 단독발효 대조구과 유사한 pH를 나타내었으나, 발효 종료 시 혼합발효의 pH가 대조구보다 낮게 나타났다(Fig. 2(A)). 효모의 알코올 발효는 산성 또는 미산성인 경우에 알코올 생성 능력이 좋은 것으로 알려져 있으나, 액성이 염기성으로 갈수록 알코올 함량의 생성은 감소하고 그 대신 초산과 글리세롤의 생성이 일어나게 되어 잡균의 오염 또한 증대한다(Song과 Park, 2003). Kang 등(2015)에 따르면, 백국 약주의 경우 pH가 3.92-3.98이었으나 본 실험에서는 이보다 조금 낮은 수치를 보였다.
3.2.2. 생균수
단독발효구와 혼합발효구 모두에서 S. cerevisiae KMBL7001의 생균수 변화는 비슷한 경향을 나타내었으며, 발효 0일차 5.50-5.75 log CFU/mL에서 발효 3일차 8.21-8.73 log CFU/mL까지 증식하여, 발효 8일차에서는 8.26-8.29 log CFU/mL를 나타내었다. 혼합발효구에서 W. anomalus JS01은 발효 3일차에 7.36 log CFU/mL까지 증가 후 점차 감소하여 발효 8일차에는 관찰되지 않았다(Fig. 2(B)). 일반적으로 non-Saccharomyces 효모들은 S. cerevisiae에 비하여 상대적으로 낮은 5-7%의 알코올 내성을 가진다고 보고되어 있다(Ciani 등, 2016). 본 연구에서도 ethanol 함량이 7%에 도달한 발효 3일차 이후로 W. anomalus JS01의 생균수가 감소하는 경향을 확인하였다. 많은 연구들에서 non-Saccharomyces 효모들이 혼합발효 초기에 휘발성 향미성분 등 다양한 2차 대사산물들을 생산한다고 보고되어 있으며(Chen 등, 2021; Ravasio 등, 2018; Zhang 등, 2022), 본 연구에서도 W. anomalus JS01의 생육이 왕성한 발효 초기에 돼지감자 약주의 주질이 변화될 것으로 기대하였다.
3.2.3. 환원당
환원당의 경우, 혼합발효구는 발효 1, 2일차에 1.05-3.46%로 대조구에 비해 0.3-1.1% 낮게 측정되었으나, 2일차에 돼지감자가 첨가된 후, 발효 3일차에 1.75-1.77%로 대조구의 수치와 유사하게 증가하였으며, 발효종료 시점(0.27-0.29%)까지 비슷한 양상을 보였다(Fig. 2(C)). 1일차 환원당 함량의 차이는 초기 S. cerevisiae KMBL7001 접종량 차이에 따른 것으로 판단되며, 발효 3일차에 혼합발효구의 환원당이 대조구에 비해 증가한 것은 2일차에 첨가된 돼지감자의 inulin이 W. anomalus JS01이 분비하는 inulinase에 의해 일부 분해되어 산출된 fructose의 영향으로 사료된다.
3.2.4. 알코올
알코올 함량은 돼지감자 첨가 후인 발효 3-5일차에 혼합발효구가 대조구보다 0.9-1% 낮게 측정되었으나, 발효 종료시점에는 혼합발효구와 대조구의 알코올 함량이 거의 동일하였다(Fig. 2(C)). Gonzalez 등(2013)은 S. cerevisiae와 함께 crabtree negative 계열 non-Saccharomyces 효모(W. anomalus)를 사용하면 최종 와인에서 에탄올 함량이 낮아질 수 있다고 보고하였다. Varela 등(2017)의 연구에서도 Metschnikowia pulcherrima와 S. uvarum을 S. cerevisiae와 각각 혼합발효하였을 때, S. cerevisiae 단독발효 와인보다 알코올 함량이 1.0%와 1.7% 낮게 생성되었다고 보고하였으며, Lee 등(2019)의 연구에서도 W. anomalus JK04와 S. cerevisiae W-3 혼합발효 와인의 알코올 함량이 S. cerevisiae W-3 단독발효 와인보다 약 1% 적게 생산되어, W. anomalus가 S. cerevisiae보다 동일 당에서 생산하는 알코올 함량이 낮은 것으로 판단된다. 본 연구에서 혼합발효구와 단독발효구의 최종 알코올 함량이 비슷한 이유는, W. anomalus JS01의 알코올 생성능이 S. cerevisiae KMBL7001보다 떨어지지만, W. anomalus JS01이 분비하는 inulinase에 의해 발효에 이용할 수 있는 fructose 함량이 증가하였기 때문으로 사료된다.
3.3. 돼지감자 첨가 혼합발효 약주의 주질 특성
3.3.1. 유리당
효모의 혼합발효에 따른 돼지감자 약주의 유리당 함량은 Table 3과 같다. 혼합발효구에서 inulin은 대조구 대비 약 45% 정도 남아있는 것으로 확인되었다. 또한, sucrose와 glucose는 소량 검출, fructose는 불검출되었으며, sorbitol은 단독발효구에서 더 높은 함량이 확인되었다. Byun과 Nahm(1978)은 돼지감자를 효소처리하여 가수분해 후 총당 조성을 분석하였을 때, 77%의 fructose와 23% glucose로 이루어져 있다고 보고하였으며, 혼합발효구에서 W. anomalus JS01이 일부 inulin을 분해하여 fructose를 만든 다음, 발효에 이용한 것으로 판단된다. 또한, Duvnjak 등(1991)에 따르면, sorbitol의 생산을 위해 S. cerevisiae ATCC 36859를 이용하여 돼지감자의 fructose로부터 sorbitol을 생산할 수 있으며 이때, 돼지감자 즙에서 포도당을 완전히 소모한 후, 3% 효모 추출물을 첨가했을 때 sorbitol의 농도는 4.6%에 이른다고 보고하였다. Wei 등(2001)의 연구에서도 돼지감자로부터 sorbitol을 생산하기 위하여 Kluyveromyces 와 S. cerevisiae를 융합시킨 균주를 개발하였으며, 본 돼지감자 약주의 경우에서도 대조구와 혼합발효 시 사용된 S. cerevisiae KMBL7001 효모에 의해 돼지감자로부터 상대적으로 많은 sorbitol이 생성된 것으로 추측되며, 이에 대한 후속 연구가 필요할 것이다.
Table 3.
Free sugar contents of yakju supplemented with Jerusalem artichoke co-fermented by Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001
|
Strains1)
|
Free sugar content (g/L) |
|
Inulin |
Sucrose |
Glucose |
Fructose |
Sorbitol |
|
KMBL7001 |
43.32±1.212)
|
ND4)
|
1.21±0.01 |
ND |
40.40±3.02 |
|
KMBL7001 + JS01 |
19.41±1.01 |
0.20±0.01 |
0.79±0.01 |
ND |
13.82±1.08 |
|
p-value3)
|
*** |
|
*** |
|
*** |
Download Excel Table
3.3.2. 유기산
약주의 유기산 성분은 젖산, 구연산, 숙신산, 말산, 호박산, 초산이 대부분이며, 발효과정에서 알코올류와 반응하여 방향족 에스터 물질로 바뀌게 되어 술의 향미에 많은 영향을 미친다(Choi등, 2018; Kang등, 2016; Shin과 Park, 2021). 유기산의 함량은 두 시료구 모두에서 citric acid (1.97-2.16 g/L), lactic acid(1.37-1.47 g/L), succinic acid(0.83-0.86 g/L), malic acid(0.36-0.38 g/L), acetic acid(0.08-0.12 g/L) 순으로 높게 확인되었으며, 대조구 대비 혼합발효구에서 acetic acid를 제외한 유기산 4종에 대해 다소 높은 함량을 보였다(Table 4). Kim 등(2018)에 따르면, A. luchuensis 74-5로 제조한 쌀누룩과 여러 가지 효모로 찹쌀 막걸리를 제조하였을 때, 전반적으로 citric acid 함량이 가장 높았고, malic acid, lactic 순으로 나타났다고 보고되었다. 또한, Shin과 Park(2021)에 따르면, 쌀입국을 사용한 non-Saccharomyces와 S. cerevisiae의 혼합발효 약주에서도 citric acid(4.31-4.53 mg/mL) 함량이 가장 높았으며, 이어 succinic acid, malic acid, acetic acid, lactic acid 순으로 확인되었다고 보고되었다. 흰색과 자색 돼지감자의 유기산 함량을 분석한 Jung과 Shin(2017)의 연구에 따르면, 두 품종 돼지감자의 주된 유기산은 citric acid, malic acid, succinic acid라고 분석되었으며, 총유기산 함량은 흰색 돼지감자(2,065 mg/100 g)에 비해 자색 돼지감자(2,482 mg/100 g)가 유의적으로(p⟨0.05) 높았다고 보고되었다. 따라서, 돼지감자 첨가 약주의 유기산 함량 중 다량을 차지하는 citric acid는 발효제로 사용한 백국과 원물 돼지감자가 함유하는 citric acid에 의한 것이라 사료된다.
Table 4.
Organic acid contents of yakju supplemented with Jerusalem artichoke co-fermented by inulin-degrading yeast Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001
|
Strains1)
|
Organic acid content (g/L) |
|
Citric acid |
Malic acid |
Succinic acid |
Lactic acid |
Acetic acid |
|
KMBL7001 |
1.97±0.162)
|
0.36±0.04 |
0.83±0.02 |
1.37±0.06 |
0.12±0.01 |
|
KMBL7001 + JS01 |
2.16±0.21 |
0.38±0.03 |
0.86±0.02 |
1.47±0.18 |
0.08±0.01 |
|
p-value3)
|
NS |
NS |
NS |
NS |
** |
Download Excel Table
3.3.3. 아미노산
아미노산의 측정결과, 각 아미노산별 함량에서 혼합발효구가 대조구보다 전반적으로 높거나 유사하였다(Table 5). 효모의 대사과정에서 유리 아미노산은 Ehrlich pathway를 거쳐 alcohol 또는 aldehyde 성분이 생성되므로 술 발효에 있어 중요한 평가 요소이다(Na와 Park, 2020). 단백질의 분해 산물인 아미노산은 각각 특유한 맛을 나타내는데, D-glutamic acid는 감칠맛, L-leucine, L-isoleucine, L-methionine, L-histidine, L-phenylalanine, L-alginine은 쓴맛, L-asparagine, L-aspartic acid, L-glutamic acid는 신맛, L-proline은 달고 신맛, glycine, L-alanine, DL-serine, DL-valine, DL-threonine, L-hydroxyproline, L-lysine, DL-tryptophan은 단맛을 가진다고 알려져 있다(Oh 등, 2008). 본 연구의 혼합발효구의 아마노산 중 serine, glycine, alanine, lysine의 경우, 각각 44.09, 91.70, 258.98, 31.06 mg/L로 단독발효구에 비해 높게 측정되었으며, 이것은 관능평가 항목 중 단맛에서 단독발효구에 비해 상대적으로 좋은 평가에 영향을 미치는 요소로 보인다(Table 5). Jung과 Shin(2017)의 연구에 따르면, 열풍건조한 돼지감자 분말의 총아미노산은 1.337×104 mg/kg이었고, 그중 필수아미노산의 함량은 2,737 mg/kg 이었으며, 아미노산 중 histidine(7,305 mg/kg)이 최고, leucine (184.16 mg/kg)이 최저 함량을 보였다고 보고하였다. 볶음 처리한 돼지감자의 영양성분을 조사한 Lee(2016)의 연구에 따르면, 볶음 돼지감자에서 총 24종의 아미노산이 동정되었으며, 총아미노산의 함량은 2,678.018 mg/100 g이고 필수아미노산은 157.294 mg/100 g으로 확인되었으며, 특히 arginine 함량이 매우 높다고 보고되었다.
Table 5.
Amino acid contents of yakju supplemented with Jerusalem artichoke co-fermented by Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001
|
Compound |
Amino acid content (mg/L) |
|
|
KMBL70011)
|
KMBL7001 + JS012)
|
|
Aspartic acid |
89.52±2.223)A4)
|
41.30±1.58B
|
|
Threonine |
ND5)
|
ND |
|
Serine |
35.98±1.25B
|
44.09±2.5A
|
|
Glutamic acid |
129.26±4.22B
|
172.75±5.25A
|
|
Glycine |
74.20±2.24B
|
91.70±4.82A
|
|
Alanine |
176.18±6.23B
|
258.98±8.24A
|
|
Cystine |
36.41±3.57B
|
53.90±4.23A
|
|
Valine |
80.61±3.21B
|
87.12±2.22A
|
|
Methionine |
19.75±0.56B
|
25.95±0.95A
|
|
Isoleucine |
32.60±0.88B
|
42.46±0.56A
|
|
Leucine |
110.35±1.42B
|
131.83±1.21A
|
|
Tyrosine |
136.70±0.89B
|
147.82±1.23A
|
|
Phenylalanine |
78.45±0.46B
|
101.94±0.56A
|
|
Lysine |
51.23±0.65B
|
53.03±0.78A
|
|
Histidine |
23.40±0.45B
|
31.06±0.21A
|
|
Arginine |
134.90±0.56 |
101.87±1.21B
|
|
Proline |
475.83±4.25B
|
629.92±5.95A
|
|
Total amino acid |
1,685.38±33.06B
|
2,015.72±41.50A
|
Download Excel Table
3.4. 돼지감자 첨가 혼합발효 약주의 관능평가
효모의 혼합발효에 따른 돼지감자 약주의 관능평가 결과는 Table 6과 같다. 모든 항목에서 시료 간의 유의적인 차이는 없었으나, W. anomalus JS01과 S. cerevisiae KMBL7001을 혼합발효한 약주가 단독발효구와 비교하여 조금씩 높은 관능점수를 받았다. 돼지감자 약주의 색의 경우 4.58-4.84, 향미는 4.41-4.76으로 확인되었으며, 신맛은 3.41-4.12, 단맛은 3.76-4.26의 점수를 얻었다. Cho 등(2010)에 따르면, 신맛과 단맛은 서로 높은 상관성을 가진다고 하며, Kang 등(2020)은 쌀누룩 약주제조 시, 백국의 신맛이 약주의 단맛을 상승시켜준다고 보고하였다. 본 돼지감자 혼합발효 약주의 경우, 백국과 효모에서 생성된 유기산으로 인해, 산미가 단맛을 증가시킨 것으로 사료된다. S. cerevisiae KMBL7001과 W. anomalus JS01 전반적인 기호도에서 혼합발효구의 경우, 5.12로 단독발효구에 비해 0.3 정도의 높은 기호도를 나타내었다. 본 연구의 관능평가 결과를 통해, 돼지감자 첨가 약주 제조 시 S. cerevisiae KMBL7001과 inulin 분해 효모 W. anomalus JS01의 혼합발효를 이용하여 우수한 품질의 돼지감자 약주 제조의 가능성을 확인하였다.
Table 6.
Sensory evaluation of yakju supplemented with Jerusalem artichoke co-fermented by Wickerhamomyces anomalus JS01 and Saccharomyces cerevisiae KMBL7001
|
Strains1)
|
Sensory score |
|
|
Color |
Flavor |
Sweetness |
Sourness |
Overall preference |
|
KMBL7001 |
3.58±1.322)
|
3.41±1.66 |
2.76±1.28 |
3.41±1.66 |
4.82±1.67 |
|
KMBL7001 + JS01 |
3.84±1.64 |
3.76±1.79 |
3.26±1.36 |
4.12±1.80 |
5.12±1.58 |
|
p-value3)
|
NS |
NS |
NS |
NS |
NS |
Download Excel Table
감사의 글
본 연구는 2022년 한국연구재단 과제(2022R1I1A3072406)의 연구비 지원에 의해 수행되었으며, 이에 감사드립니다.
References
Ahmed H. Principles and Reactions of Protein Extraction, Purification, and Characterization. CRC Press, London, England, p 350-352 (2004)

Byun SM, Nahm BH. Production of fructose from Jerusalem artichoke by enzymatic hydrolysis. J Food Sci, 43, 1871-1873 (1978)


Chen L, Li D, Ren L, Song S, Ma X, Rong Y. Effects of simultaneous and sequential cofermentation of
Wickerhamomyces anomalus and
Saccharomyces cerevisiae on physicochemical and flavor properties of rice wine. Food Sci Nutr, 9, 71-86 (2021)

,

,


Cho SD, Chang MS, Kim DM, Kim GH. Correlation between sensory quality and instrumental quality attributes in ‘Campbell Early’ grape. Korean J Hortic Sci Technol, 28, 691-695 (2010)

Choi JS, Park YD, Kim CW, Jeong ST. Characteristics of
Yakju fermented using different commercial yeasts. Korean J Food Preserv, 25, 715-721 (2018)


Ciani M, Morales P, Comitini F, Tronchoni J, Canonico L, Curiel JA, Oro L, Rodrigues AJ, Gonzalez R. Non-conventional yeast species for lowering ethanol content of wines. Front Microbiol, 7, 642 (2016)


Costa GT, Abreu GC, Guimaraes AB, Vasconcelos PR, Guimaraes SB. Fructo-oligosaccharide effects on serum cholesterol levels. An overview. Acta Cir Bras, 30, 366-370 (2015)

,


Cunningham M, Azcarate-Peril MA, Barnard A, Benoit V, Grimaldi R, Guyonnet D, Holscher HD, Hunter K, Manurung S, Obis D, Petrova MI, Steinert RE, Swanson KS, van Sinderen D, Vulevic J, Gibson GR. Shaping the future of probiotics and prebiotics. Trends Microbiol, 29, 667-685 (2021)

,


Duvnjak Z, Turcotte G, Duan ZD. Production of sorbitol and ethanol from Jerusalem artichokes by
Saccharomyces cerevisiae ATCC 36859. Appl Microbiol Biotechnol, 35, 711-715 (1991)


Gonzalez R, Quiros M, Morales P. Yeast respiration of sugars by non-
Saccharomyces yeast species: A promising and barely explored approach to lowering alcohol content of wines. Trends Food Sci Technol, 29, 55-61 (2013)


Hwang EG, Lee SH, Kim BK, Kim SJ, Ann YG, Doryoon M, Oh SC. Components and function of artichoke tea prepared by steaming and drying method. J Korean Appl Sci Technol, 36, 1-12 (2019)

Hwang SJ. Antioxidant activities and quality characteristics of seolgitteok added with purple Jerusalem artichoke (
Helianthus tuberosus L.). Food Service Industry Journal, 17, 247-259 (2021)

Ibrahim OO. Functional oligo-saccharides: Chemicals structure, manufacturing, health benefits, applications and regulations. J Food Chem Nanotechnol, 4, 65-76 (2018)

Jung BM, Shin TS. Organic acids, free sugars, and volatile flavor compounds by type of Jerusalem artichoke. J Korean Soc Food Sci Nutr, 46, 822-832 (2017)

Kalyani Nair K, Kharb S, Thompkinson D. Inulin dietary fiber with functional and health attributes: A review. Food Rev Int, 26, 189-203 (2010)


Kang JE, Choi HS, Kim JW, Kim CW, Yeo SW, Jung ST. Quality characteristics of
yakju with
nuruk extracts. Korean J Food Sci Technol, 48, 223-230 (2016)


Kang JE, Kim HE, Im BR, Choi HS, Jeong ST. Analysis of the physicochemical characteristics in
yakju with variety
nuruk. Korean J Community Living Sci, 31, 15-24 (2020)


Kango N, Jain SC. Production and properties of microbial inulinases: Recent advances. Food Biotechnol, 25, 165-212 (2011)


Kim DM, Kim HS. Continuous production of gluconic acid and sorbitol from Jerusalem artichoke and glucose using an oxidoreductase of
Zymomonas mobilis and inulinase. Biotechnol Bioeng, 39, 336-342 (1992)

,


Kim MH, Kim HY, Han JS, Ji EH, Kim AJ. Physicochemical analysis and quality characteristics of Jerusalem artichoke and
mook prepared with Jerusalem artichoke powder. Korean J Food Nutr, 28, 635-642 (2015)

,


Kim SH, Mun JY, Kim SY, Yeo SH. Quality characteristics of glutinous rice-
Makgeolli fermented with Korean yeast (SC Y204 and Y283) isolated from
nuruk. Korean J Food Preserv 25, 874-884 (2018)


Kumar CG, Sripada S, Poornachandra Y. Status and future prospects of fructooligosaccharides as nutraceuticals. In: Role of Materials Science in Food Bioengineering, Grumezescu AM, Holban AM (Editors), Academic Press, Amsterdam, The Netherlands, p 451-503 (2018)


Kurtzman CP, Fell JW. The Yeasts, A Taxonomic Study. 4th ed, Elsevier Science Publishers, Amsterdam, The Netherlands, p 89-94 (1998)

Lee SB, Banda C, Park HD. Effect of inoculation strategy of non‐
Saccharomyces yeasts on fermentation characteristics and volatile higher alcohols and esters in campbell early wines. Aust J Grape Wine Res, 25, 384-395 (2019)


Lee YR. Analysis of nutritional components and antioxidant activity of roasting
Wooung (burdock,
Aarctium lappa L.) and Jerusalem artichoke (
Helianthus tuberosus L.). Korean J Food Nutr, 29, 870-877 (2016)


Liu GL, Chi Z, Chi ZM. Molecular characterization and expression of microbial inulinase genes. Crit Rev Microbiol, 39, 152-165 (2013)

,


Na Y, Park SH. Fermentation of wheat bran through lactic acid bacteria: Changes in flavor components and free amino acids and potential applications in baking. Korean J Food Sci Technol, 52, 524-528 (2020)

National Tax Service Liquors License Support Center. Analysis Regulations of Alcoholic Beverages. NTS, NTS Instructions 2014, (2014)

Oh HI, Lee HJ, Moon TH, Noh NS, Kim SJ. Food Chemistry. Soohaksa, Seoul, Korea, p 191-192 (2008)

Park BB, Renchinkhand G, Nam MS. Physicochemical properties of fermented milk supplemented with
Helianthus tuberosus powder. J Milk Sci Biotechnol, 37, 196-205 (2019)


Park HY, An NY, Ryu HK. The quality characteristics and hypoglycemic effect of cookies containing
Helianthus tuberosus powder. Korean J Community Living Sci, 24, 233-241 (2013)


Park JB, Choi JS, Park HW, Lee SB, Park HD. Development of Korean indigenous low-temperature-tolerant yeast for enhancing the flavor of
yakju. Fermentation, 7, 260 (2021)


Ravasio D, Carlin S, Boekhout T, Groenewald M, Vrhovsek U, Walther A, Wendland J. Adding flavor to beverages with non-conventional yeasts. Fermentation, 4, 15 (2018)


Shin DS, Choi ID, Lee SK, Park JY, Kim NG, Park CH, Choi HS. Properties of amino acid and volatile flavor compounds of fermented soybean products by soybean cultivar. Korean J Food Nutr, 32, 434-441 (2019)

Shin HY. Manufacturing of non-
Saccharomyces yeast starter with excellent flavor-enhancing effect of
yakju by air-blast drying and characteristics of co-fermentation with
S. cerevisiae. MS Thesis, Kyungpook National University, Korea, p 45-46 (2021)

Shin SH, Kwon SJ, Jo HJ, Go D, Han J. Extraction and analysis of inulin from Jerusalem artichoke. Food Sci Ind, 45, 50-58 (2012)

Slimestad R, Seljaasen R, Meijer K, Skar SL. Norwegian-grown Jerusalem artichoke (
Helianthus tuberosus L.): Morphology and content of sugars and fructo-oligosaccharides in stems and tubers. J Sci Food Agric, 90, 956-964 (2010)

,


Song JC, Park HJ. Takju brewing using the uncooked germed brown rice at second stage mash. J Korean Soc Food Sci Nutr, 32, 847-854 (2003)


Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6: Molecular evolutionary genetics analysis version 6.0. Mol Biol Evol, 30, 2725-2729 (2013)

,

,


Varela C, Barker A, Tran T, Borneman A, Curtin C. Sensory profile and volatile aroma composition of reduced alcohol Merlot wines fermented with
Metschnikowia pulcherrima and
Saccharomyces uvarum. Int J Food Microbiol, 252, 1-9 (2017)

,


Wei W, Wu K, Qin Y, Xie Z, Zhu X. Intergeneric protoplast fusion between
Kluyveromyces and
Saccharomyces cerevisiae to produce sorbitol from Jerusalem artichokes. Biotechnol Lett, 23, 799-803 (2001)


Weng W, Zheng H, Su W. Characterization of edible films based on tilapia (
Tilapia zillii) scale gelatin with different extraction pH. Food Hydrocoll, 41, 19-26 (2014)


Yuan X, Gao M, Xiao H, Tan C, Du Y. Free radical scavenging activities and bioactive substances of Jerusalem artichoke (
Helianthus tuberosus L.) leaves. Food Chem, 133, 10-14 (2012)


Zhang B, Tang C, Yang D, Liu H, Xue J, Duan C, Yan G. Effects of three indigenous non-
Saccharomyces yeasts and their pairwise combinations in co-fermentation with
Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines. Food Chem, 368, 130807 (2022)

,