1. 서론
30세 이후 남성호르몬인 테스토스테론의 분비량은 매년 약 1-2% 비율로 감소하고, 40세 이후 그 수준이 현저하게 감소하게 된다(Decaroli와 Rochira, 2017). 테스토스테론은 정소의 Leydig 세포에서 생성되며 정자 형성, 근육량 및 골격량 증가 등을 조절하는 호르몬이다. 콜레스테롤은 steroidogenic acute regulatory protein(StAR protein)과 cytochrome P450 family 11 subfamily A member I(CYP11A1)에 의해 pregnenolone으로 전환되며 3β-hydroxysteroid dehydrogenase 2(3β-HSD2)에 의해 pregnenolone을 progesterone으로, cytochrome P450 family 17 subfamily A member 1(CYP17A1)은 progesterone을 androstenedione으로 전환하는 단계를 순차적으로 거쳐, 최종적으로 17β-hydroxysteroid dehydrogenase 3(17β-HSD3)에 의해 테스토스테론으로 합성되며, 이와 반대로 5α-reductase2 및 aromatase는 테스토스테론을 dihydrotestosterone(DHT)과 에스트라디올로 전환하며 테스토스테론을 감소시킨다(Haider, 1996; Payne와 Hales, 2004; Rasmussen과 Ekstrand, 2014). 노화에 의한 Leydig 세포 감소뿐만 아니라 산화적 스트레스는 콜레스테롤을 pregnenolone으로 전화시키는 P450scc와 StAR 단백질 발현을 억제하여 최종적으로 테스토스테론 합성을 감소시키는 것으로 알려져 있으며, 남성 갱년기의 주요 원인 중 하나로 여겨지고 있다(Chang 등, 2008; Choe 등, 2016; Luo 등, 1996; Tsai 등 2003). 테스토스테론 감소는 남성 갱년기의 주된 원인으로 작용하며 다양한 신체 증상을 유발한다(Sattler 등, 2011). 개인차에 따라 다르게 나타나기는 하지만 발기부전, 체력 저하, 근육량 감소, 안면홍조, 복부지방 증가 및 비만, 골밀도 감소, 기억력 감소, 활력 저하로 인한 피로감, 우울증 등 다양한 증상들이 나타나게 된다(Luo 등, 1996; Schubert과 Jockenhovel, 2005). 이러한 남성 갱년기 증상들은 노화의 진행과 함께 테스토스테론이 감소하며 자연스럽게 발생하기 때문에 진행이 느리고 다른 질병이나 여성 갱년기처럼 증상이 뚜렷하게 나타나지는 않지만, 여러 신체 기관에 부정적인 영향을 끼치며 신체적, 정신적, 사회적인 면에서 삶의 질을 현저하게 저하시키게 된다(Bhasin 등, 2006; Nieschlag 등, 2006; Singh, 2013). 따라서 테스토스테론의 생성을 증가시켜 남성 갱년기 증상을 개선 시키기 위한 많은 연구가 보고되고 있다. 대표적인 방법으로 테스토스테론을 직접 보충하는 방법에 관한 연구들이 진행됐지만, 효과의 지속성과 전립선암, 전립선 비대증, 심혈관질환 및 적혈구 증가 등의 부작용 발생에 의한 안전성에 관한 논란이 제기되고 있다(Decaroli와 Rochira, 2017; Jakiel 등, 2015). 따라서 남성 갱년기 증상 개선을 위해 장기적으로 테스토스테론을 생성하며 안전성이 확보된 천연물 소재의 필요성이 대두되고 있다.
코끼리마늘(Allium ampeloprasum)은 부추속(Allium genus)에 속하는 식물로, 마늘처럼 인편이 분화되며 약 10배가량 크며 무취마늘, 점보마늘, great-headed 마늘, 웅녀마늘 등으로 불리지만 leek에 더 가까운 작물이다(Brewster, 2008; Figliuolo 등, 2001; Youn 등, 2015). 여러 연구를 통해서 scopoletin, scordinin, alliin, allicin 등과 같은 물질을 함유하고 있으며, 항균, 항암, 항산화, 항당뇨, 지방세포 분화억제, 콜레스테롤 수치 저하, 혈압 및 기관지염과 같은 호흡기 질환 치료 등과 같은 생리활성이 보고되고 있어 다양한 분야에서 활용 가능성에 대해 제시되고 있다(Ham 등, 2016; Hughes와 Lawson, 1991; Kim, 2017; Kim과 Kim, 2015; Lee 등, 2020; Lu 등, 2011; Moreno 등, 2006; Rahini-Madiseh 등, 2017; Rattanachaikunsopon과 Phumkhachorn, 2009; Tavakkoli 등, 2015). 하지만 대부분의 국내 연구는 코끼리마늘 육종, 영양성분 분석, 흑마늘 제조에 관한 연구들이 대부분을 차지하고 있으며 생리활성에 관한 연구는 부족한 실정이다(Cho 등, 2020; Kim 등, 2019; Kwon 등, 2018; Youn 등, 2015). 따라서 본 연구에서는 TM3 Leydig 세포에서 코끼리마늘 추출물이 테스토스테론 생성을 증가시킬 수 있는지를 확인하여 남성 갱년기 증상 개선을 위한 기능성 소재로서 활용 가능성을 검토하였다.
2. 재료 및 방법
코끼리마늘은 의성에서 재배된 것을 농업회사법인 현대에프앤비(주)로부터 제공받아 실험에 사용하였다. 코끼리마늘은 껍질을 제거하고 흐르는 물로 세척한 다음 자연 건조하였다. 코끼리마늘 100 g에 70% 에탄올 300 mL를 가하고 상온에서 1주일간 침지추출하였다. 추출액은 filter paper (Advantec, Tokyo, Japan)로 여과하고 회전 감압농축기(Tokyo Rikakikai, Tokyo, Japan)를 이용하여 농축하였다. 농축된 추출물은 동결건조기(Ilshin Lab, Dongducheon, Korea)를 이용하여 분말 상태로 제조하고 −20°C에 보관하며 실험에 사용하였다. 코끼리마늘 추출물은 4.7 g을 얻었고 약 4.7%의 수율로 산출되었다.
TM3 Leydig 세포는 한국세포주은행(Seoul, Korea)에서 분양받아 실험에 사용하였다. 10% Fetal bovine serum (FBS)과 1% antibiotics(100 units/mL penicillin and 100 μg/mL streptomycin)를 첨가한 Dulbecco’s modified Eagle medium(DMEM) 배지를 사용하여 37°C, 5% CO2 조건에서 배양하였으며, 세포 밀도가 70-80%가 되었을 때 trypsin-EDTA를 이용하여 계대 배양하며 사용하였다. 산화적 스트레스를 유도하기 위해 세포를 분주하고 24시간 후, 과산화수소를 포함하는 serum free 배지에서 4시간 동안 배양한 후 추출물을 농도별로 희석하여 추가로 24시간 배양한 후 세포 및 배지를 수거하여 실험에 사용하였다.
코끼리마늘 추출물의 세포독성을 보기 위해, TM3 Leydig 세포를 1×105 cells/well 농도로 96-well plates에 분주하여 24시간 배양하였다. 코끼리마늘 추출물과 과산화수소에 의한 세포 생존율 변화를 확인하기 위해, 100 μM 과산화수소를 포함하는 serum free 배지에서 4시간 동안 배양한 후 추출물을 농도별로 희석하여 추가로 24시간 배양하였다. 배양 후 배지를 제거하고 각각의 well에 0.5 mg/mL MTT[3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl-tetrazoliumbromide] 용액을 100 μL씩 처리하였다. 37°C에서 4시간 동안 배양한 후 배지를 제거하고 생성된 formazan을 100 μL DMSO에 녹여준 후 microplate reader (Molecular Devices, Sunnyvale, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하고 세포 생존율을 비교하였다.
코끼리마늘 추출물이 testosterone 생성에 미치는 영향을 확인하기 위해 ELISA를 이용하여 확인하였다. TM3 Leydig 세포를 5×105 cells/well 농도로 6-well plates에 분주한 후 100 μM 과산화수소를 포함하는 serum free 배지에서 4시간 동안 배양한 후, 추출물을 농도별로 희석하여 추가로 24시간 배양하였다. Testosterone 측정은 ELISA kit(MyBioSource, San Diego, CA, USA)를 사용하여 제조사의 manual에 따라 측정하였다.
코끼리마늘 추출물이 테스토스테론 합성 및 분해에 관여하는 효소인 3β-HSD2, 17β-HSD3, aromatase, 5α-reductase2 활성에 미치는 영향을 확인하기 위해 ELISA를 이용하여 확인하였다. TM3 Leydig 세포를 5×105 cells/well 농도로 6-well plates에 분주한 후 100 μM 과산화수소를 포함하는 serum free 배지에서 4시간 동안 배양한 후, 추출물을 농도별로 희석하여 추가로 24시간 배양하였다. 3β-HSD2, 17β-HSD3, aromatase, 5α-reductase2 측정은 ELISA kit(MyBioSource, San Diego, CA, USA)를 사용하여 제조사의 manual에 따라 측정하였다.
추출물과 과산화수소 처리가 끝난 후 TM3 Leydig 세포를 회수하여 PBS로 세척한 후, RIPA buffer(50 mM Tris-HCl, pH 8.0, 150 mM NaCl, 1% NP-40, 0.5% nadeoxycholate, 0.1% SDS)를 처리하고 20분간 4°C에서 용해시켰다. 12,000 rpm, 4°C에서 20분간 원심분리하여 상등액을 회수하고 BCA assay kit(Thermofisher, Waltham, MA, USA)를 이용하여 단백질을 정량하였다. 20 μg/mL의 단백질을 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)에서 전기영동하였다. 전기영동 후 단백질을 polyvinylidene fluoride(PVDF) membrane(Roche Diagnostics GmbH, Mannheim, Germany)에 1시간 동안 전이시키고, everyblot blocking buffer(Bio-Rad, Hercules, CA, USA)를 이용하여 상온에서 10분 동안 blocking하였다. 1차 antibody를 1:1,000으로 희석하여 4°C에서 하룻밤 동안 반응시켰으며 TBST로 membrane을 3회 세척 후, 2차 antibody를 1:1,000-1:2,500으로 희석하여 상온에서 2시간 반응시켰다. 반응이 끝난 membrane을 TBST로 3회 세척 후 enhanced chemiluminescent substrate(Thermofisher, Waltham, MA, USA)에 반응시켜 membrane에 생성된 protein band를 image reader(Microchemi 4.2, DNR, Neve Yamin, IS)로 확인 후 발현 정도를 분석하였다.
3. 결과 및 고찰
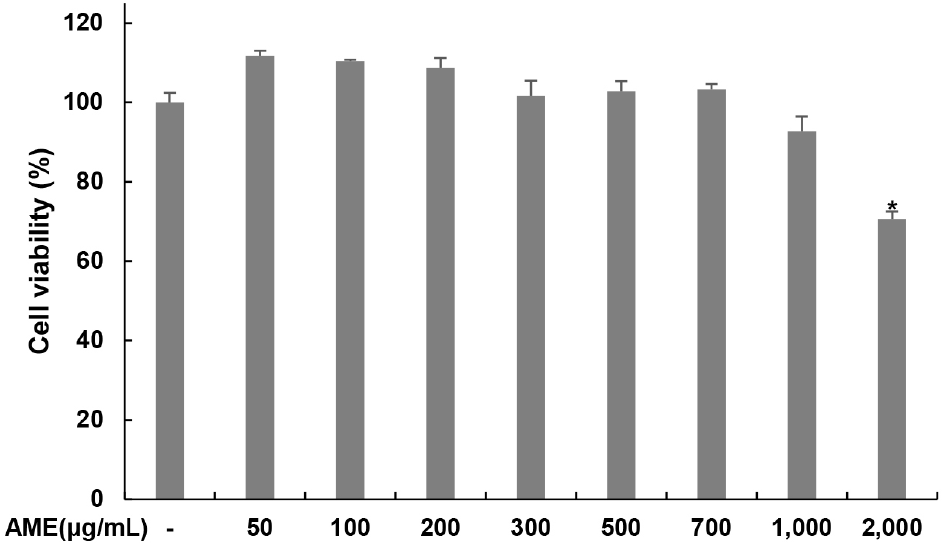
코끼리마늘 추출물이 TM3 Leydig 세포의 세포 생존율에 미치는 영향을 확인하였다. 추출물을 0-700 μg/mL 농도로 24시간 처리하였을 때 700 μg/mL 이하에서는 독성을 보이지 않았으며, 1,000 μg/mL를 처리하였을 때 무처리군 대비 92.77%, 2,000 μg/mL를 처리하였을 때 무처리군 대비 70.63%의 세포 생존율을 나타냄을 확인하였다(Fig. 1). 이 결과를 바탕으로 세포독성을 나타내지 않은 농도 범위 내에서 다음 실험을 진행하였다.
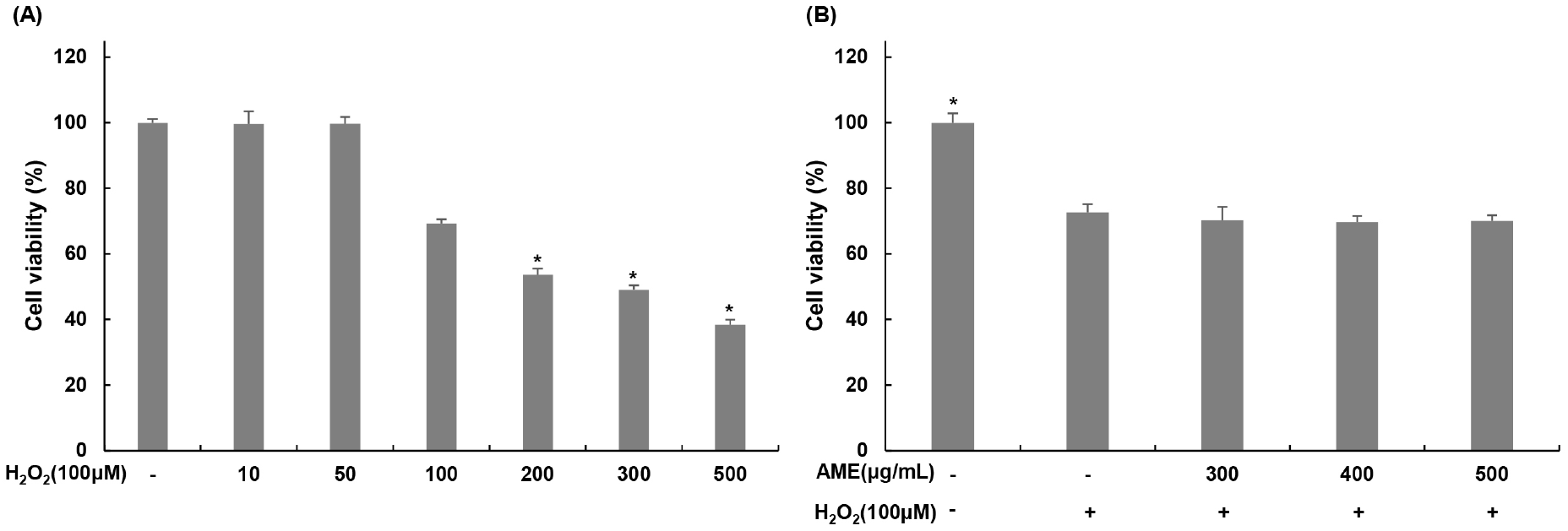
산화적 스트레스에 대한 코끼리마늘 추출물의 세포 보호능을 알아보기 위해 과산화수소를 처리하였다. 과산화수소의 세포독성을 확인하기 위해 농도별(10, 50, 100, 200, 300, 500 μM)로 처리하고 24시간 후 세포 생존율을 측정하였다. 24시간 후 과산화수소 처리군의 세포 생존율은 무처리군 대비 각각 99.61, 99.70, 69.27, 53.62, 49.07, 38.35%를 나타냈으며, 이후 실험은 과산화수소 100 μM을 처리 농도로 설정하였다(Fig. 2(A)). TM3 Leydig 세포에 100 μM의 과산화수소를 4시간 동안 처리한 뒤 코끼리마늘 추출물을 농도별로 처리하고 24시간 후 세포 생존율 변화를 확인하였다. 24시간 후 세포 생존율을 확인한 결과, 무처리군 대비 과산화수소 단독 처리군은 68.61%로 세포 생존율이 감소하였지만, 코끼리마늘 추출물을 300, 400, 500 μg/mL로 처리한 군에서는 70.31, 69.70, 70.07%를 보였다(Fig. 2(B)). 따라서 코끼리마늘 추출물은 산화적 스트레스를 받은 TM3 Leydig 세포의 세포 생존율의 증가에는 영향을 미치지 않는 것으로 나타났다.
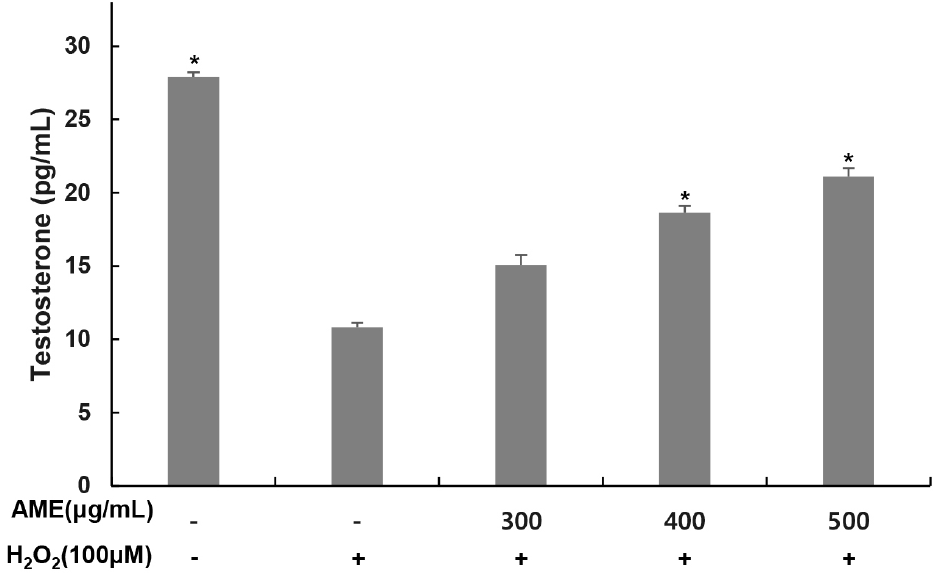
산화적 스트레스는 테스토스테론을 감소시킴으로써 남성 갱년기의 주요 원인 중 하나로 여겨지고 있다. 과산화수소를 처리한 in vitro 모델 연구에서 산화적 스트레스에 의해 콜레스테롤을 pregnenolone으로 전화시키는 P450scc와 StAR 단백질 발현이 억제되고, 최종적으로 테스토스테론 감소가 나타나는 것으로 보고되고 있다(Chang 등, 2008; Choe 등, 2016; Tsai 등 2003). 산화적 스트레스가 유도된 TM3 Leydig 세포에서 코끼리마늘 추출물이 테스토스테론 생성에 미치는 영향을 알아보기 위해 과산화수소(100 μM)를 4시간 동안 처리한 뒤, 코끼리마늘 추출물(300, 400, 500 μg/mL)을 농도별로 24시간 동안 처리한 후 배지를 수거하여 테스토스테론 함량을 측정하였다. 무처리군에서는 27.90 pg/mL를 나타냈지만, 과산화수소 단독 처리군에서 테스토스테론 함량이 10.81 pg/mL로 61.25% 감소하였다. 코끼리마늘 추출물 처리군에서는 각 농도별로 15.09, 18.64, 21.12 pg/mL로 나타났으며 과산화수소 단독 처리군 대비 테스토스테론 함량이 139.57, 172.41, 195.35% 증가하였다(Fig. 3). 이러한 결과는 코끼리마늘 추출물이 TM3 세포에서 테스토스테론의 생성을 증가시킬 수 있음을 보여주고 있으며, 테스토스테론 생성 저하로 인한 남성 갱년기 증상 개선에 도움을 줄 수 있는 소재로 활용 가능할 것으로 판단된다.
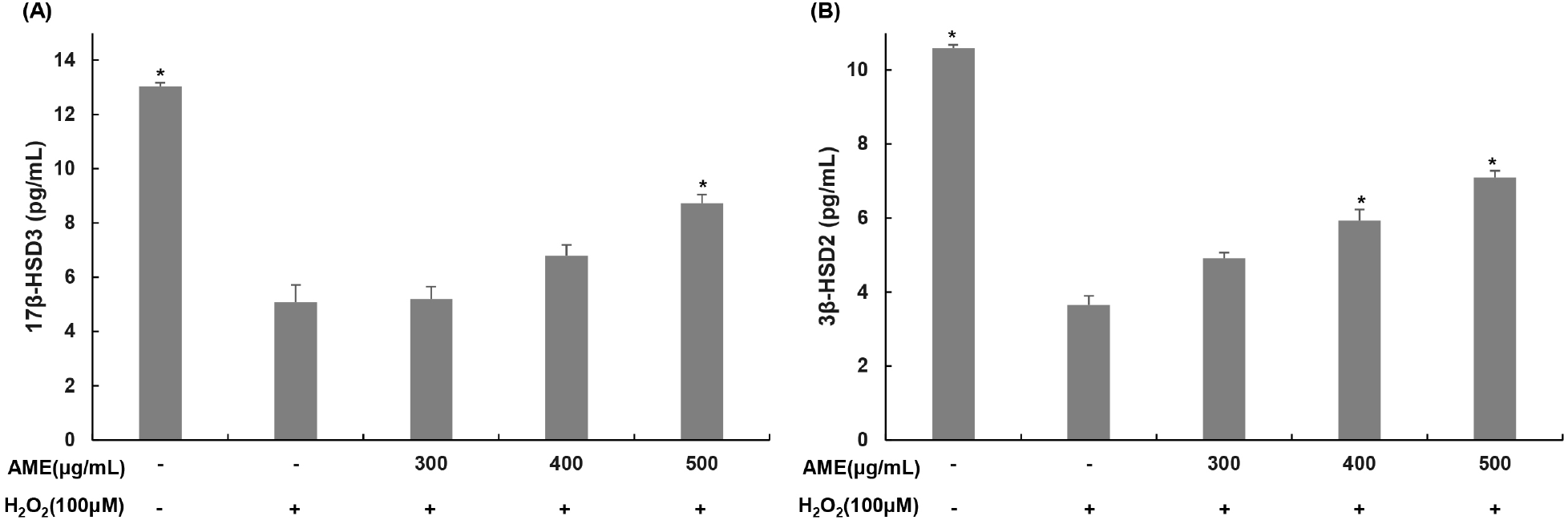
테스토스테론 합성에 관여하는 17β-HSD3과 3β-HSD2는 testosterone 합성과정 초기부터 마지막 과정까지 관여한다. 17β-HSD3은 DHEA를 androstendiol로 전환시키고, androstenedione을 testosterone으로 전환시키는 효소이며 3β-HSD2는 pregenolone을 progesterone으로 전환시키고, androstendiol에서 testosterone으로 전환시키는 효소이다(Byun과 Choung, 2019). 산화적 스트레스가 유도된 TM3 Leydig 세포에서 코끼리마늘 추출물이 테스토스테론 합성과정에 관여하는 효소에 미치는 영향을 알아보기 위해 과산화수소(100 μM)를 4시간 동안 처리한 뒤 코끼리마늘 추출물(300, 400, 500 μg/mL)을 농도별로 처리하고 24시간 동안 처리한 후 배지를 수거하여 측정하였다(Fig. 4). 17β-HSD3의 경우에는, 무처리군에서는 13.02 pg/mL를 나타냈지만, 과산화수소 단독 처리군에서는 5.07 pg/mL로 61.01% 감소하였다. 코끼리마늘 추출물 처리군에서는 각 농도별로 5.20, 6.80, 8.72 pg/mL로 과산화수소 단독 처리군 대비 17β-HSD3가 각각 102.55, 130.60, 128.31% 증가하였다. 3β-HSD2의 경우, 무처리군에서는 10.60 pg/mL를 나타냈지만, 과산화수소 단독 처리군에서는 3.65 pg/mL로 65% 감소하였다. 코끼리마늘 추출물 처리군에서는 각 농도별로 4.91, 5.93, 7.09 pg/mL로, 과산화수소 단독 처리군 대비 3β-HSD2가 각각 134.62, 162.55, 194.41% 증가하였다. 과산화수소 처리에 의해 테스토스테론 합성에 관여하는 효소들의 감소가 나타남을 확인하였으며, 코끼리마늘 추출물이 과산화수소에 의해 감소된 테스토스테론 합성에 관여하는 효소들을 증가시켜 테스토스테론의 전체 생성을 증가시키는 것으로 판단된다.
테스토스테론 대사과정에서 5α-reductase는 androstenedione을 androstanedione으로 전환을 담당하며 테스토스테론을 dihydrotestosterone으로 전환하고, aromatase는 테스토스테론을 estradiol로 전환하여 테스토스테론의 전체 농도를 감소시킨다(Khazali과 Mahmoudi, 2019; Rasmussen과 Ekstrand, 2014). 산화적 스트레스가 유도된 TM3 Leydig 세포에서 코끼리마늘 추출물이 테스토스테론 분해과정에 관여하는 효소에 미치는 영향을 알아보기 위해 과산화수소(100 μM)를 4시간 동안 처리한 뒤, 코끼리마늘 추출물(300, 400, 500 μg/mL)을 농도별로 처리하고 24시간 동안 처리한 후 배지를 수거하여 측정하였다(Fig. 5). 5α-Reductase의 경우에는, 무처리군에서는 85.96 pg/mL를 나타냈지만, 과산화수소 단독 처리군에서는 123.79 pg/mL로 144.10% 증가하였다. 코끼리마늘 추출물 처리군에서는 각 농도별로 119.80, 107.94, 96.50 pg/mL로 과산화수소 단독 처리군 대비 5α-reductase가 각각 3.20, 12.78, 22.03% 감소하였다. Aromatase의 경우에는, 무처리군에서는 179.61 pg/mL를 나타냈지만, 과산화수소 단독 처리군에서는 487.11 pg/mL로 271.19% 증가하였다. 코끼리마늘 추출물 처리군에서는 각 농도별로 400.33, 320.16, 253.91 pg/mL로, 과산화수소 단독 처리군 대비 aromatase가 각각 17.81, 34.27, 47.87% 감소하였다.
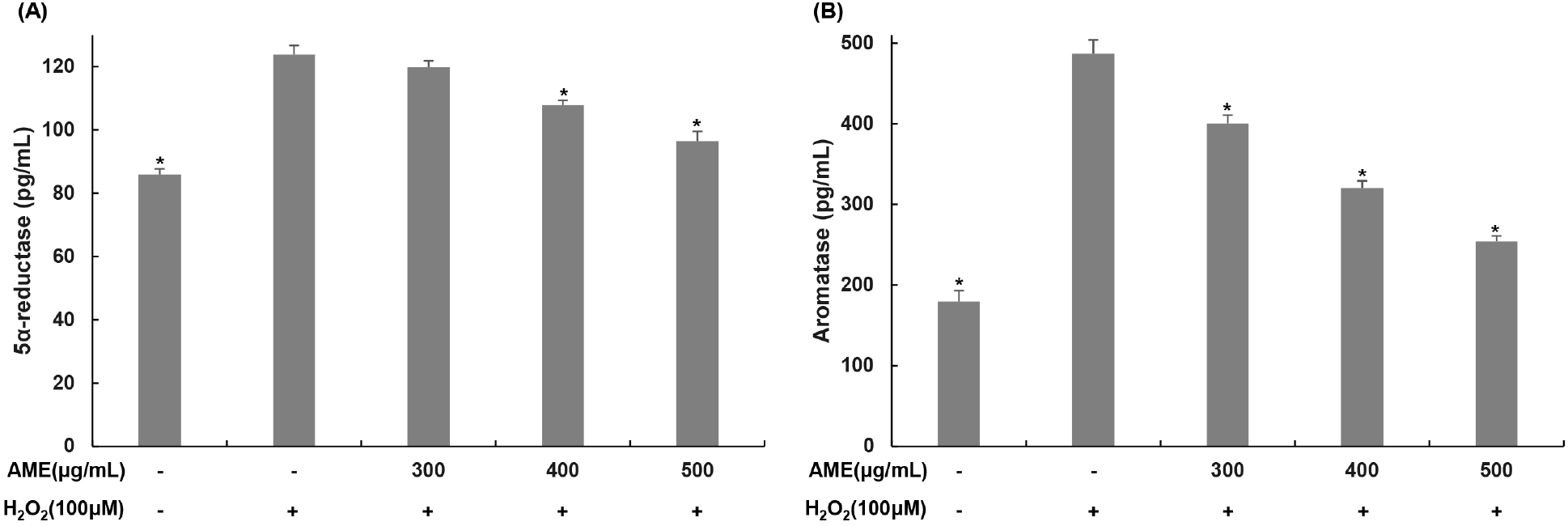
Byun 등(2019)은 과산화수소에 의한 테스토스테론 합성 효소의 감소와 분해 효소의 증가로 테스토스테론의 생성이 감소되었지만, 비수리 추출물에 의해 테스토스테론 합성 효소의 증가와 분해 효소의 감소를 유도하여 테스토스테론의 합성이 증가함을 보고하였으며, 본 연구 결과와 유사한 결과를 나타내었다. 따라서 코끼리마늘 추출물은 과산화수소에 의한 산화적 스트레스에 의해 감소된 테스토스테론 합성 효소들을 증가시킬 뿐만 아니라, 산화적 스트레스에 의해 증가되었던 테스토스테론 분해 효소들을 감소시켜 과산화수소에 의해 감소 되었던 테스토스테론의 생성을 증가시키는 것으로 판단된다.
콜레스테롤은 CYP11A1에 의해 pregnenolone으로 합성되며, pregnenolone은 endoplasmic reticulum으로 이동하여 CYP17A1, 3β-HSD, 17β-HSD 등과 같은 테스토스테론 합성 효소에 의해 분해되면서 테스토스테론이 합성된다. 코끼리마늘 추출물이 TM3 Leydig 세포에서 테스토스테론 합성과 관련된 효소의 유전자 발현 변화에 미치는 영향을 확인한 결과, 과산화수소 단독 처리에 의해 CYP11A1, 3β-HSD, 17β-HSD 발현이 무처리군 대비 각각 65.37, 89.19, 49.51% 발현이 감소하였지만 코끼리마늘 추출물을 농도별로 처리하였을 때, 과산화수소 단독 처리군 대비 CYP11A1은 125.22, 176.20, 233.93%, 3β-HSD는 233.97, 521.12, 571.98%, 17β-HSD는 82.54, 105.37, 136.50% 발현이 증가하였다(Fig. 6(A)).
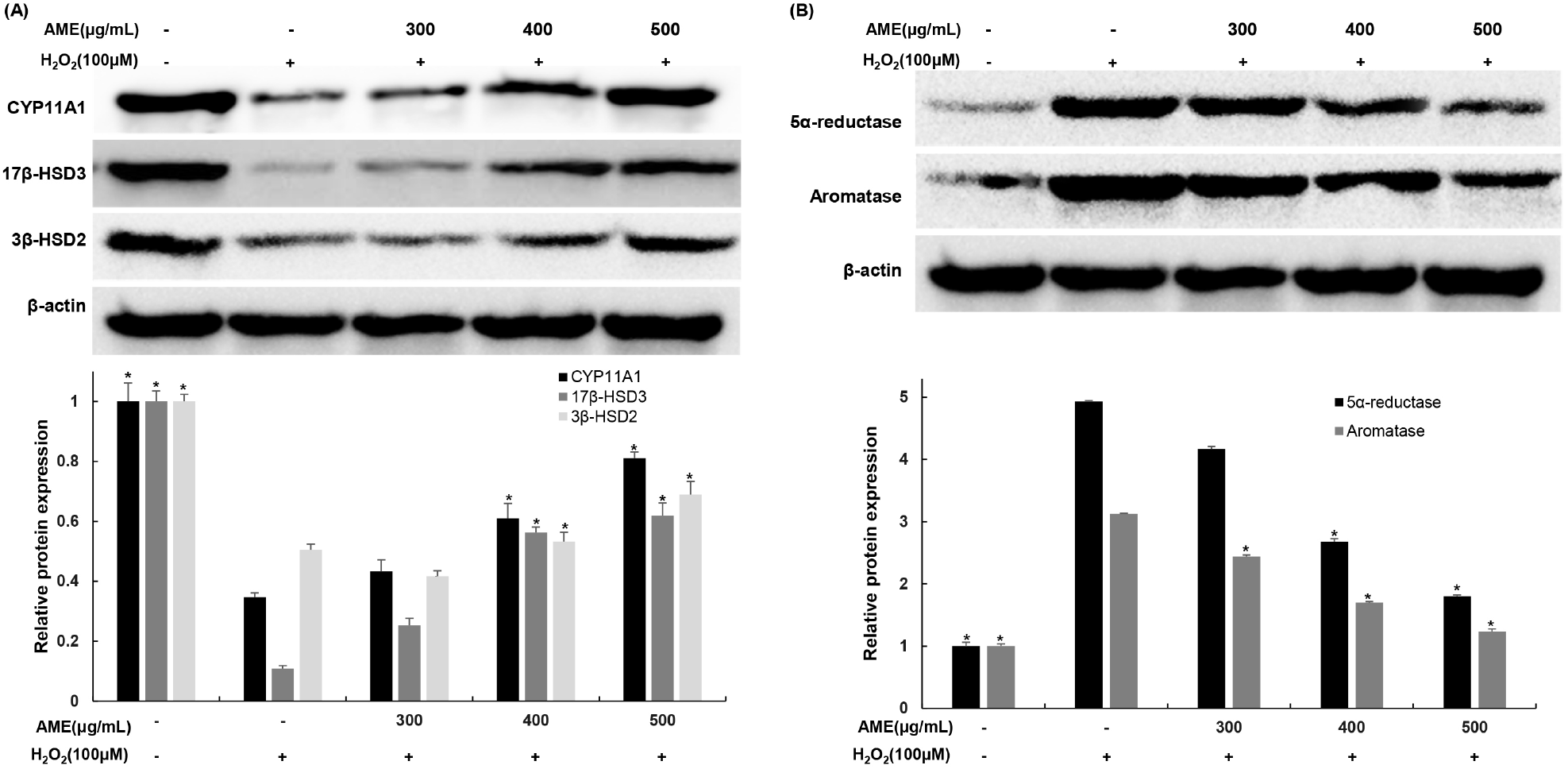
5α-Reductase2 및 aromatase는 테스토스테론을 분해하여 DHT와 estradiol로 전환한다. 코끼리마늘 추출물이 TM3 Leydig 세포에서 테스토스테론 분해와 관련된 효소의 유전자 발현 변화에 미치는 영향을 확인하기 위해 테스토스테론 대사과정에서 테스토스테론 분해 효소로 작용하는 5α-reductase, aromatase의 발현량을 확인한 결과, 무처리군에 비해 과산화수소 단독 처리군은 각각 493.08, 312.72% 발현이 증가하였다. 코끼리마늘 추출물을 농도별로 처리하였을 때, 과산화수소 단독 처리군 대비 5α-reductase는 15.43, 45.72, 63.47%, aromatase는 21.97, 45.68, 60.59% 발현이 감소하였다(Fig. 6(B)). 이러한 결과들을 통해 코끼리마늘 추출물은 테스토스테론 합성 효소의 유전자 발현과 테스토스테론 분해 효소의 유전자 발현을 조절하여 과산화수소에 의해 감소된 테스토스테론의 생성을 증가시키는 것으로 판단된다. 이는 Kim(2020)의 연구와 유사한 결과를 나타내는데, 석창포 에탄올 추출물을 이용한 남성 갱년기 모델 연구에서 추출물의 처리는 테스토스테론 합성 효소 발현을 증가시키고 분해 효소 발현을 감소시킴으로써 테스토스테론 생성이 증가한다고 보고하였다.
이상의 결과로부터 코끼리마늘 추출물이 과산화수소 처리로 산화적 스트레스를 유도한 TM3 Leydig 세포의 세포 생존율을 증가시키지는 못하였지만, 테스토스테론 합성 효소의 생성을 증가시키고 테스토스테론 분해 효소의 생성을 억제하여 최종적으로 테스토스테론의 생성을 증가시키는 효과가 있는 것으로 판단된다. 이를 통해서 코끼리마늘 추출물은 테스토스테론 감소에 의해 나타나는 남성 갱년기 증상 개선을 위한 기능성 소재로서 활용 가능할 것으로 여겨지며, 이후 동물 실험을 통한 추가 연구와 테스토스테론과 관련된 기전에 대한 추가적인 연구가 필요하다고 여겨진다.
4. 요약
본 연구에서는 코끼리마늘 추출물이 과산화수소를 이용하여 산화적 스트레스를 유도한 TM3 Leydig 세포 내 테스토스테론 생성에 미치는 영향을 확인하고자 수행하였다. 과산화수소로 산화적 스트레스가 유도된 TM3 Leydig 세포에 코끼리마늘 추출물을 처리하여 세포 생존율에 영향을 미치지 않는 것으로 나타났다. 테스토스테론은 과산화수소 처리에 의해 감소하였지만 코끼리마늘 처리에 의해 증가함을 확인하였다. 또한, 테스토스테론 합성과 분해에 관여하는 효소의 발현에 미치는 영향을 확인한 결과, 테스토스테론 합성에 관여하는 CYP17A1, 3β-HSD, 17β-HSD는 과산화수소 처리에 의해 감소하였지만 코끼리마늘 처리해 의해 발현이 증가하였고, 테스토스테론 분해에 관여하는 5α-reductase와 aromatase는 과산화수소 처리에 의해 증가하였지만 코끼리마늘 처리에 의해 발현이 감소하였다. 이 결과를 통해서 코끼리마늘은 산화적 스트레스에 의해 감소된 TM3 Leydig 세포의 세포 생존율 회복에는 영향을 미치지 못하였지만, 테스토스테론 합성에 관여하는 효소를 증가시키고 반대로 분해에 관여하는 효소를 감소시킴으로써 산화적 스트레스에 의해 감소되었던 테스토스테론의 전체 생성을 증가시키는 것으로 여겨진다. 이러한 결과를 바탕으로 코끼리마늘 추출물은 테스토스테론의 생성 증가를 통해서 남성 갱년기 증상 개선을 위한 기능성 소재로서 활용 가능할 것으로 판단된다.
