1. 서론
누룩은 우리나라의 대표 전통주를 만드는 데 사용되는 발효제로, 파쇄한 보리와 밀 등의 곡류를 이용하여 빚은 후, 종균을 인위적으로 첨가하지 않고 원료나 공기 중에 유입된 곰팡이, 효모 등의 자연 미생물을 주로 이용하여 발효된다(Kim 등, 2020). 따라서 제조 지역과 온도, 원료 같은 다양한 환경요소에 영향을 많이 받으며, 그에 따라 미생물의 다양성이 결정된다. 누룩에는 곰팡이, 효모, 유산균 등 다양한 미생물이 공존하고 있으며, 그중 누룩에서 가장 많이 분리되며 우점하는 곰팡이는 Aspergillus oryzae와 Rhizopus oryzae이다. 또한, Aspergillus niger,Aspergillus luchuensis와 Rhizopus delemar, Rhizopus oryzae, Lichtheimia ramosa, Mucor circinelloides 등의 접합균류, Aspergillus flavus와 일부 Penicillum 속 등의 유해 곰팡이 등이 다양하게 포함되어 있다(Song 등, 2013). 발효식품에서 곰팡이는 alpha-amylase와 glucoamylase 등 다양한 전분 분해효소를 분비하여 곡류를 당화하며, 분해된 당류는 효모가 알코올을 생산하는 데 사용되므로, 지금까지 대부분 액화력과 당화력 등이 높은 곰팡이의 전분 분해 효소 활성에 대해 집중되어 연구되었다(Baek, 2010; Mun, 2017). 최근에는 곰팡이의 효소활성뿐만 아니라, 항당뇨활성(Agrawal, 2021; Ye, 2021)과 항염증효과(Pan, 2021; Wang, 2021; Xu, 2021), 항균효과 및 항산화(Quang, 2020), 항암(Tian, 2021) 등 생리기능적 활성에 대한 연구들도 많이 보고되고 있으나, 주로 비식품 유래의 곰팡이거나 곰팡이 유래의 2차 대사산물을 분리하여 구조, 작용기작 등을 분석한 연구가 보고되었다. 따라서 본 연구에서는 각 지역에서 수집된 전통 누룩에서 분리한 곰팡이 자체의 생육특성과 환경적응성을 파악하였으며, 곰팡이 배양액을 이용하여 항균, 항염증, 항당뇨, 항고혈압 등의 특성을 규명하고, 식품을 비롯한 다양한 산업에서 그 활용가능성을 높이고자 하였다.
2. 재료 및 방법
각 지역별 양조장, 누룩 제조사에서 수집한 누룩 1 g을 10 mL 멸균 식염수에 현탁한 후 상등액을 적절히 희석하여 potato dextrose agar(PDA, BD, Franklin Lakes, NJ, USA)에 도말하였다. 이후 30°C에서 3-4일 동안 배양하고 단일 콜로니를 계대하는 과정을 반복하여 곰팡이를 순수분리하였다. 분리된 곰팡이의 부분 동정을 위해 18S rDNA는 NS 1(5'-GTA GTC ATA TGC TTG TCT C-3')과 NS8(5'-TCC GCA GGT TCA CCT ACG GA-3')을 이용하여 PCR 증폭하였으며, ITS region은 ITS1(5'-TCC GTA GGT GAA CCT GCG G-3')과 ITS4(5'-TCC TCC GCT TAT TGA TAT GC-3')를 이용하여 증폭하였다. 염기서열 분석은 Macrogen(Daejeon, Korea)사에 의뢰하여 시퀀싱 결과를 얻었으며, 결정된 염기서열은 GenBank DNA database(http://www.ncbi.nl.gov/BLAST/)를 이용하여 곰팡이를 동정하였다.
곰팡이 생육특성을 확인하기 위하여 배양 온도를 6단계(5, 15, 28, 35, 45, 55°C)로 구분하였고, 생육 pH는 PDA 배지에 1 N HCl과 NaOH를 첨가하여 배지의 pH를 4단계(3, 5, 7, 9)로 조절하였다. Potato dextrose agar(PDB, BD, Franklin Lakes, NJ, USA)에 1.0×106 spore/mL로 포자 수를 맞춘 각 곰팡이 포자액을 100 μL 접종하여, 배양속도에 따라 5-7일간 정치 배양하였다. 배양된 곰팡이는 멸균 생리식염수로 포자를 회수한 후 hemocytometer와 현미경(Axio Imager A2, Carl Zeiss Microimaging GmbH, Gottingen, Germany)으로 포자를 계수하여 최적 생육조건과 특정 조건에서의 내저온성(5, 15°C), 내열성(45, 55°C), 내산성(pH 3, 5)의 환경적응성을 확인하였다.
곰팡이의 당화력은 glucoamylase 활성을 측정하였다. 2% 가용성 전분 용액 1 mL에 0.2 M 초산 완충액 0.2 mL를 넣고 40°C 항온수조에서 5분간 예열한 후에, 곰팡이 배양액 0.1 mL를 넣어 40°C에서 20분간 반응시켰다. 1 N 수산화나트륨 용액 0.1 mL를 첨가해 반응을 정지시킨 후, 30분간 방치하였다가 1 N 염산 용액 0.1 mL를 넣어 중화시켰다. 중화된 반응액 50 μL를 반응액 150 μL와 96-well plate에 넣고 540 nm 파장에서 흡광도를 측정하였다. 0.2 M 초산 완충액은 0.2 M 초산 용액과 0.2 M 초산나트륨 용액을 1:2로 혼합하고, pH를 5.0으로 맞추어 제조하였다. 1 mg/mL 포도당 용액으로 표준곡선을 작성하여 포도당을 정량하였으며, glucose assay kit(Sigma-Aldrich Chemical Co., St. Louis, MO, USA)를 이용하여 시료 중에 생성된 포도당을 분석하였다. Glucoamylase 활성은 40°C에서 20분간 가용성 전분으로부터 1 mg의 포도당을 생성하는 배양액 1 mL의 활성을 1 unit으로 정의하여 아래와 같이 계산하였다.
곰팡이의 항균효과를 알아보기 위하여 항균활성 대상 균주로 그람양성(Bacillus cereus, Staphylococcus aureus)과 그람음성(E. coli O157:H7, Salmonella typhimurium)의 식중독 유발 세균 4종을 사용하였다. 2가지 미생물을 공동 배양하여 특정 미생물의 생육저해를 확인하는 co-culture법(Lee 등, 2010)을 변형하여, 곰팡이 배양액과 유해 세균을 혼합 배양하였다. 곰팡이는 PDB에 포자액 5%(v/v)를 접종하여 30°C에서 48시간 동안 배양한 후, 1.0×106 spore/mL로 포자 수를 조절하여 실험에 사용하였다. 4종의 유해 세균은 각각 흡광도 600 nm에서 0.5 수준으로 맞춰 실험에 사용하였다. Tryptic soy broth(BD, Sparks, MD, USA)에 균액을 1%(v/v) 접종하여 30°C에서 24시간 배양하고, 각 곰팡이 배양액을 1%(v/v) 추가 접종하여 37°C에서 24시간 동안 공동 배양하였다. 배양 후에는 멸균 수로 일정한 비율로 희석해 tryptic soy agar(BD, Sparks, MD, USA)에 배양하여, 아래의 식과 같이 무처리군 대비 유해세균의 생장 저해율로 항균활성을 나타냈다.
Cushman과 Cheung(1971)의 방법을 일부 변형하여, hippuryl-L-histidyl-L-leucine을 기질로 안지오텐신 전환효소(angiotensin converting enzyme, ACE) 저해 활성을 측정하였다. 포자 수를 1.0×106 spore/mL로 조절한 곰팡이 포자액을 PDB 배지에 5%(v/v) 접종하여 28°C에서 7일간 배양한 후, 원심분리한 상층액을 분석 시료로 사용하였다. ACE 활성억제율은 ACE inhibition screening kit(Kamiya Biomedical Company, Seattle, WA, USA)를 사용하여 제조사의 manual procedure에 따라 측정하였다. 아래 식으로 계산하고 양성대조군 1% captopril (Sigma, St. Louis, MO, USA)의 값을 100% 비율로 환산하여 상대적 활성을 나타냈다.
A1: Positive control 흡광도(no ACE inhibition)
A2: Reagent blank 흡광도
AS: Sample의 흡광도
혈전용해효소 활성은 일부 변형된 Ehrlich(1987)의 방법을 이용하여 tyrosine 정량법으로 측정하였다. 곰팡이 배양 조효소액은 1.0×106 spore/mL로 조절한 곰팡이 포자액을 PDB 배지에 5%(v/v) 접종하여 5일간 shaking incubator (28°C, 180 rpm)에서 배양한 후, 원심분리하여 사용하였다. Fibrinogen(Sigma, St. Louis, MO, USA)을 0.6% (w/v)로 용해하고, 곰팡이 배양 조효소액을 넣어 37°C에서 10분간 반응시켰다. 0.4 M trichloroacetic acid로 반응을 정지시키고 10분간 실온에 방치한 후, 반응 여과액에 0.4 M Na2 CO3와 1 N Folin reagent를 넣고 660 nm에서 흡광도를 측정하였다. 1 mg/mL tyrosine 표준곡선에 측정된 흡광도값을 대입하여 유리 tyrosine 양을 계산하였다. 최종적으로 양성대조군 plasmin(1 U/mL)을 사용하여, 곰팡이의 상대적 혈전용해 효소활성을 나타냈다.
곰팡이별 항당뇨 활성을 검토하기 위해 곰팡이 배양액의 α-amyloglucosidase 저해 활성을 측정하였다. 50 mM sodium acetate buffer(pH 5.0)로 α-amyloglucosidase를 녹여 1 U/mL로 조정하고, 20 mg/mL의 maltose 용액을 기질로 사용하였다. PDB에 7일간 배양하여 분리한 상등액 곰팡이 조효소액 100 μL와 α-amyloglucosidase 100 μL를 넣고 37°C에서 10분간 정치한 후, 동량의 기질을 첨가하여 1시간 동안 반응시켰다. 0.2 M NaOH로 반응을 종결시킨 후에 0.2 M acetic acid를 첨가하여 중화시켰다. 반응액은 glucose assay kit(Sigma, St. Louis, MO, USA)를 이용하여 포도당을 정량하였고, 양성대조군으로 항당뇨물질 0.5%(w/v) acarbose를 사용하여 상대적 효소 저해 활성을 계산하였다.
Mouse macrophage reporter cell line의 Raw blue 264.7 cell(InvivoGen, San Diego, CA, USA)을 구매하여 사용하였고, 배지는 DMEM(Dulbecco’s modified Eagle’s medium, Gibco Laboratories, NY, USA)에 10% heat-inactivated FBS(fetal bovine serum, Gibco, UT, USA), 1% penicillin-streptomycin(Gibco, 10,000 U/mL)을 첨가하여 사용하였다. 곰팡이의 항염증활성은 Hong 등(2021)의 방법을 일부 변형하여 측정하였다. Raw blue 264.7 cell을 2.5×106 CFU/mL 농도로 접종하여 CO2 incubator(37°C, 5% CO2)에서 24시간 배양하고, 1.0×106 spore/mL 곰팡이 멸균 포자액을 250 μL 접종하였다. 염증반응은 내독소인 LPS(lipopolysaccaride, Sigma, St. Louis, MO, USA)를 곰팡이 포자액이 접종된 cell에 처리하여 유도하였고, 24시간 후 배양액을 회수하여 분석시료로 사용하였다. 전염증성 사이토카인 3종 TNF-α(tumor necrosis factor-α), IL-1β, IL-6의 생성량은 mouse uncoated ELISA kit(Invitrogen, CA, USA)로 측정하였다.
3. 결과 및 고찰
각 지역(경기, 전라, 경상, 충청)에서 전통 방식으로 제조된 밀 누룩 6종으로부터 당화력이 우수한 균주를 선발하기 위해 17주 곰팡이를 순수 분리하여 동정하였고, 생육특성과 효소활성의 결과를 Table 1에 나타냈다. 분리된 17주 곰팡이 중 대부분은 28°C 또는 35°C에서 최적생장을 보였다. Mucor circinelloides HN-W와 Rhizopus azygosporus KJ-BF, Lichtheimia ramosa KJ-WF 3주의 털곰팡이는 5-15°C에서 내저온성을 보유하였고, 특히 Lichtheimia ramosa KJ-WF는 45°C 조건에서 내열성을 보였다. Xie 등(2020)에 따르면 활털곰팡이속 Lichtheimia ramosa는 25-45°C의 중고온의 온도조건에서 생육 정도가 양호한 것으로 보고하였는데, 본 연구에서 Lichtheimia ramosa KJ-WF가 35°C(89.6%), 45°C(23.4%) 온도 조건에서 열 안정성을 보유한 것과 유사한 결과로 판단된다. 당화력 평가 지표로서 glucoamylase 활성을 측정하여 누룩에서 분리된 곰팡이 17주의 당화력을 확인한 결과, 11.0-63.2 U/mL로 효소활성은 큰 편차가 확인되었으며, 높은 당화력을 보유한 상위 5주의 곰팡이를 최종 선발하였다. 동정 및 선발된 곰팡이 5주를 대상으로 이후 여러 생리기능적 특성을 평가하였다.
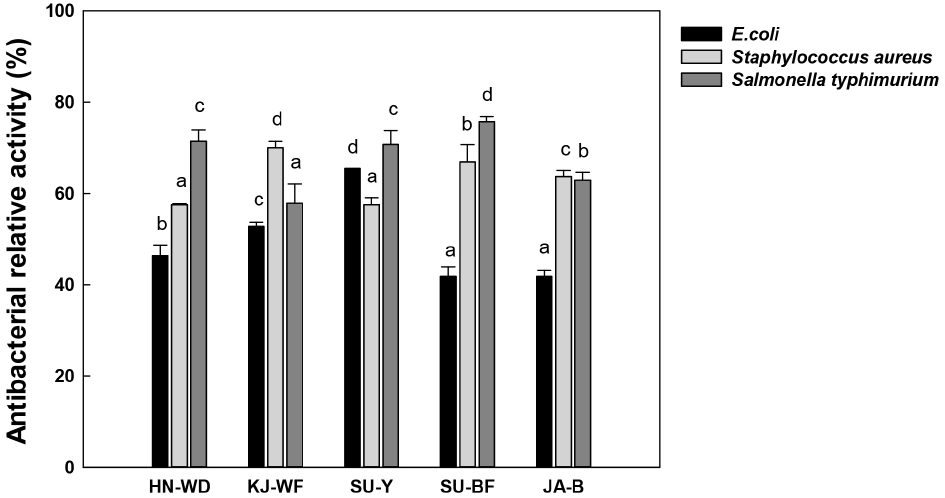
본 연구에서는 곰팡이가 세균의 생육에 미치는 영향을 파악하기 위해 곰팡이와 유해세균을 공동 배양하여 생육 저해 효과를 확인하였다(Fig. 1). E.coli 에 대한 곰팡이의 항균활성은 Aspergillus oryzae SU-Y와 공동 배양하였을 때 65.5%로 가장 높은 생장 저해를 보였다. Staphylococcus aureus에 대한 항균효과는 Lichtheimia ramosa KJ-WF가 가장 높았으며 생육을 70.0% 수준까지 억제하였다. Salmonella typhimurium의 경우, 5주 곰팡이가 59.9-75.7%까지 저해하였으나, Lichtheimia panacisoli SU-BF에 의하여 가장 높은 생육 저해가 확인되었다. 4가지 유해 세균 중에 유일하게 Bacillus cereus에 대한 항균활성이 나타나지 않았는데, Chang과 Chang(2007)에 따르면 B. cereus는 포자 형성을 통하여 다양한 환경에 대한 적응성이 높으며, Oh 등(2012)은 B. cereus를 비롯한 Bacillus 속 세균이 생산하는 항진균성 펩타이드계 저분자 물질이 곰팡이의 생육을 저해한다고 보고하였다. 따라서 유사한 결과로 선발된 5주 곰팡이의 B. cereus에 대한 항균 활성이 확인되지 않은 것으로 사료된다.
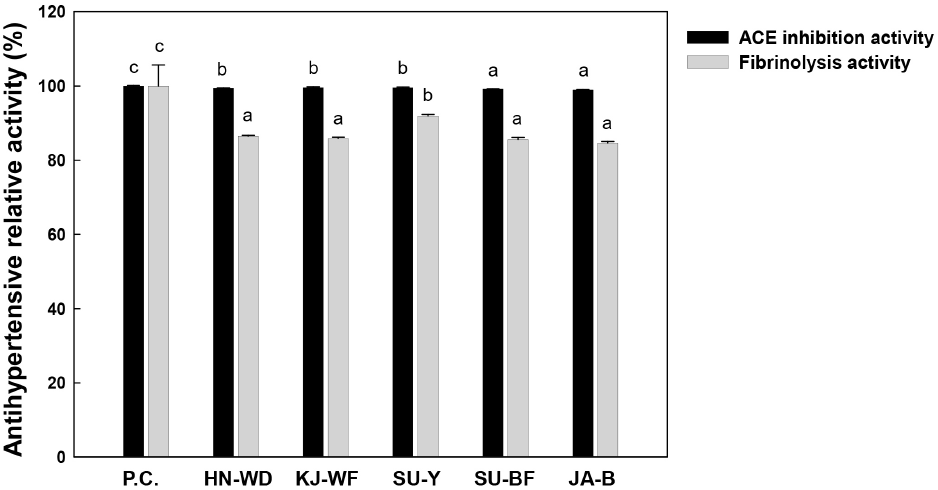
선발된 곰팡이 5주의 조효소액을 이용하여 ACE 저해 활성과 혈전용해효소 활성으로 확인한 항고혈 활성 결과를 Fig. 2에 나타냈다. 고혈압이 발생하는 기작에서 안지오텐신 전환효소(angiotensin converting enzyme, ACE)는 angiotensin-I의 말단에 존재하는 histidine-leusine을 절단하여 angiotensin-II의 분비를 촉진시키고, 결과적으로 알도스테론 분비를 증가시켜 혈압감소 유발 물질을 불활성화시키는 효소로, 고혈압을 유발하는 것으로 보고되었다(Corvor, 1995; Fujita, 2000). ACE 저해 활성을 나타내는 대표적인 물질로는 captopril이 있으며(Vermeirsscna 등, 2002), 선발된 5주 곰팡이의 ACE 저해 활성은 양성대조군(1 mg/mL captpril)과 유사한 높은 활성(98.9-99.6%)을 나타내며, 균주 간에 큰 차이를 보이지 않았다. 혈전용해활성은 피브린을 분해하여 생산되는 티로신을 정량해 나타냈으며, 그 결과를 혈장 속에 있는 단백질 가수분해효소로 fibrin을 분해하는 물질인 plasmin(Gaffney와 Brasher, 1973)을 사용하여 활성을 비교하였다. 곰팡이 5주는 양성대조군(plasmin)의 혈전용해효소 활성과 비교하여 84.7-91.9% 수준으로 비교적 높은 혈전용해활성이 확인되었다. 특히, Aspersillus oryzae SU-Y가 비교물질 활성 대비 91.9%로 가장 높은 혈전용해효소 활성을 나타냈다. 최근 Aspergillus oryzae로 발효한 식품의 항고혈압 효과, 곰팡이 유래 protease를 처리하여 생산된 펩타이드의 항고혈압 활성 등, 생리 기능성 탐색을 위한 유용 곰팡이의 활용성이 점차 증가하고 있다(Mohsen, 2020; Okamoto, 2021). 따라서 본 연구를 통해 곰팡이 배양액의 기능성을 분석하여 발효식품에 적용 가능한 항고혈압 활성 보유 곰팡이를 선발하고 평가하는 방법으로 응용할 수 있을 것이라 기대한다.
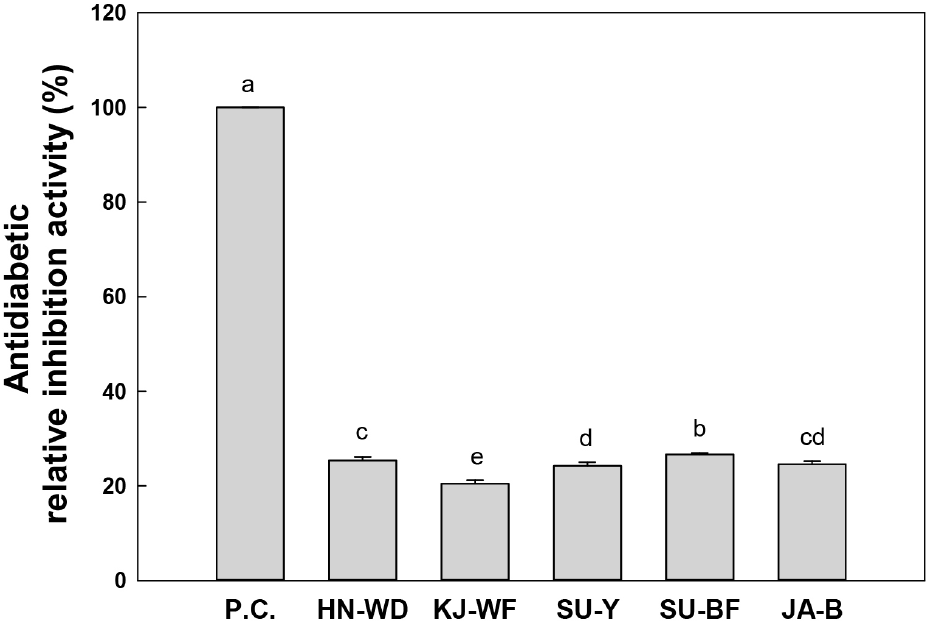
항당뇨활성은 α-1,4 및 α-1,6 glucoside 결합을 가수분해하는 α-amyloglucosidase의 저해 활성으로 측정하여 Fig. 3에 나타냈다. 곰팡이 5주의 항당뇨 활성은 양성대조군으로 사용한 acarbose(100%)의 활성과 비교하여 20.4%에서 26.6% 수준으로 나타났다. 선발된 5주의 곰팡이 중에서 Lichtheimia panacisoli SU-BF(26.4%)의 α-amyloglucosidase 저해 활성이 가장 높은 것으로 확인되었다. α-Amyloglucosidase는 곰팡이 배양 시 세포 외로 분비되는데, 해당 효소의 저해 활성을 분석함으로써 단당류 소화흡수 저해작용으로 식후 혈당상승 억제를 간접적으로 확인할 수 있는 것으로 알려져 있다(Jo 등, 2012). 항당뇨 기능성은 주로 비식품 유래 곰팡이가 생산하는 물질의 특성이 보고되었으나(Hussain 등, 2021), 발효식품에서 발굴한 곰팡이의 항당뇨 활성을 비교한 연구는 보고된 바 없다. 따라서 식품에서 분리한 유용 곰팡이를 식·의약 소재로 활용하여 비만, 당뇨 등의 당질 관련 질환에 생리기능적 효능을 얻을 수 있으므로, 기능성 곰팡이를 지속적으로 발굴하여 균주 안전성과 항당뇨적 활성에 기인하는 물질의 구조, 작용기작 등의 특성을 구명하는 추가적인 연구가 필요할 것으로 생각된다.
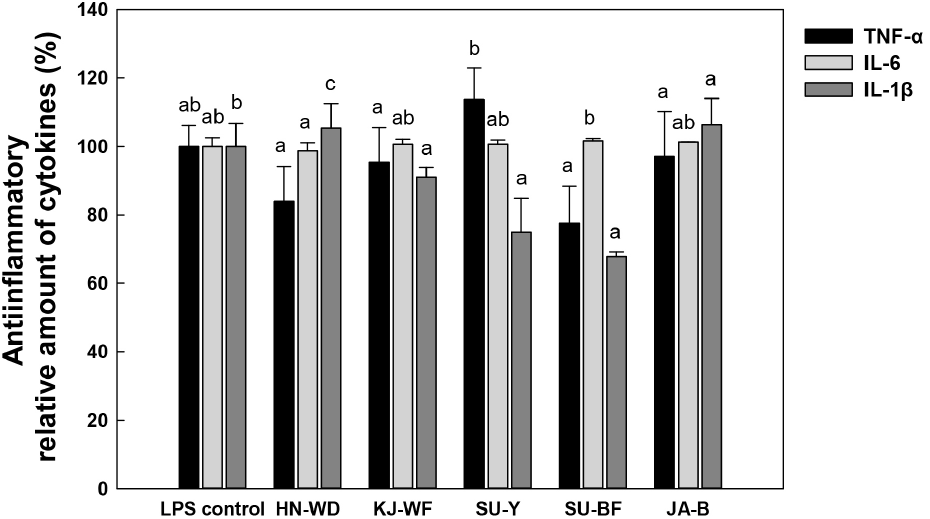
LPS를 처리한 대식세포의 곰팡이 처리군과 무처리군의 사이토카인 함량을 비교하여, 면역억제에 기인하는 곰팡이의 항염증 활성을 Fig. 4에 나타냈다. 체내 염증 발생 시 대식세포는 사이토카인을 생산하여 감염 초기에 생체 방어에 중요한 역할을 하며, LPS로 자극한 마우스 대식세포에서 다양한 염증매개 물질을 생성하는 것으로 보고되어 있다(Mann, 2005; Neuman, 2011; Song, 2013). Aspergillus oryzae SU-Y를 제외한 곰팡이 4주는 LPS 처리 시 TNF-α 생성을 억제하였으며, Lichtheimia panacisoli SU-BF의 TNF-α의 생성량은 무처리군 대비 77.8%로 가장 높은 생성량 감소가 확인되었다. 사이토카인 중 IL-6은 Aspergillus glaucus HN-WD(98.7%) 이외에는 생성량 감소가 확인되지 않았다. 3주의 곰팡이 처리군에서 LPS로 증가한 IL-1β의 생성량이 감소하였으며, 특히 Lichtheimia panacisoli SU-BF는 IL-1β가 비교구 대비 67.9%까지 감소하여 가장 우수한 항염증 활성이 확인되었다. 선발한 곰팡이 5주의 염증성 매개물질 조절 효과를 종합적으로 확인할 때, 분석된 5주 곰팡이 중에서 털곰팡이속 Lichtheimia panacisoli SU-BF의 항염증 효과가 가장 높은 균주로 보인다. 곰팡이 자체의 항염증 효과에 대해 조사된 연구는 없으나, 최근 장류 등 전통 발효식품의 항염증 효과(Kim 등, 2020; Lim 등, 2018)에 대해 폭넓게 연구되고 있으며, 기능성 발효식품에 대한 중요성이 증가하는 가운데, 선발된 5주의 면역억제 조절 효과를 나타내는 곰팡이를 활용한 식품으로서 활용 가능성이 기대된다.