서 론
최근 생활수준이 높아짐에 따라 건강에 대한 관심이 높 아지고 식생활이 개선되어지고 있다. 이에 well-being 산채 의 함유 성분에 생리활성 기능이 밝혀져 국민적 이목이 집중되고 있으며 식품학적, 약리학적으로 가치를 새롭게 인정받고 있다(1). 현재 우리 주변에서 볼 수 있는 천연항산 화제는 Vitamin E, C류, tannin, anthocyanin, tocopherol, carotenoid류, flavonoid류 등이 있으며, 이들은 생체 내에서 노화, 고혈압, 염증, 관절염, 퇴행성질환 및 암을 예방하고 약리학적으로 아주 효과적인 것으로 보고되고 있고(2,3) 식물에서 유래된 페놀 화합물, steroid류, 비타민 등의 천연 항산화제가 활성산소 종에 의한 산화손상에 화학적 예방 촉매기능이 보고됨에 따라 많은 주목을 받아 오고 있다 (4,5,6). 이러한 천연물을 대상으로 성인병의 주된 원인으로 알려져 있는 활성산소 종을 억제하기위해 항산화제에 대한 다양한 연구가 수행되어지고 있고, 특히 동양의학과 대체의학에 대한 관심과 그 가치를 인정받으면서 민간에서 치료 및 예방을 목적으로 사용되어 지는 각종 생약이나 야생 산채류 등 약용식물을 대상으로 연구가 활발히 이루어지고 있다(7,8). 이중 산채류의 경우 일반적으로 현재 100여종이 알려져 있고, 이 안에서는 각종 tannin, alkaloid, saponin, 배당체, flavonoids류가 많이 함유 되어 있어서 특수한 생리 학적 효과의 기능성을 나타낼 가능성이 매우 높다고 조사되 고 있다(9).
취나물은 대부분 국화과에 속한다. 취나물의 종류는 100 여 종인데 우리나라에는 분포되어 있는 것은 60여종으로 24종이 식용으로 가능하며, 한국에서 주로 재배되어지는 취나물은 참취(Aster scaber ), 각시취(Saussurea pulchella), 곰취(Ligularia fischer ), 곤달비(Ligularia stenocephala) 등 이 있다(10). 이 중에서 참취(Aster scaber )는 쌍떡잎식물 합판화군 초롱꽃목 국화과의 다년초로서 지역에 따라 나물 취, 암취, 향소, 동풍채라고도 불리며, 전국의 산지와 들의 초원에서 자라는 취의 일종으로 뿌리잎은 가장자리에 굵은 톱니가 있고 자루가 길고 심장 모양으로 꽃이 필 때쯤에 없어지고, 어린순은 취나물이라 하고 생식하거나 가열 처 리한 나물로 섭취하였으며, 건조한 후 수시로 나물의 원료 로 사용하였고 맛은 대체로 향긋하고 쌉쌀한 특징을 가지고 있다(11,12). 예로부터 동의학사전에서는 황달, 간염, 해독 제거, 혈액순환 촉진, 진통작용, 해소, 소화 장애, 타박상, 장염으로 인한 복통, 풍 제거, 골절의 동통치료에 효능이 있는 것으로 알려져 왔다(13). 한방에서는 진통, 해독의 치 료에 뿌리를 약재로 쓰며, 예부터 인후염, 요통, 두통, 근골 통증, 장염으로 인한 복통 등의 치료에 효과가 있는 것으로 알려져 있다(11). 참취에는 Ca, Fe 및 β-carotene 등이 함유 되어 있으며(11), 약용성분으로는 옹근풀의 경우 다량의 flavonoid 화합물과 saponin을 함유하고 있고, 꽃 이삭과 줄기에는 정유 성분이, 뿌리에는 coumarin, sapogenin, shionon, alkaloid, squalene, friedelin, α-spinasterol 등의 기능 성 성분을 함유하고 있는 것으로 알려지고 있다(14). 또한 참취의 생리활성 연구는 지방대사와 항산화에 미치는 영향 (9), 고지혈증 예방효과와 혈중 콜레스테롤 LDL, VLDL 농도의 저하 및 혈관 내피세포의 변화 지연(15), HMG-CoA reductase 저해활성(16)등이 보고되었다.
사람은 사이가 들어감(aging)에 따라 신체적으로 여러가 지 현상들이 나타나게 된다. 고혈압, 당뇨, 관절염 등 성인병 의 발현과 피부색이 어두워지고 주름이 생기는 등의 피부외 적인 변화를 겪게 된다. 본 연구에서는 참취로부터 phenolic compounds를 추출하여 이러한 노화에 따른 여러 가지 징후 에 대한 anti-aging 효과를 비교, 검토하여 참취 추출물을 성인병예방식품 및 기능성 미용식품 소재로 개발 가능성을 검증하고자 하였다.
재료 및 방법
본 연구에서 사용된 참취(Aster scaber )는 시중에서 생채 를 구입하여 45℃ dry oven(Jeiotech, Daejeon, Korea)에서 건조시킨 후 40 mesh로 분쇄하여 시료로 사용하였다.
생리활성 측정을 위한 추출물의 제조는 물 추출물의 경우 참취 분말 1 g을 증류수 200 mL에 침지하여 추출물이 100 mL가 될 때까지 가열한 후 냉각하여 24시간 동안 교반 추출하였으며, ethanol 추출물은 참취 분말 1 g에 60% ethanol 100 mL를 첨가하여 4℃의 shaking incubator에서 24시간 동안 교반 추출하였다. 각 추출물은 Whatman No. 1 filter paper(Whatman, piscataway, NJ, USA)로 여과한 후 필요에 따라 rotary vacuum evaporator(Eyela NE, Tokyo, Japan)에서 농축하여 시료로 사용하였다.
Total phenolic 정량은 추출물 1 mL에 95% ethanol 1 mL와 증류수 5 mL를 첨가하고 1 N Folin-ciocalteu reagent 0.5 mL를 잘 섞어 5분간 방치한 후 Na2CO3 1 mL를 가하여 흡광도 725 nm에서 1시간 이내에 측정하여 gallic acid를 이용한 표준곡선으로부터 양을 환산하였다(17).
1,1-diphenyl-2-picrylhydrazyl(DPPH) radical에 대한 소거 활성은 Blios의 방법(18)에 준하여 측정하였으며, 전자공여능(%)은 1-(반응구의 흡광도/대조구의 흡광도)×100으로 나타내었다. 2,2'-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) radical cation decolorization(ABTS)의 측정은 Pellegrin 등의 방법(19)에 준하여 측정하였고, 저해율(%)은 1-(반응 구의 흡광도/대조구의 흡광도)×100으로 나타내었다. Antioxidant protection factor(PF)는 Andarwulan과 Shetty의 방법(20)에 준하여 측정하였으며, PF는 반응구의 흡광도/ 대조구의 비로 나타내었다. Thiobarbituric acid reactive substance(TBARs) 측정은 Buege와 Aust의 방법(21)에 준하여 측정하여 저해율(%)은 1-(반응구의 TBARs μM/대조구 의 TBARs μM)×100으로 나타내었다.
ACE 저해효과 측정은 Cushman과 Cheung의 방법(22)에 준하여 측정하였다. 반응구는 0.3 M NaCl을 함유한 0.1 M potassium phosphate buffer(pH 8.3)에 녹인 기질액 2.5 mM hippuryl-L-histidyl-L-leucine(HHL, Sigma-Aldrich Co, Louis, MO, USA) 0.15 mL와 ACE(Sigma-Aldrich Co, St. Louis, MO, USA, 0.25 unit/mL) 0.1 mL와 시료 0.1 mL을 넣고, 대조구에는 시료 대신 증류수를 0.1 mL를 첨가하여 37℃에서 30분간 반응시킨 후 종료시약 1 N HCl 0.25 mL를 가하고 ethyl acetate 3 mL을 첨가하였다. Ethyl acetate에 의해 분리된 이중층 중 상층액만 분취하여 증류 건조시켜 hippuric acid를 추출하고, 추출된 hippuric acid를 2 mL의 증류수를 사용하여 재용해하여 흡광도 280 nm에서 측정하였다. ACE 저해율(%)은 (1-시료의 hippuric acid 함량/대조 구의 hippuric acid 함량)×100으로 계산하였다.
Xanthine oxidase 저해효과 측정은 Stirpe와 Della Corte의 방법(23)에 준하여 측정하였다. 즉, 반응구는 0.1 M potassium phosphate buffer(pH 7.5)에 녹인 기질액 2 mM xanthine 3 mL에 효소액(0.05 U/0.1 mL) 0.1 mL와 시료 0.3 mL를 넣고 대조구에는 시료 대신 증류수를 0.3 mL 첨가하여 37℃에서 5분간 반응시키고 종료시약 20% TCA 1 mL를 가한 후 반응액을 원심분리하여 단백질을 제거하고 생성된 uric acid를 흡광도 292 nm에서 측정하여, 저해율(%) 은 (1-시료의 uric acid 함량/대조구의 uric acid 함량)×100으 로 계산하였다.
Pancreatin α-amylase 저해 효과 측정은 agar diffusion 방법(24)에 준하여 측정하였다. Plate는 5 g의 agar와 5 g의 soluble starch를 증류수에 녹여 끓인 후, 121℃로 15분간 멸균하고 15 mL씩 petridish에 붓고 굳혀 제작하여 사용하였다. 제작한 plate에 지름 10 mm disc paper를 올린 후 시료 액 0.8 mL와 효소액 0.2 mL(1,000 U/mL)를 혼합해 disc paper에 각각 분주하고 대조구에는 시료액 대신 증류수를 넣어 37℃에서 3일간 배양한 후 I2/KI(5 mM I2 in 3% KI) 3 mL를 가하여 15분간 발색시킨 후 다음의 식으로 저해율 (%)은 (1-시료의 clear zone area/대조구의 clear zone area)×100으로 계산하였다.
Tyrosinase 저해효과 측정은 Hearing의 방법(25)에 준하여 측정하였다. 반응구는 0.1 M sodium phosphate buffer(pH 6.8) 2.3 mL와 기질액 1.5 mM L-tyrosine 용액 0.4 mL의 혼합액에 mushroom tyrosinase(Sigma-Aldrich Co., St. Louis, MO, USA, 250 U/mL) 0.1 mL와 시료 0.2 mL를 넣고 대조구에는 시료 대신 증류수를 0.2 mL를 첨가하여 37℃에 서 20분간 반응시켜 흡광도 475 nm에서 측정하여, 저해율 (%)은 (1-시료의 absorbance/대조구의 absorbance)×100으 로 계산하였다.
Elastase 저해효과 측정은 James 등의 방법(26)에 준하여 측정하였다. 반응구는 0.2 M Tris-HCl buffer(pH 8.0) 1 mL 에 기질액 0.8 mM N-succinyl-(Ala)3-ρ-nitroanilide 용액 0.1 mL의 혼합액에 1.0 U/mL porcine pancreatice elastase (PPE)(Sigma-Aldrich Co., St. Louis, MO, USA) 효소용액 0.1 mL와 시료 0.1 mL를 넣고 대조구에는 시료 대신 증류수 0.1 mL를 첨가하여 25℃에서 20분간 반응시켜 ρ -nitroaniline 생성량을 흡광도 410 nm에서 측정하여 저해율 (%)은 (1-시료의 absorbance/대조구의 absorbance)×100으 로 계산하였다.
결과 및 고찰
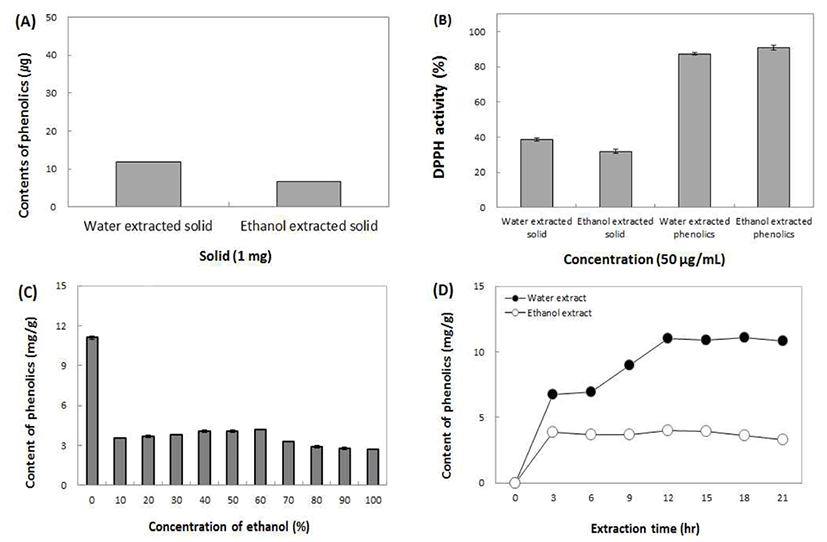
참취 추출물의 고형분에 함유된 phenol성 화합물들의 함량은 Fig. 1A에서와 같이 12 μg/solid 1 mg정도의 매우 낮은 함량을 나타내었으며, phenolic 화합물 함량이 낮은 고형분의 생리활성 역시 동량의 phenolic화합물에 비해 매 우 낮은 수준으로 나타났다(Fig. 1B). 따라서 참취 추출물이 나타내는 생리활성은 추출물에 함유되어있는 phenolic 화 합물에 의해 효과가 좌우될 것으로 판단되었다. 앞의 결과 에 근거하여 참취로부터 생리활성에 관여하는 phenolic 화 합물을 추출하기 위하여 phenolic을 보다 효율적으로 추출 할 방안을 확립하기 위하여 인체에 유해하지 않은 용매로 물과 에탄올을 선택하여 추출 시간, 용매의 농도에 따라 추출되는 phenolic 화합물의 함량을 측정하였다.
과실과 채소에 함유되어 있는 phenol성 물질들, flavonoid 등의 물질들은 유해한 활성산소종에 대해 보호 작용이 있는 다수의 항산화물질을 함유하고 있고, 항산화, 항염, 항암 등의 만성질환에 유효한 효과를 나타내는 것으로 보고되어 있다(27,28). 따라서 ethanol을 다양한 농도로 사용하여 추출하여 phenolic의 함량을 측정한 결과 Fig. 1C에서와 같이 물추출물이 phenolic의 함량이 가장 높게 나타났으며, ethanol은 농도 간 유의적 차이를 거의 나타내지 않았다. 이러한 결과는 phenol성 물질의 용출에 미치는 polarity의 차이에 기인한 것으로 추측되며 향후 검토해 보아야 할 사항으로 생각되었다. 상대적으로 60% ethanol을 추출 용매 로 사용한 실험군의 phenolic 함량이 다른 농도의 추출물에 비해 상대적으로 다소 높게 나타나 향후 실험에서는 물추출 물과 60% ethanol 추출물을 연구시료로 이용하였다. Phenolic성 화합물의 추출을 위한 최적 추출 시간은 Fig. 1D에서와 같이 물 추출물이 12시간, 60% ethanol 추출물이 3시간에서 높은 용출량을 나타내었다. 위의 결과에 따라 생리활성 효과에 대한 기능성 탐색을 위하여 참취 추출물을 건강기능성 식품에 적용하기 위해 물과 60% ethanol 추출물을 용매로 사용하여 각각 15시간과 3시간 동안 추출 후 생리활성 효과를 측정하였다.
DPPH radical법은 일종의 전자공여능을 측정하는 방법 으로 DPPH는 불안정한 상태로 있는 hydrazyl의 질소원자가 쉽게 수소원자를 받아들이는 성질을 가지고 있어 항산화 성 물질과 반응하여 수소원자를 받아들여서 자체의 정색성 을 잃게 되는 성질을 이용하여 항산화능의 정도를 측정할 수 있게된다(29). 참취 추출물을 이용하여 전자공여능을 측정한 결과 Table 1에서와 같이 50~200 μg/mL의 phenolic 화합물 농도 범위에서 대조구인 BHT는 51.83~75.88%의 전자공여능을 나타내었으나, 물 추출물의 경우 87.47~ 90.62%의 전자공여능을, ethanol 추출물에서 90.71~93.13% 의 전자공여능을 나타내었다. 물추출물이 ethanol 추출물에 비해 상대적으로 phenol성 화합물의 함량이 높으나 항산화 측정을 위한 시료 제조시 phenol 함량을 50~200 μg/mL으로 동일하게 조절한 결과 물추출물과 ethanol 추출물의 전자공 여능이 비슷한 결과를 나타낸 것으로 판단되며, ethanol 추출물이 물추출물보다 상대적으로 전자공여능이 다소 높게 나타난 것은 각 추출물에 함유되어있는 phenolic의 profile 이 다르기 때문으로 추측되었다. Kim 등(30)은 하고초 (Prunella vulgaris) 추출물의 항산화 측정 결과, 열수 추출물과 ethanol 추출물에서 각각 79%, 75%의 전자공여능을 나타낸다고 보고한 것과 비교하면 참취 추출물의 전자공여능이 더 우수한 효능을 가진 것을 알 수 있었다. 혈장에서 ABTS는 metmyoglobin이 과산화수소에 의해 활성화 되어 ABTS+을 형성한다. ABTS assay는 ABTS와 potassium persulfate와 반응하여 파랑/녹색의 ABTS+을 형성하고 항산 화제 존재 시 ABTS+이 소거되는 정도를 분석하는 방법 (31,32,33)으로 ABTS를 측정한 결과 Table 1에서와 같이 대조 구인 BHT는 200 μg/mL에서 85.53%의 ABTS저해능을 나타내었으나, 참취 추출물은 물 추출물과 ethanol 추출물 모두 저 농도의 50 μg/mL에서 99.0, 98.8%의 높은 활성을 나타내 었다. 이러한 결과로 보아 참취 추출물은 수용성 항산화제 인 vitamin C와 같이 수용성 부분에서 활성산소와 반응하여 이를 불활성화 시키고, 수용액상에서 +3가 철분(Fe3+)을 +2가 철분(Fe2+)으로 환원시켜 지방질을 과산화 시키는 효소인 lipoxygenase의 활성을 저하시켜 준 것을 알 수 있었다. 참취 추출물의 antioxidant protection factor의 차이를 측정한 결과 Table 1에서와 같이 대조구인 BHT는 1.92~2.46 PF를 나타내었으나, 물 추출물의 경우 1.14~1.87 PF를, ethanol 추출물은 1.28~2.22 PF의 항산화능을 나타내어 대조구인 BHT와 유사한 효능을 나타내는 것으로 확인되었다. 참취 추출물의 thiobarbituric acid reactive substance를 측정한 결 과 Table 1에서와 같이 대조구인 BHT는 97.77~97.66%의 높은 항산화력을 나타내었고, 물 추출물과 ethanol 추출물 도 50 μg/mL의 저농도에서 각각 95.1%, 96.7%의 높은 저해력을 나타내어 지용성 물질에 대한 항산화력도 매우 높은 것을 확인할 수 있었다. 위의 결과로 보아 참취 추출물은 수용성 및, 지용성 항산화에 높은 효능을 나타내었고, 추출물의 phenolic 화합물에 농도 의존적인 양상 효과를 나타내는 것으로 확인되었다.
Angiotensin converting enzyme(ACE)은 renin에 의하여 생성된 angiotensin I으로부터 C-말단 dipeptide(His-Leu)를 가수분해 시킴으로서 강력한 혈관수축작용을 나타내는 angiotensin II를 생성하여 고혈압의 원인이 되고 있다(34). 참취 추출물의 ACE 저해 활성을 측정한 결과 Table 2에서 와 같이 ethanol 추출물이 물 추출물에 비해 저해율이 상대 적으로 높게 나타났으며, 50~200 μg/mL의 phenolics 농도 범위의 물 추출물에서 28.0~50.8%의 저해율을 나타내었고, ethanol 추출물에서 60.8~69.4%의 ACE 저해율을 나타내어, 혈압약으로 쓰이고 있는 Captopril과 유사한 ACE 저해 효과를 나타내었다. Jo와 Cho(35)는 오가피 열매(Acanthopanax fruit) 추출물의 phenolic 화합물이 200 μg/mL의 phenolics 농도에서 물 추출물과 ethanol 추출물이 59.5, 85.1%의 ACE 억제력을 나타내었다고 보고한 것과 비교해 참취 추출물의 고혈압억제력이 비슷한 것으로 판단되어, 향후 renin angiotensin system에 의한 고혈압억제를 위한 예방 또는 치료기능을 활용한 기능성 식품 등에 활용할 수 있을 것이라 판단되었다.
Xanthine oxidase(XOase)는 purine 대사에 관여하는 효소 로서 xanthine 또는 hypoxanthine의 산소를 때어내면서 과산 화수소(H2O2)를 생성하게 되고, 나머지 골격이 uric acid를 형성하여 혈장 내에 과량 존재하게 되면 신장에 침착되어 신장질환을 일으키고, 골절에 축적되어 심한 통증을 유발하는 통풍 효소로 알려져 있다(34). XOase 저해활성 측정은 대조구로 allopurinol을 사용하였으며 참취 추출물과 농도 별로 비교하였다. 참취 추출물의 XOase 저해 활성을 측정 한 결과 Table 3에서와 같이 물 추출물이 ethanol 추출물에 비해 저해율이 상대적으로 높게 나타났으며, 50~200 μg/mL 의 phenolics 농도 범위의 물 추출물에서 90.9~93.9%의 저해 율을 나타내었고, ethanol 추출물에서 21.9~80.2%의 XOase 저해율을 나타내어, 참취 물 추출물은 저 농도에서도 통풍 억제약제인 allopurinol보다 더 우수한 XOase 저해효과를 나타내었다. Kim 등(36)은 유근피(Ulmus pumila) 추출물의 phenolic 화합물이 200 μg/mL의 phenolics 농도에서 48.1% 의 XOase 억제력을 나타내었다고 보고한 것에 비해 참취 추출물의 통풍억제력이 더 우수하여 통풍 치료제로서 활용이 가능할 것으로 판단되었다.
α-Amylase는 탄수화물의 α-D-(1,4)-glucan 결합을 분해 하는 효소(37)로서 소장에서 음식물 중의 전분을 포도당과 같은 단당으로 분해하여 흡수시킨다. 따라서 소장의 α -amylase를 저해함으로써 포도당의 흡수를 지연시킬 수 있어 α-amylase의 저해활성은 혈당수치 상승억제의 지표로써 사용된다(38). 참취 추출물의 α-amylase 활성저해 효과를 측정한 결과 Table 4에서와 같이 물 추출물에서는 2.0~ 23.8%의 효소 억제 효과를 나타내었으며, 참취 ethanol 추출물은 100~200 μg/mL의 phenolics 농도에서 대조구로 쓰인 acarbose의 20.33~40.03% 억제효과에 비해 상대적으로 우 수한 48.57~88.57%의 높은 억제력을 나타내었다. Lee와 Lee(39)는 phenol성 물질은 여러 식물체에 널리 분포되어 있지만 그들의 함량, 종류, 형태 등이 각각 다르므로, α -amylase 효소 활성의 저해는 polyphenol의 양과 종류에 따 라 달라진다고 하였다. 참취의 각각 추출물에 용해되어 있는 phenolic 화합물 성분과 종류에 따라서 상대적으로 다른 효소 억제력을 보인 것으로 판단되었다.
흑갈색의 색소 melanin은 피부의 melanocyte 세포에서 펩타이드 tyrosinase에 의해 생성되어진다. Tyrosinase는 인체내의 melanin 생합성 경로에서 가장 중요한 초기 속도결정단계인 L-tyrosine에서 L-DOPA를 거쳐 L-dopaquionone 으로의 전환에 관여하는 효소로서, 피부가 자외선에 노출 되었을 때 활성화되어 피부노화가 촉진되며 피부에 암갈색 의 색소물질을 침착하게 하기 때문에 미백 성분의 효과를 평가하는데 널리 이용되고 있다(40). 참취 추출물의 tyrosinase 저해활성을 측정한 결과 Table 5에서와 같이 대조구인 kojic acid는 35.21~77.03%의 억제효과를 나타내었으나, 참취 ethanol 추출물에서는 13.8~24.7% 저해활성을 나타내었고, 물 추출물에서는 15.8~46.9% 저해활성을 나타내어 미백 효과를 위한 기능성 식품으로 활용하기 위해서는 물 추출물이 더 효과적이라고 판단되었다. Jo과 Cho(35)는 오가피 열매(Acanthopanax fruit) 추출물의 phenolic 화합물이 200 μg/mL의 phenolics 농도에서 물 추출물과 ethanol 추출물이 33.7%, 58.8%의 tyrosinase 저해활성을 나타내었다고 보고한 결과에 비해 조금 낮은 활성을 나타내었다.
Elastase는 피부구조와 탄력을 유지하는 역할을 하는 주요 단백질 중의 하나인 elastin을 분해하거나 collagen을 비특이적으로 가수분해하는 효소이다. 피부주름은 연령이 증가함에 따라 collagen 생성 감소 또는 분해속도 증가, 자외선 등에 의해 elastase 활성이 증가되어 생성되는 것으로 알려져 있다(27). 참취 추출물의 elastase 저해 활성을 측정한 결과 Table 6에서와 같이 대조구인 epigallocatechin-gallate 는 55.54~73.25%의 높은 억제효과를 나타내었으나, 참취 ethanol 추출물에서는 물 추출물보다 낮은 활성으로 200 μg/mL phenolics 농도에서 14.4%의 저해활성을 나타냈고, 물 추출물에서는 45.5% 저해활성을 나타내었으며, Cho과 Choi(41)는 감태(Eckloina cava) 추출물을 1 mg/mL phenolics의 농도로 처리했을 때 44%의 elastase 저해 활성이 나타난다고 보고한 것과 비교해 참취 추출물의 elastase 저해활성이 더 우수한 것으로 판단하였다.
이상의 결과로 보아 참취 추출물은 우수한 항산화력, 고혈압억제력, 통풍억제력 등을 활용한 성인병 예방식품에 적용이 가능할 것으로 판단되었으며, 미백효과와 주름개선 효과도 있어 미용식품 활성 소재로서 활용 가능성이 큰 것으로 판단되어 노화로 인해 발생하는 신체 내외의 여러 가지 징후들을 예방할 수 있는 anti-aging 소재로 활용이 가능할 것으로 판단되었다.
요 약
참취로부터 phenolic compounds를 추출 후 항산화 효과, 건강 기능성 식품 및 미용식품 활성을 검정하여 기능성 소재로 활용 가능성을 살펴보았다. 참취에 함유되어 있는 페놀성 물질은 물과 60% ethanol을 용매로 하여 추출하였을 때 각각 11.1 mg/g, 4.18 mg/g 함량을 나타내었다. 추출물의 phenolic 농도를 50~200 μg/mL로 조절하여 DPPH를 측정한 결과, 물 추출물과 ethanol 추출물 50 μg/mL phenolics 농도 에서 각각 87%, 91%였고, ABTS radical decolorization도 50 μg/mL phenolics 농도에서 각각 99%, 99%였다. Antioxidant protection factor는 200 μg/mL phenolics 농도에 서 물 추출물과 ethanol 추출물에서 각각 1.87 PF와 2.22 PF로 측정되었으며, TBARs값은 50 μg/mL phenolics농도에 서 물 추출물이 95%, ethanol 추출물에서 97%를 나타내었 다. Angiotensin converting enzyme(ACE) 저해능은 물 추출물에서 50.8%, ethanol 추출물에서 69.4%의 저해율을 나타내었으며, xanthine oxidase 저해능은 물 추출물은 50 μg/mL phenolics농도에서 91%, ethanol 추출물은 200 μg/mL phenolics농도에서 80%의 높은 효능을 보였다. α-Amylase 저해능은 물 추출물과 ethanol 추출물에서 각각 24%, 89% 로 ethanol 추출물에서 높은 효능을 보였다. Tyrosinase 저해 능을 측정한 결과 물 추출물과 ethanol 추출물에서 각각 47%, 25%의 미백 효과를 나타내었다. Elastase 저해능 측정 결과 물 추출물과 ethanol 추출물에서 각각 46%, 14%로 물 추출물에서 주름 개선 효과가 상대적으로 높게 나타내었다. 이러한 결과로 보아 참취 추출물은 항산화 고혈압억제, 통풍억제, 당분해억제, 미백효과, 주름개선효과 등의 건강 기능성 식품 및 미용식품 활성 소재로서 활용 가능성이 큰 것으로 판단되었다.