ARTICLE
콩 코오지를 이용한 된장의 품질 특성
김도윤, 권동진*
Quality characteristics of Doenjang manufactured with soybean Koji
Do-Yoon Kim, Dong-Jin Kwon*
Department of Food Processing and Distribution, College of Life Science, Gangnung-Wonju National University, Gangneung 201-702, Korea
*Corresponding author. E-mail:
kdj6001@gwnu.ac.kr; Phone: 82-33-640-2965, Fax: 82-33-640-2965
© The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Mar 12, 2013; Revised: Dec 11, 2013; Accepted: Mar 30, 2014
Abstract
This study investigated the quality characteristics and sensory evaluation of Doenjang samples made of soybean koji and prepared with Bacillus subtillus 3-B-1 and/or Aspergillus oryzae 6-M-1 isolated from traditional Meju, to replace the koji with wheat flour. Among the quality characteristics of doenjang during its fermentation at 30°C for 40 days, its moisture decreased by degrees, but its amino-type nitrogen and reducing sugar increased by degrees. The color of the doenjang made of koji and prepared with Aspergillus oryzae 6-M-1 changed more significantly than that of the doenjang with Bacillus subtilis 3-B-1. The viable cell and mold counts increased by degrees during the fermentation. The results of the sensory evaluation of the doenjang made with koji and prepared with Aspergillus oryzae 6-M-1 did not significantly differ from those of the doenjang with Bacillus subtilis 3-B-1 and of the commercial doenjang. These results showed the possibility of preparing doenjang with soybean koji instead of wheat flour koji.
Keywords: Doenjang; enzyme; soybean koji; Bacillus subtillus; Aspergillus oryzae
서 론
콩은 높은 단백질과 지방 함량으로 예로부터 밭에서 나 는 고기로 알려져 있는데, 특히 전통적으로 채식위주의 식 생활을 하는 우리 민족에게는 중요한 필수아미노산과 필수 지방산의 급원식품으로 사용되어 왔다(1). 그 중 장류는 콩을 주원료로 하여 가공한 저장성이 있는 조미식품으로 옛부터 전해 내려온 조미발효식품인 동시에 우리 식생활에 단백질 공급원으로서 전통적인 부식이며, 이중 된장은 전 통적인 맛과 향을 지닌 콩 발효식품으로 탄수화물 원료에 Aspergillus속의 곰팡이를 이용하여 제조한 메주로 만들어 진다(2).
된장은 제조하는 방법에 따라 재래식 된장과 개량식 된 장으로 구분하고 있다. 재래식 된장은 콩을 삶은 후 벽돌 또는 둥근 모양으로 성형한 메주를 짚으로 싸서 일정기간 주위의 미생물을 부착시켜 발효시킨 다음 소금물과 함께 일정기간 숙성시킨 후 액체부분은 간장으로 분리하고 남은 고형분을 말한다. 이에 반해 개량식 된장은 주로 산업적으 로 제조되는 된장으로 콩 대신 밀가루에 황국균을 접종하여 48∼72시간 발효시킨 것, 즉 코오지에 콩, 식염수 등을 함께 첨가하여 일정기간 숙성시킨 것을 말한다(3). 된장의 풍미는 메주나 코오지의 효소활성과 된장 발효에 관여하는 미생물에 의해 가장 큰 영향을 받으며, 이와 함께 담금 원료 의 구성, 숙성 온도 및 기간에 의해 결정된다(4). 된장을 한국 고유의 전통 발효 식품에서 국제적인 식품으로 발전시 키기 위해서는 장류 제조에 적합한 최적의 콩 품종 선발, 장류의 품질에 영향을 주는 미생물의 발효조건 확립으로 표준화된 제품의 생산, 된장의 생리활성 기능성 강화, 기호 성 증대 및 편리성 추구를 통한 소비자 만족도 향상 등 다양한 노력이 요구되고 있다(5).
된장에 대한 연구로는 된장의 발효 중 염 농도가 낮을수 록 관능과 protease 활성이 우수하다는 저염 된장에 관한 연구(4,6), 국내 시판 및 재래된장의 발효 중의 이화학적 특성 및 숙성기간별 세균, 곰팡이 및 혐기성균의 미생물 변화에 대해 분석한 연구(1,7), 혼합 콩과 현미 코오지를 이용하여 생리활성 기능을 함유하는 전통된장을 제조할 때의 이화학적 성분에 관한 연구(5,8), 된장제조 미생물원 을 달리하여 제조한 된장의 숙성중의 질소 성분, 아미노산 조성 및 품질특성에 대한 연구(9-12), 전통메주로부터 분리 한 protease 생성 곰팡이 및Bacillus속 세균을 이용한 된장을 숙성시킬 때 향기 및 항산화성에 미치는 연구(13-15) 등이 있다.
이처럼 된장의 숙성기간 중의 품질특성 변화와 항산화성 등의 기능성에 대한 연구는 많으나 콩 코오지를 이용한 된장 제조 기법을 개발한 연구가 거의 없는 실정이다. 재래 식 된장의 경우 자연적인 발효제품인 메주를 이용하여 된장 을 제조하고 있으나 시판되고 있는 된장은 메주를 사용하지 않고 밀가루 코오지를 이용하여 된장을 제조하기 때문에 전통적인 우리 맛을 재현하기 어려운 문제를 갖고 있다.
따라서 본 연구는 된장제조에 있어서 제조시간이 많이 걸리는 메주 대신 빠른 시간에 제조할 수 있는 콩 코오지를 이용하여 재래식 된장과 같은 향과 맛을 지닌 된장을 제조 하는 것이 가능한 것이지를 알아보기 위해 효소활성이 우수 한 세균과 곰팡이를 종균을 분리하여 밀가루 코오지 대신에 콩 코오지 제조에 이용하여 된장을 제조하는 제조기술을 개발하기 위한 기초자료로 제시코자 한다.
재료 및 방법
재 료
된장제조에 사용된 콩은 강원도 강릉에서 2011년에 구입 한 메주콩을 사용하였고, 식염은 시중에서 구입한 천일염 을 사용하였다. 또한 효소활성이 우수한 균주를 분리하기 위해 전국 35개 지역에서 재래식 메주 41종, 산업적으로 이용되고 있는 코오지 5종을 구입하였다. 관능검사에 사용 하기 위해 시중에서 밀가루 코오지로 제조한 된장을 구입하 였다.
균주분리 및 동정
전국에서 수집한 재래식 메주와 산업적으로 이용되고 있는 코오지 10 g을 0.85% 생리식염수 90 ml에 넣어 30분간 진탕한 후 세균은 plate count agar(PCA)를 사용하여 분리 (16)하였고, 곰팡이는 potato dextrose agar(PDA)를 사용하 여 분리(16)하였다. 육안 및 현미경으로 다른 모양을 지닌 곰팡이 및 세균을 분리하여 amylase 및 protease 등의 효소능 을 측정하여 효소활성이 우수한 균을 분리, 선정 및 동정하 여 본 연구에 사용하였다. 동정은 세균의 경우 API kit를, 곰팡이는 ITS-5.8S rDNA sequencing을 하였다.
코오지 및 된장 제조
콩을 선별하여 침지하고 세척한 다음 증자시킨 콩을 절 구에 빻아 콩의 1/4 정도 크기로 한 다음 재래식 메주에서 분리한 세균인 Bacillus subtilis 3-B-1과 곰팡이인 Aspergillus oryzae 6-M-1을 를 각각 0.1%(w/w)씩 접종한 다음 30°C에서 4일간 배양한 콩 코오지를 Table 1의 비율로 혼합하고 여기에 식염수를 첨가하여 30°C, 65% RH인 항온 항습기(T&H Chamber, AAA84021, Jeio Tech, Seoul, Korea) 에서 40일간 숙성시켜 된장을 제조하였다. 이때 된장의 총 량은 800 g으로 하였으며 식염농도는 12%(w/w)가 되도록 하였고 옹기 항아리에 담아 저장하면서 실험에 사용하였 다.
Table 1.
The mixture ratios of Doenjang made of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1 (unit : %)
|
Samples No |
koji prepared with Bacillus subtilis 3-B-1 |
koji prepared with Aspergillus oryzae 6-M-1 |
|
No. 1 |
100 |
0 |
|
No. 2 |
30 |
70 |
|
No. 3 |
50 |
50 |
|
No. 4 |
70 |
30 |
|
No. 5 |
0 |
100 |
Download Excel Table
성분분석
효소분석에 사용할 조효소액은 시료 5 g을 증류수 100 ml에 현탁하여 실온에서 4시간 진탕한 후 여과한 액을 5°C 이하에 보관하면서 실험에 사용하였다. 효소활성 측정을 위하여 α-amylase의 경우 Kim과 Oh(17)의 방법으로, β -amylase와 protease는 Park과 Oh(18) 및 Kim 등(17,19)의 방법, protease의 역가는 Von(20)의 방법에 준하였다. 수분 은 105°C 상압건조법(21)으로 하였고, 아미노태질소는 Formal 적정법(22)으로 분석하였다. 환원당은 Somogyi법 (23)에 준하여 분석한 후 glucose로 환산하였다. 색도는 시 료를 분쇄한 후 색차계(Colorimeter, CM-3500d, Minolta, Tokyo, Japan)를 이용하여 L, a, b값을 구하였다.
미생물 수
생균수는 plate count agar(PCA) 배지에 시료를 일정 배수 로 조제한 후 접종하여 30°C에서 2일간 배양한 후 계수하였 다. 곰팡이 및 효모 수는 pH 3.5로 조정한 PDA 배지에 접종하여 30°C에서 2∼3일간 배양한 후 계수하였다.
관능검사
관능검사는 10명의 관능검사 요원을 대상으로 맛, 향, 색 및 전체적인 기호도에 대하여 9점 평점법으로, 매우 좋다 9점, 매우 나쁘다 1점으로 실시하였다. 모든 실험의 결과는 평균치와 표준편차로 나타내었으며 통계처리는 SPSS (SPSS Inc. Ver. 12.0, Chicago, IL, USA)을 이용하여 Duncan's multiple range test를 시행하여 p<0.05수준에서 유의성 검정을 하였다.
결과 및 고찰
효소활성이 우수한 균 분리 및 선정
재래식 메주와 산업적으로 이용되고 있는 코오지로부터 효소활성이 우수한 균을 선정하기 위해 α-amylase, β -amylase, 산성 protease 및 중성 protease를 분석한 결과는 Table 2, 3과 같다.
Table 2.
Enzyme activities of bacter ia separated from traditional meju and koji
|
Bacteria No. |
α-Amylase (unit/g)3) |
β-Amylase (unit/g)4) |
Acidic protease (unit/g)5) |
Neutral protease (unit/g)6) |
|
1-B-11) |
572.44 |
2140.38 |
391.76 |
316.46 |
|
2-B-11) |
1487.00 |
1979.85 |
309.15 |
277.62 |
|
3-B-11) |
1646.18 |
3953.13 |
877.56 |
790.08 |
|
4-B-11) |
1030.96 |
480.53 |
477.60 |
391.36 |
|
5-B-11) |
22.80 |
279.87 |
63.09 |
79.54 |
|
6-B-11) |
10< |
1784.98 |
109.98 |
46.56 |
|
7-B-11) |
153.57 |
1039.01 |
255.86 |
200.65 |
|
8-B-11) |
143.56 |
213.99 |
91.61 |
162.10 |
|
9-B-11) |
207.51 |
273.64 |
342.54 |
304.25 |
|
10-B-11) |
884.67 |
2700.44 |
956.55 |
1147.70 |
|
11-B-11) |
10< |
263.24 |
36.24 |
58.42 |
|
12-B-11) |
322.61 |
3097.06 |
1083.38 |
1197.87 |
|
13-B-11) |
842.74 |
574.84 |
103.04 |
94.96 |
|
14-B-11) |
607.57 |
761.57 |
147.56 |
124.13 |
|
15-B-11) |
871.86 |
914.53 |
306.32 |
266.96 |
|
16-B-11) |
170.49 |
283.31 |
84.24 |
108.42 |
|
17-B-11) |
10< |
519.57 |
923.42 |
772.09 |
|
18-B-11) |
10< |
298.00 |
381.38 |
321.77 |
|
19-B-11) |
643.41 |
2321.69 |
255.57 |
591.47 |
|
20-B-11) |
10< |
343.21 |
10< |
58.98 |
|
21-B-11) |
49.61 |
339.28 |
10< |
70.57 |
|
22-B-11) |
85.60 |
378.28 |
72.80 |
86.99 |
|
23-B-11) |
117.93 |
185.30 |
130.28 |
256.24 |
|
24-B-11) |
106.75 |
160.60 |
114.78 |
208.27 |
|
25-B-11) |
348.75 |
1361.44 |
328.20 |
425.34 |
|
26-B-11) |
1073.66 |
2811.27 |
496.08 |
705.44 |
|
27-B-11) |
1426.76 |
3676.80 |
701.19 |
1012.74 |
|
28-B-11) |
464.53 |
1051.49 |
508.43 |
784.85 |
|
29-B-11) |
44.53 |
237.76 |
479.10 |
594.50 |
|
30-B-11) |
382.36 |
330.20 |
66.50 |
126.00 |
|
31-B-11) |
868.31 |
2088.24 |
571.49 |
887.77 |
|
32-B-11) |
63.57 |
210.21 |
62.24 |
112.56 |
|
33-B-11) |
56.69 |
211.93 |
72.80 |
69.91 |
|
34-B-11) |
144.49 |
242.55 |
84.81 |
134.84 |
|
35-B-11) |
57.53 |
153.48 |
27.37 |
70.61 |
|
36-B-11) |
398.72 |
1169.97 |
377.76 |
259.14 |
|
37-B-11) |
157.30 |
1318.95 |
217.28 |
131.68 |
|
38-B-11) |
1008.00 |
3877.63 |
322.35 |
322.66 |
|
39-B-11) |
172.00 |
162.41 |
43.16 |
10< |
|
40-B-11) |
426.38 |
2507.49 |
483.78 |
667.82 |
|
41-B-11) |
68.37 |
223.39 |
281.90 |
469.62 |
|
1-K-B-12) |
398.72 |
1169.97 |
377.76 |
259.14 |
|
2-K-B-12) |
157.30 |
1318.95 |
217.28 |
131.68 |
|
3-K-B-12) |
1008.00 |
3877.63 |
322.35 |
322.66 |
|
4-K-B-12) |
1226.19 |
3173.98 |
433.34 |
593.02 |
|
5-K-B-12) |
521.50 |
1315.60 |
492.48 |
271.18 |
Download Excel Table
Table 3.
Enzyme activities of mold separated from traditional meju and koji
|
Bacteria No. |
α-Amylase (unit/g)3) |
β-Amylase (unit/g)4) |
Acidic protease (unit/g)5) |
Neutral protease (unit/g)6) |
|
1-M-11) |
979.02 |
2851.95 |
441.50 |
372.28 |
|
2-M-11) |
1053.98 |
755.82 |
10< |
29.71 |
|
4-M-11) |
1847.48 |
4950.77 |
21.42 |
84.30 |
|
6-M-11) |
1942.56 |
6324.20 |
326.97 |
296.47 |
|
8-M-11) |
988.42 |
2467.98 |
195.63 |
298.22 |
|
9-M-11) |
183.00 |
913.98 |
42.81 |
143.33 |
|
10-M-11) |
1288.48 |
6220.34 |
1020.75 |
1573.20 |
|
11-M-11) |
70.39 |
2244.77 |
713.28 |
768.37 |
|
12-M-11) |
1912.55 |
6564.33 |
279.03 |
361.12 |
|
13-M-11) |
551.53 |
543.12 |
194.63 |
156.50 |
|
14-M-11) |
234.29 |
1337.09 |
712.04 |
651.98 |
|
15-M-11) |
464.45 |
1714.85 |
440.34 |
638.47 |
|
16-M-11) |
1845.16 |
2317.53 |
218.13 |
269.48 |
|
17-M-11) |
922.91 |
2302.39 |
331.16 |
585.65 |
|
18-M-11) |
1150.39 |
2276.10 |
185.82 |
890.84 |
|
19-M-11) |
47.97 |
284.08 |
10< |
55.80 |
|
20-M-11) |
109.93 |
317.79 |
10< |
52.76 |
|
21-M-11) |
299.93 |
193.47 |
10< |
35.38 |
|
24-M-11) |
34.54 |
200.49 |
42.90 |
61.55 |
|
26-M-11) |
451.99 |
1118.55 |
243.77 |
340.40 |
|
27-M-11) |
533.99 |
1145.04 |
10< |
61.32 |
|
28-M-11) |
335.21 |
538.64 |
73.46 |
135.86 |
|
30-M-11) |
1966.54 |
6856.87 |
41.48 |
189.82 |
|
31-M-11) |
121.42 |
439.71 |
100.98 |
108.97 |
|
32-M-11) |
206.22 |
409.34 |
96.45 |
110.02 |
|
33-M-11) |
227.45 |
305.62 |
25.62 |
94.73 |
|
36-M-11) |
98.76 |
140.96 |
38.27 |
59.06 |
|
37-M-11) |
70.28 |
221.92 |
50.76 |
75.89 |
|
38-M-11) |
162.85 |
268.45 |
10< |
96.67 |
|
39-M-11) |
1486.69 |
3751.83 |
32.25 |
68.64 |
|
40-M-11) |
435.61 |
969.50 |
294.54 |
523.54 |
|
41-M-11) |
15.56 |
389.99 |
114.48 |
138.02 |
|
1-K-M-12)
|
221.88 |
492.44 |
41.77 |
80.58 |
|
2-K-M-12)
|
1815.31 |
6283.04 |
115.32 |
139.49 |
|
3-K-M-12)
|
1486.69 |
3751.83 |
32.35 |
68.64 |
|
4-K-M-12)
|
883.56 |
2810.08 |
250.88 |
304.03 |
Download Excel Table
재래식 메주로부터 총 41종의 세균을 분리하였으며 α -amylase, β-amylase, 산성 protease 및 중성 protease의 평균 활성을 분석한 결과 각각 419.01 unit/g, 1144.43 unit/g, 308.76 unit/g, 359.0 unit/g이었다. 산업적으로 이용되고 있 는 코오지로부터 5종의 세균을 분리하였으며 이들 균주의 평균 α-amylase, β-amylase, 산성 protease 및 중성 protease 역가는 각각 662.34 unit/g, 2171.23 unit/g, 368.64 unit/g 및 315.54 unit/g으로 재래식 메주로부터 분리한 세균의 역가 보다 약간 많은 양이 생성되고 있었다. 재래식 메주와 코오 지로부터 분리한 세균 중에서 효소활성이 가장 높고 산업적 으로 생산하는 코오지로부터 분리한 세균보다 높은 효소활 성을 가진 세균을 우수균주로 하여 선정한 결과 재래식 메주로부터 분리된 3-B-1였으며 이 균주의 α-amylase는 1646.18 unit/g, β-amylase는 3953.13 unit/g, 산성 protease는 877.56 unit/g 그리고 중성 protease는 790.08 unit/g으로 분리 세균의 평균 효소 역가보다 각각 3.0배, 2.4배, 2.6배 및 2.3배 높았다.
재래식 메주로부터 총 32종의 곰팡이를 분리하였으며 α-amylase, β-amylase, 산성 protease 및 중성 protease의 평균 활성을 분석한 결과 각각 688.74 unit/g, 1916.80 unit/g, 241.48 unit/g, 291.51 unit/g이고, 산업적으로 생산되는 코오 지로부터 4종의 곰팡이를 분리하였으며 α-amylase, β -amylase, 산성 protease 및 중성 protease의 평균 활성은 각 각 1101.86 unit/g, 3334.34 unit/g, 110.08 unit/g 및 140.69 unit/g으로 재래식 메주로부터 분리한 amylase는 높은 편이 나 protease는 다소 낮은 편이다. 재래식 메주와 코오지로부 터 분리한 곰팡이 중에서 효소활성이 가장 높고 산업적으로 생산하는 코오지의 생산균보다 높은 효소활성을 지닌 곰팡 이를 우수균주로 하여 선정한 결과 재래식 메주로부터 분리 된 6-M-1였으며 이 균주의 α-amylase는 1942.56 unit/g, β -amylase는 6324.2 unit/g, 산성 protease는 326.97 unit/g 그리 고 중성 protease는 296.47 unit/g으로 분리 곰팡이의 평균 효소 역가보다 각각 2.2배, 2.4배, 1.9배 및 1.4배 높았다. 전체적으로 곰팡이는 세균에 비해 amylase 활성이, 세균은 곰팡이에 비해 protease 활성이 높았다.
이러한 결과는 발효가 진행됨에 따라 전분질의 액화효소 인 α-amylase의 활성이 발효 70일 후 메주 내부는 80.8 unit/g, 외부는 259.8 unit/g 이고, 당화효소인 β-amylase 의 활성은 발효 70일 후 메주 내부는 1.61 unit/g, 외부는 2.38 unit/g 이고, 산성 protease가 101.65 unit/g이었다는 Yoo(7) 등의 결과보다 높았다.
선정된 균주의 동정
Amylase와 protease 등의 효소활성이 우수한 곰팡이 및 세균을 분리, 동정한 결과 3-B-1 세균은 Bacillus subtilis 이었고, 6-M-1 곰팡이는 Aspergillus oryzae 이었다.
이화학적 특성
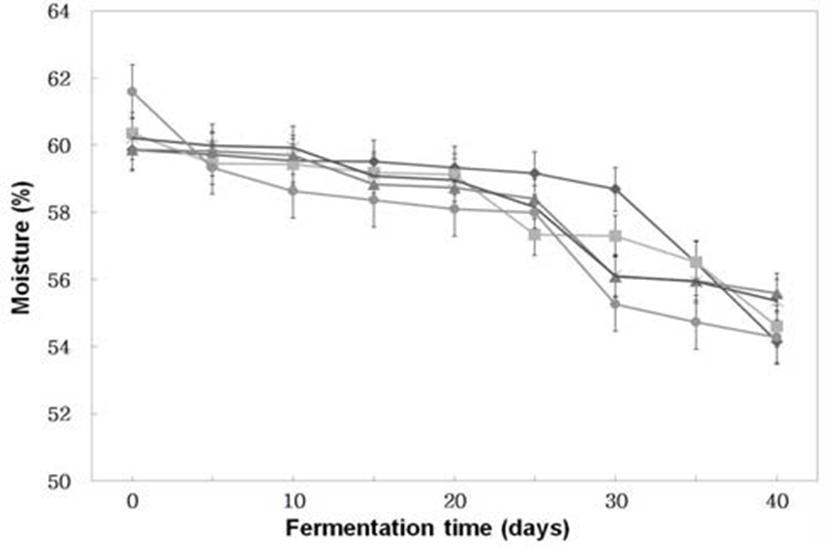
분리, 선정한 A. oryzae 6-M-1과B. subtilis 3-B-1를 이용 하여 코오지를 제조한 후 이들 코오지를 Table 1과 같은 혼합비율로 된장을 제조한 후 30°C, 65% RH의 항온항습기 에서 40일간 숙성시키면서 수분함량, 아미노태질소, 환원 당, 색의 변화를 조사한 결과는 Fig 1∼5와 같다.
Fig. 1.
Changes of moisture of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*- Doenjang made of Koji prepared with Bacillus subtilis 3-B-1 only
-×- Doenjang made of Koji prepared with Bacillus subtilis 3-B-1 and Aspergillus oryzae 6-M-1 (70:30)
-▲- Doenjang made of Koji prepared with Bacillus subtilis 3-B-1 and Aspergillus oryzae 6-M-1 (50:50)
-■- Doenjang made of Koji prepared with Bacillus subtilis 3-B-1 and Aspergillus oryzae 6-M-1 (30:70)
-◆- Doenjang made of Koji prepared with Aspergillus oryzae 6-M-1 only
Download Original Figure
수분 (Fig. 1)은 모든 처리구에서 숙성 40일 동안 약간 감소하고 있었다. 초기 수분함량은 59.86∼61.58%(w/w)로 시료간 큰 차이는 없었으나 모든 처리구에서 숙성 25일째 를 경과하면서 수분함량이 감소하여 숙성 40일경에는 54.15∼55.59 %(w/w)를 나타내었다. 이와 같이 숙성기간 동안 수분이 감소하는 것은 콩 코오지를 제조하는 동안 세균 및 곰팡이에 의한 발열반응으로 사료된다.
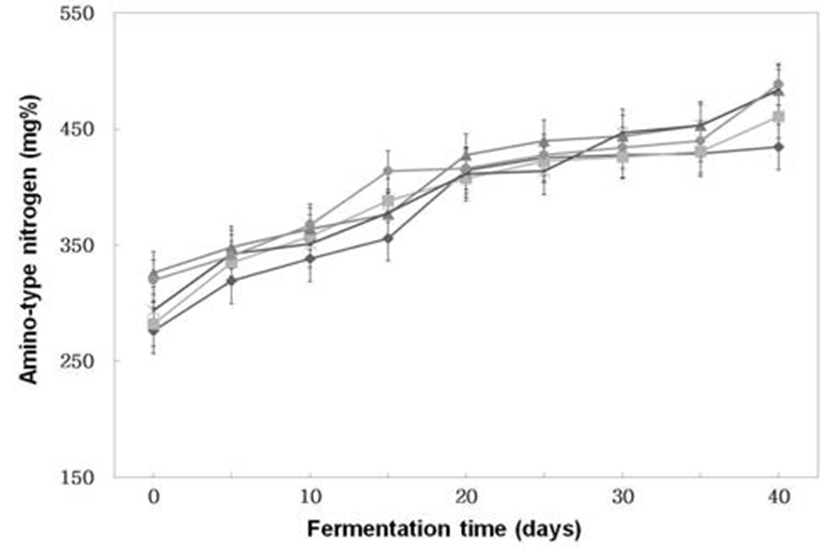
숙성기간 동안 꾸준히 아미노태질소 (Fig. 2)가 증가하고 있었다. 또한 숙성 10일이 경과하면서 전통식품 표준규격 (24)에서 정한 300 mg%(w/w) 이상 생성하여 분리한 세균 및 곰팡이가 콩 코오지 제조에 적합한 균주였다. 숙성 40일 째에는 분리, 선정한A. oryzae 6-M-1으로 제조한 코오지만 을 이용하여 된장을 제조한 것이 434.49 mg%(w/w)로 가장 적게 생성되었고, B. subtilis 6-M-1로 제조한 코오지만으로 제조한 것이 488.72 mg%(w/w)로 가장 많이 생성되었으나 시료간에 큰 차이는 없었다.
Fig. 2.
Changes of amino-type nitrogen of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
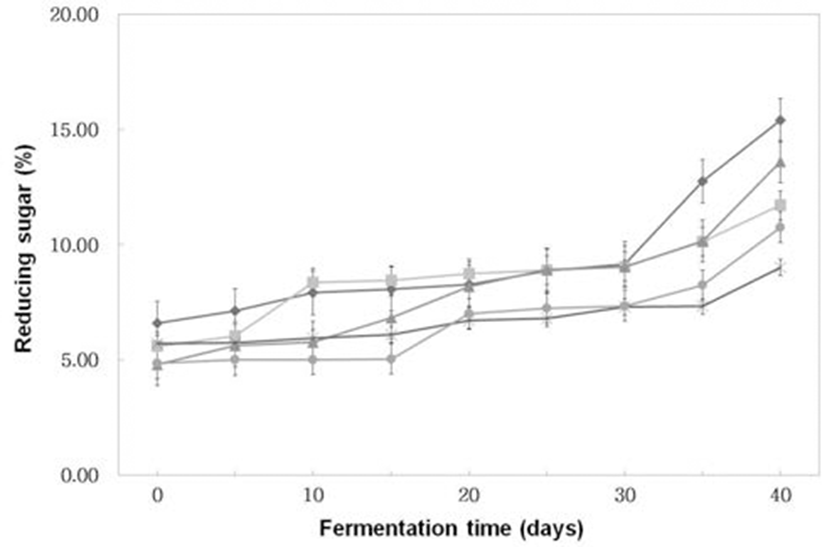
숙성 초기에는 환원당(Fig. 3)이 5%(w/w) 내외에서 숙성 이 경과할수록 점차 증가하는 경향을 보였고 특히 숙성 30일 이후에는 급격히 증가하는 추세였다. 숙성 40일째에 A. oryzae 6-M-1로 코오지를 제조한 후 이를 이용하여 된장 을 제조한 것이 가장 많은 15.40%(w/w)를 생성하였고, A. oryzae 6-M-1과B. subtilis 3-B-1을 30 : 70의 비율로 혼합하 여 제조한 된장이 다른 처리구에 비해 가장 적은 9.01%(w/w)를 생성하여 균주에 따라 환원당 생성량의 차이 가 있어 된장의 맛에 미치는 영향이 있을 것으로 사료된다.
Fig. 3.
Changes of reducing sugar of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
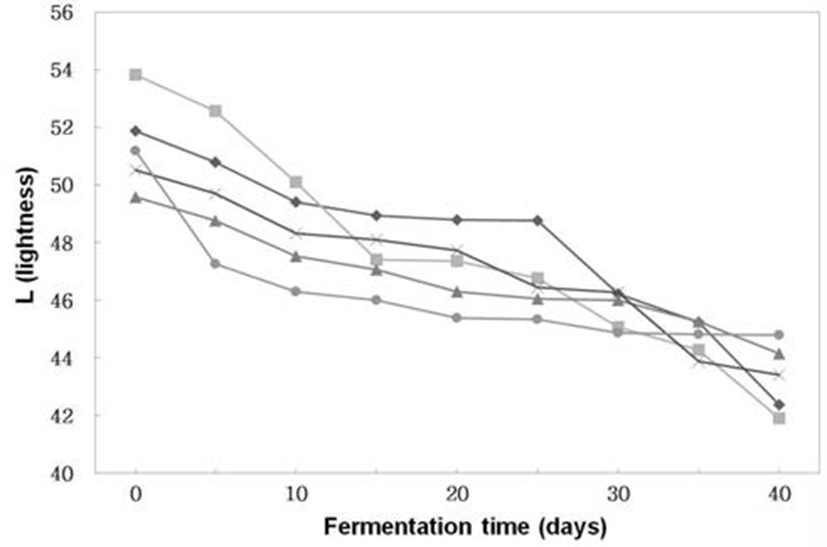
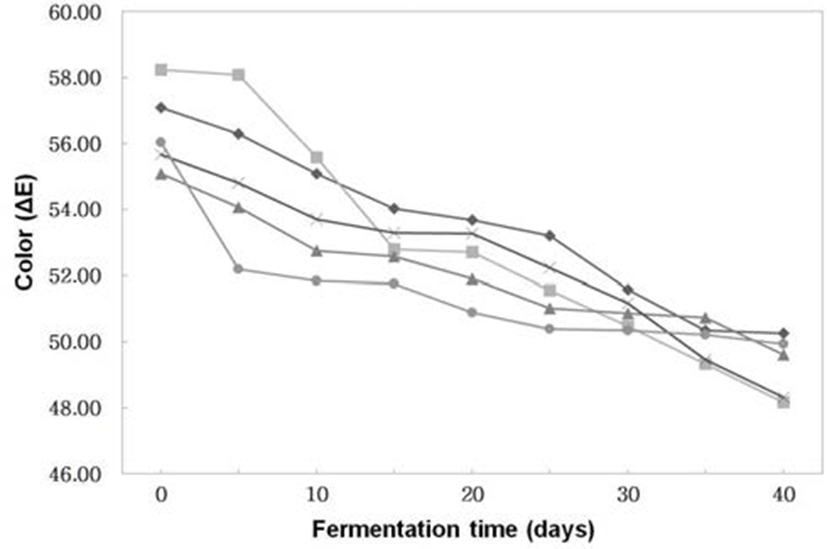
된장의 색 중에서 밝은 색인 L(lightness)값 (Fig. 4)은 전체적으로 숙성이 진행될수록 감소하는 경향이었다. 특히 세균 코오지보다는 곰팡이 코오지의 L값의 변화가 컸다. 즉, 숙성 40일경에 B. subtilis 3-B-1으로 제조한 된장의 L값 은 44.80이고, A. oryzae 6-M-1로 제조한 된장의 L값은 42.38 로B. subtilis 3-B-1으로 제조한 된장보다A. oryzae 6-M-1로 제조한 된장의 L값이 낮았다. 이는 Hong 등(25)이 세균과 곰팡이를 이용하여 제조한 더덕 된장에서 세균보다는 곰팡 이에 의해 L값이 낮다는 결과와 유사하였다. 숙성 중 전체 적인 색의 변화 (△E)는 Fig. 5와 같이 숙성기간이 경과할수 록 점차 감소하였다. 이는 색의 변화 중에서 L(lightness)의 변화가 가장 크기 때문이었다.
Fig. 4.
Changes of color (L) of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
Fig. 5.
Changes of color (ΔE) of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
생균수, 곰팡이 및 효모수
분리, 선정한 A. oryzae 6-M-1과B. subtilis 3-B-1를 이용 하여 코오지를 제조한 후 이들 코오지를 Table 1과 같은 혼합비율로 된장을 제조한 후 30°C, 65% RH의 항온항습기 에서 40일간 숙성시키면서 생균수, 효모 및 곰팡이수의 변 화를 조사한 결과는 Fig. 6, 7과 같다.
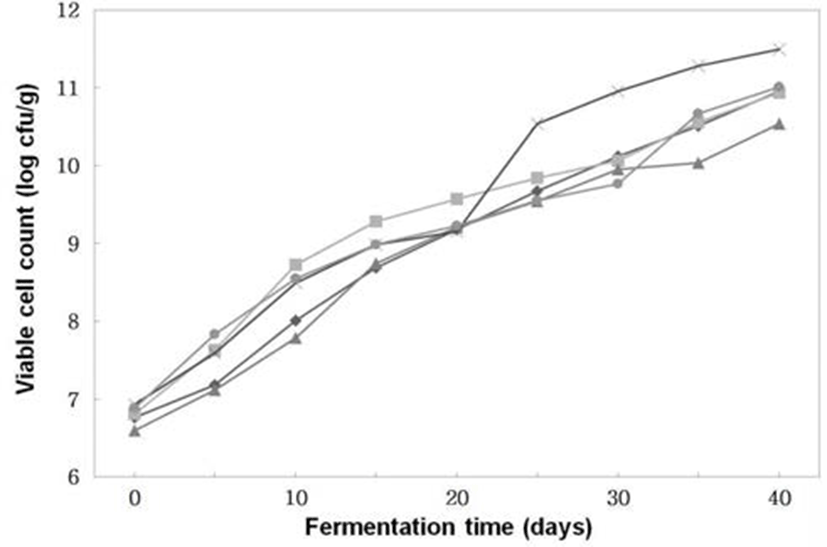
Fig. 6.
Changes of viable cell counts of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
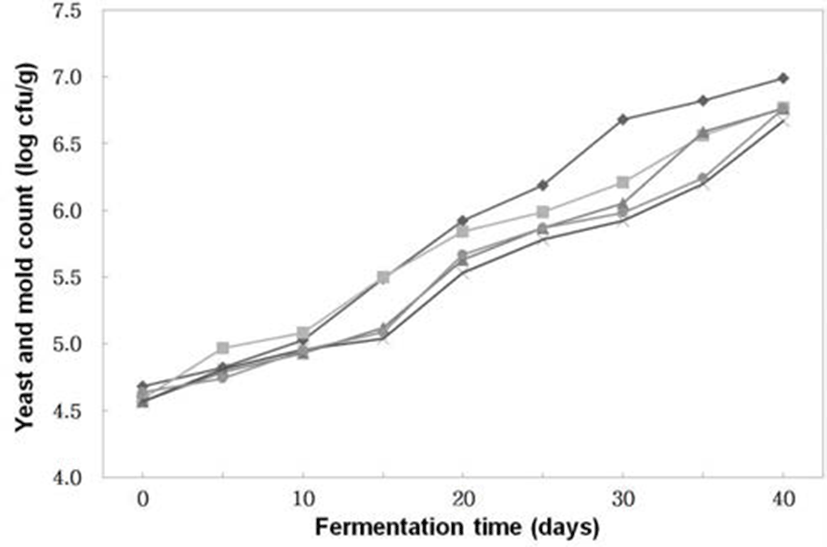
Fig. 7.
Changes of yeast & mold counts of Doenjangs according to mixed ratios of koji prepared with Bacillus subtilis 3-B-1 and/or Aspergillus oryzae 6-M-1
-*-, -×-, -▲-, -■-, -◆- ; Samples were referred to Fig. 1.
Download Original Figure
생균수 (Fig. 6)는 전체적으로 숙성 기간이 경과할수록 꾸준히 증가하였다. B. subtilis 3-B-1으로 코오지를 제조한 후 이를 이용하여 된장을 제조한 처리구는 1.0×1011 cfu/g로 가장 많은 균수를 보이고A. oryzae 6-M-1과B. subtilis 3-B-1 으로 코오지를 제조한 후 이를 30 : 70의 비율로 혼합하여 된장을 제조한 것은 3.2×1010 cfu/g으로 가장 적었다. 이러한 결과는 염 농도에 따른 된장의 숙성 중 세균수 변화에 대해 숙성초기에 약간 증가하는 경향을 보이다가 숙성 6주의 된장에서 105∼106 cfu/g으로 일정한 수준을 유지한다는 Lim 등(4)의 연구 결과 보다 높은 값이었다.
곰팡이 및 효모수 (Fig. 7)는 전체적으로 숙성 기간이 경과할수록 균의 수는 꾸준히 증가하였으나 생균수에 비하 여 적었다. A. oryzae 6-M-1으로 코오지를 제조한 후 이를 이용하여 된장을 제조한 처리구는 9.9×106 cfu/g로 가장 많았으며A. oryzae 6-M-1과B. subtilis 3-B-1으로 코오지를 제조한 후 이를 3 : 7의 비율로 혼합하여 된장을 제조한 것은 4.7×106 cfu/g으로 가장 적었다. 이런 결과는 염 농도에 따른 된장의 숙성 중 효모 및 곰팡이수의 변화에 대해 숙성 초기에 약간 증가하고 숙성 10∼12주의 된장에서 104∼106 cfu/g으로 일정한 수준을 유지한다는 Lim(4)등의 연구결과 보다 약간 높았다.
관능검사
분리한 세균과 곰팡이를 이용한 콩 코오지로 제조한 된 장과 밀가루 코오지로 제조한 시판된장과의 맛, 향, 색 및 전체적인 기호도에 대해 관능검사를 실시한 결과는 Table 4와 같다.
Table 4.
Sensory evaluation1) of Doenjang made by koji prepared with Bacillus subtilis 3-B-1 and Aspergillus oryzae 6-M-1
|
Samples |
No. 12) |
No. 22) |
No. 32) |
No. 42) |
No. 52) |
No. 63) |
|
Taste |
6.9 ± 1.4a
|
6.4 ± 1.4a
|
6.2 ± 1.4a |
6.8 ± 1.9a
|
6.9 ± 2.0a
|
7.4 ± 1.9a
|
|
Flavor |
7.4 ± 1.2a
|
7.6 ± 1.5a
|
7.4 ± 1.2a |
7.4 ± 1.6a
|
7.4 ± 1.5a
|
8.0 ± 1.9a
|
|
Color |
7.2 ± 1.8a
|
7.4 ± 1.4a
|
7.1 ± 1.2a
|
8.1 ± 1.2a
|
7.6 ± 1.3a
|
8.2 ± 2.1a
|
|
Overall acceptability |
7.1 ± 2.7a
|
7.2 ± 1.6a
|
6.8 ± 1.2a
|
7.4 ± 1.8a
|
7.3 ± 2.4a
|
8.3 ± 2.4a
|
Download Excel Table
맛, 향, 색 및 전체적인 기호도에서 관능검사를 실시한 결과 5% 수준에서 유의성이 인정되지 않아 시판된장과 본 실험에서 제조한 된장과의 기호도면에서 유사하였다. 즉 콩을 이용하여 제조한 코오지로 된장을 제조하는 것이 시판 된장과의 관능적인 기호도에서 차이를 보이지 않아 콩 코오지를 이용한 된장의 제조가 가능하였다.
맛의 경우 5% 수준에서 유의성이 인정되지 않아 시료간 의 차이가 없었다. 즉 분리, 선정한 A. oryzae 6-M-1으로 제조한 코오지를 이용한 된장과B. subtilis 3-B-1으로 제조 한 코오지를 이용한 된장이 각각 6.9점이고 분리, 선정한 A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 50 : 50의 비율로 혼합한 것이 가장 낮은 6.2점을 얻었고 시판 된장이 가장 높은 7.4점이었다.
향의 경우 유의성 검정결과 5% 수준에서 유의성이 인정 되지 않아 시료간의 차이가 없었다. 즉 분리, 선정한 A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 70 : 30의 비율로 혼합한 된장이 7.6점 이었으나 A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 50 : 50의 비율로 한 된장, A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 30 : 70의 비율로 한 된장, B. subtilis 3-B-1 으로 제조한 코오지를 이용한 된장이 각각 가장 낮은 7.4점 이었으나 시료간에 유의적인 차이가 없었고 시판된장이 가장 높은 8.0점이었다.
색의 경우에서도 5% 수준에서 유의성이 인정되지 않아 시료간에 차이가 없었다. 즉 분리, 선정한A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 30 : 70의 비율로 한 된장이 8.1점 이었고, 분리, 선정한 A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 50 : 50의 비율로 혼합한 것이 각각 가장 낮은 7.1점, 시판 된장이 가장 높은 8.2점 이었다.
전체적인 기호도의 경우 5% 수준에서 유의성이 인정되 지 않아 시료간의 차이가 없었다. 즉 분리, 선정한A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 30 : 70의 비율로 한 된장이 7.4점을 얻고 분리, 선정한 A. oryzae 6-M-1과 B. subtilis 3-B-1으로 제조한 코오지를 50 : 50의 비율로 한 된장이 제조한 된장 중에서는 가장 낮은 6.8이었 으며 시판 된장은 가장 높은 8.3점 이었다.
따라서 관능검사 결과 콩 코오지를 이용한 된장이 시판 된장에 비해 5% 수준에서 유의성이 인정되지 않았으나 전체적인 관능적 기호도에서 점수가 약간 낮아 이에 대한 보완연구가 필요하다고 사료된다.
요 약
밀가루 코오지 대신 콩 코오지를 이용하여 된장을 제조 하기 위해 콩 코오지에 이용할 종균을 분리, 선정하고 이를 이용한 된장을 제조하여 품질 변화 및 관능검사를 조사하였 다. 재래식 메주로부터 amylase 및 protease 활성이 우수한 세균과 곰팡이를 분리 및 동정한 결과 A. oryzae 6-M-1과 B. subtilis 3-B-1이었다. 분리, 선정된 세균 및 곰팡이를 이용 하여 30°C에서 40일간 제조한 된장의 숙성 중 품질변화 중 수분함량은 숙성 초기에 59.86∼61.58%(w/w)이었고 숙 성 25일째를 경과하면서 수분함량의 감소폭이 컸다. 아미 노태 질소 함량은 숙성기간 동안 꾸준히 아미노태질소가 증가하며, 숙성 10일이 경과하면서 300 mg%(w/w) 이상 생성하고, 색도는 숙성기간이 경과할수록 B. subtilis 3-B-1 으로 제조한 코오지를 이용한 된장보다A. oryzae 6-M-1로 제조한 코오지를 이용한 된장의 색 변화가 큰 것으로 나타 났다. 환원당은 숙성 30일 이후에는 급격히 증가하여 숙성 40일경에는 9.01∼15.40%(w/w)였다. 생균수, 곰팡이 및 효 모수는 숙성 초기부터 꾸준히 증가하였다. 관능검사 결과 5% 수준에서 맛, 향, 색 및 전체적인 기호도에서 시판된장 과의 유의성이 인정되지 않아 시료간의 차이가 없었다. 이 런 결과는 밀가루 코오지 대신 콩 코오지로 된장을 제조하 는 것이 가능하다는 것을 보였다.
감사의 글
본 연구결과는 중소기업청에서 지원하는 2011년도 산학 연공동기술개발사업(No. 00046176)의 연구수행으로 인한 결과물임을 밝힙니다.
REFERENCES
Park JW, Lee YJ, Yoon S. Total flavonoids and phenolics in fermented soy products and their effects on antioxidant activities determined by different assays. Korean J Food Culture. 2007; 22 p. 352-358.

Joo HK, Kim DH, Oh KT. Chemical composition changes in fermented
Doenjang depend on
Doenjang koji and its mixture. Korean J Agric Chem Soc. 1992; 35 p. 351-360.

Choi KS, Lee HJ, Kwon DJ. Physicochemical and microbiological properties of Korean traditional
Meju. Korean J Food Preserv. 2009; 16 p. 217-222.

Mok CK, Song KT, Lee JY, Park YS, Lim SB. Changes in microorganisms and enzyme activity of low salt soybean paste(
Doenjang) during fermentation. Food Eng Prog. 2005; 9 p. 112-117.

Lee SW, Yoon WJ, Moon HK, Kim GY, Moon JN. Effect of mixed soybeans materials on quality characteristics of traditional soybean paste(
Doenjang) during aging. Korean Food Cookery Sci. 2010; 26 p. 314-322.

Lee JY, Mok CK. Changes in physicochemical properties of low salt soybean paste(
Doenjang) during fermentation. Food Eng Prog. 2010; 14 p. 153-158.

Yoo JY, Kim HG, Kim WJ. Physico-chemical and microbiological changes of traditional
Meju during fermentation in
Kangweondo area. Korean J Food Sci Technol. 1998; 30 p. 908-915.

Lee SE, Suh HJ, Hwang JH. Characteristics of rice
Doenjang prepared with brown rice
koji. Korean J Food Preserv. 2011; 18 p. 859-868


Rho JD, Choi SY, Lee SJ. Quality characteristics of soybean pastes (
Doenjang) prepared using different types of microorganisms and mixing ratios. Korean Food Cookery Sci. 2008; 24 p. 598-605.

Rhee CH, Kim WC, Rhee IK, Park HD. Effects of inoculation of
Bacillus subtilis cells on the fermentation of korean traditional soy paste (
Doenjang). Korean J Food Preserv. 2008; 15 p. 598-605.

Park JS, Lee MY, Kim JS, Lee TS. Compositions of nitrogen compound and amino acid in soybean paste (
Doenjang) prepared with different microbial sources. Korean J Food Sci Technol. 1994; 26 p. 609-615.

Kim EY, Rhyu MR. The chemical properties of Doenjang prepared by
monascus koji. Korean J Food Sci Technol. 2000; 32 p. 1114-1121.

Kim JH, Yoo JS, Lee CH, Kim SY, Lee SK. Quality properties of soybean pastes made from
Meju with mold producing protease isolated from traditional
Meju. Korean J Soc Appl Biol Chem. 2006; 49 p. 7-14.

Kim DH, Lim DW, Bai S, Chun SB. Fermentation characteristics of whole soybean
Meju model system inoculated with 4
Bacillus strains. Korean J Food Sci Technol. 1997; 29 p. 1006-1015.

Lee JJ, Lee YM, Chang HC, Lee MY. Antioxidative effects of
Doenjang fermented using
Bacillus subtilis DJI. Korean J Food Preserv. 2009; 16 p. 554-561.

Mary JZ. Difco™ & BBL™ Manual, manual of microbiological culture media. BD diagnostics-diagnostic systems. 2009; USALoveton Circle p. 441-446.

Kim MS, Oh PS. Isolation of thermostable α -amylase hyper producing
bacillus sp. NO. 32H417 and some properties of the enzyme. Korean J Appl Microbiol Biotechnol. 1991; 19 p. 122-127.

Park JM, Oh HI. Changes in microflora and enzyme activities of traditional
Kochujang meju during fermentation. Korean J Food Sci Technol. 1995; 27 p. 56-62.

Kim YS, Kwon DJ, Koo MS, Oh HI, Kang TS. Changes in microflora and enzyme activities of traditional
Kochujang during fermentation. Korean J Food Sci Technol. 1993; 25 p. 502-509.

Von W. Worthington enzyme mannual. 1993; NJ, USAWorthington Biochemical Corp p. 36-44 p. 349-340(amylase), (protease).

AOAC Official Method of Analysis of AOAC. Method 945.39. 199516th edArlington, VA, USAAssociation of Official Analytical Communities.

Yoo JY, Kim HG. Characteristics of traditional
Mejus nation-wide collection. Korean J Soc Food Sci Nutr. 1998; 27 p. 259-267.

Somogyi M. Notes on sugar determination. J Biological Chemistry. 1927; 195 p. 19-23.

Ministry of Agriculture & Forestry Traditional food standard specifications. 2007; KoreaMinistry of Agriculture & Forestry p. 99.

Hong SC, Choi KS, Lee HJ, Kwon DJ. Effects of
Deodeok contents on the qualities of quick fermented doenjang type product. J Korean Soc Food Sci Nutr. 2010; 39 p. 757-763