1. 서론
산업화 및 서구화에 따라 생활환경이 바뀌어 식습관 역시 설탕, 단백질, 지방 등이 많은 음식을 섭취하는 인구가 증가하고 있다(Kaur 등, 2021). 이러한 고열량 식단은 체내에서 인슐린을 분비하는 세포인 췌장 β 세포를 손상시키고 인슐린 저항성을 유발하게 되어 체내 혈당을 증가시킨다(Lauritano와 Ianora, 2016). 체내 혈당이 과도하게 증가되면 장 상피 내벽의 세포에서 미토콘드리아의 기능 장애를 유발하여 활성 산소종(reactive oxygen species, ROS) 생성이 촉진된다(Shabbir 등, 2021). 화학적으로 반응성이 높은 활성 산소종은 생체분자들과 빠르게 반응하여 체내 산화와 환원의 균형을 무너뜨려 지질과산화, 단백질 변성 및 DNA 손상 등을 유발시킨다(Park 등, 2017). 과도한 활성 산소종은 산화적 스트레스를 유발시켜 장벽의 투과성을 증가시키고 장내에서 유익균에 비해 유해균의 비중이 증가되는 장내 미생물총의 불균형을 초래하게 된다(Yardeni 등, 2019). 이와 더불어 단당류 중 포도당의 과도한 섭취 역시 외부 항원으로부터 장 상피를 보호하는 점액층의 두께 감소 및 장 상피세포 사이의 밀착연접의 손상을 유발하고, 장벽의 투과성을 증가시킴으로써 장내 미생물총 불균형에 영향을 미친다. 장내 미생물총 불균형이 발생하면 대장균과 같은 그람 음성균 외막의 염증을 유발하는 물질인 lipopolysacchride(LPS)의 수준을 증가시키고 장내 유해균의 전위를 유발하여 당뇨병, 비만, 고혈압을 비롯한 다양한 대사 증후군의 발병률을 증가시킨다(Ferro 등, 2020; Iwamoto 등, 2021). 또한, 혈장 LPS 및 산화적 스트레스 수준의 증가는 장 면역 및 장벽에 손상을 주어 세포에서 전염증성 사이토카인이 방출되고 과도한 염증을 유발시켜 위장 및 대사 질환에 대한 합병증 역시 유발시킨다(Hersoug 등, 2016). 따라서 당뇨 및 비만과 같은 대사 질환과 합병증을 예방 및 완화하기 위한 방법으로 Levilactobacillus breivs(L. brevis), Lactobacillus gasseri(L.gaseri), Lactobacillus plantarum(L. plantarum) 등과 같은 항당뇨 및 항비만 활성을 가진 장내 유익균을 이용한 다양한 연구가 수행돼 오고 있다(Abdelazez 등, 2018; Martiz 등, 2023).
두충은 두충과 두충속에 속하는 다년생 낙엽교목으로써 한국, 중국, 일본에서 널리 이용됐으며 두충의 수피는 한방의 생약 제재로 근육과 뼈의 강화에 이용되었고, 잎은 지방 대사를 촉진하여 콜레스테롤을 감소시키는 데 효과가 있어 주로 차로 이용됐다(Huang 등, 2021). 두충의 생리활성 물질은 caffeic acid, quercetin, aucubin 등 다양하게 존재하며 daucosterol, β-sitosterol과 같은 steroid와 다양한 아미노산 및 무기질을 함유하고 있다고 알려져 있다(Hussain 등, 2016). 현재 두충 추출물에 함유되어 있는 다양한 페놀성 화합물에 의해 라디칼 소거활성을 측정하였을 때 우수한 소거활성을 나타내어 항산화 효과가 있는 것으로 나타났으며, 관절염 유발 랫의 발목 관절 및 혈청에서 tumor necrosis factor-α(TNF-α), interleukin-1β (IL-1β)와 같은 전염증성 사이토카인의 발현 정도가 두충 잎 추출물을 처리하였을 때 감소하여 항염증 효과를 나타냈다. 또한, 두충 잎 물 추출물을 이용하였을 때 간 세포주로 알려져 있는 HepG2 세포에서 세포 생존율이 증가하였고 oleic acid로 지방이 축적된 세포에서 중성지방의 수준을 감소시켰으며 활성화되었을 때 인슐린 저항성을 감소시킨다고 알려져 있는 peroxisome proliferator-activated receptor gamma(PPARγ)의 발현 정도를 증가시켜 항당뇨 효과를 나타낸 것과 같이 두충을 이용한 연구가 다양하게 수행되어 왔다(Gong 등, 2022; Xing 등, 2020; Xue 등, 2022). 하지만, 장 상피세포에 대한 보호 효과와 장내 유익균의 증식을 자극하여 생육에 유익한 영향을 미치는지에 대한 연구는 상대적으로 미비한 실정이다. 따라서 본 연구는 고당으로 유도된 산화적 스트레스에 대한 두충 잎의 장 상피세포 보호 효과 및 장내 유익균으로서 알려진 L. brevis에 대한 증식 자극 효과를 확인하여 두충 잎의 건강기능식품 소재로서의 가치를 확인하기 위해 수행되었다.
2. 재료 및 방법
본 실험에 사용된 시약은 sodium phosphate buffer, 2,2'-azinobis(3-ethyl benzothiazoline-6-sulfonic acid)(ABTS), 2,2'-azobis-(2-amidinopropane)-dihydrochloride(AAPH), potassium persulfate, 1,1-diphenyl 2-picrylhydrazyl(DPPH), sodium acetate buffer, HCl, 2,4,6-tri(2-pyridyl)-1,3,5-triazine(TPTZ), FeCl3, trichloroacetic acid, thiobarbituric acid, ascorbic acid, catechin, tris HCl buffer, acetaldehyde, LPS(Escherichia coli O55;B5), 2-mercaptoethanol, 2’,7’-dichlorofluorescin diacetate(DCF-DA), 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT), rosewell park memorial institute(RPMI) 1640, dimethyl sulfoxide(DMSO)는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였다. Man-rogosa-sharp(MRS) broth, without glucose MRS는 Difco(Detroit, MI, USA)에서 구입하였으며, fructo-oligosaccharide는 Wako(Osaka, Japan)에서 구입하였다. 그 외 사용된 용매 및 시약은 모두 1급 이상의 등급을 사용하였다.
본 실험에 사용된 두충 잎은 경상북도 영천시에 위치한 농가에서 40°C로 열풍 건조된 건조물을 구입하여 마쇄하였다. 이후 실험에 이용하기 위해 마쇄된 두충 잎 분말 20 g을 증류수 1 L에 혼합하여 40°C에서 2시간 동안 환류 냉각 추출하여 No.2 여과지(Whatman PLC, Kent, UK)로 여과하였다. 여과된 추출물은 회전진공농축기(N-N series, Eyela Co., Tokyo, Japan)로 농축하여 동결건조한 후 −20°C에서 보관하여 사용하였다.
ABTS 라디칼 소거활성을 측정하기 위해 1.0 mM AAPH와 2.5 mM ABTS를 150 mM NaCl이 용해된 100 mM sodium phosphate buffer(pH 7.4)에 넣고 혼합하여 70°C의 항온수조에 15분간 방치하였다. 이후 실온에서 30분간 냉각한 뒤 만들어진 ABTS 용액을 0.45 μm filter를 이용하여 여과하고 24시간 동안 냉장 보관한 후 실험에 이용하였다. 제조된 ABTS 원액을 증류수로 희석하여 734 nm에서 흡광도 값이 0.70±0.02가 나오도록 맞춘 후 실험에 이용하였으며 ABTS 용액과 시료를 혼합하여 37°C에서 10분간 반응시킨 후 734 nm에서 흡광도(UV-1800, Shimadzu, Kyoto, Japan)를 측정하여 라디칼 소거활성을 측정하였다. 측정 후, 라디칼 소거활성은 아래의 식을 이용하여 계산하였다.
DPPH 라디칼 소거 활성을 측정하기 위해 80% MeOH을 이용하여 0.1 mM DPPH 용액을 제조하였다. 이후 만들어진 DPPH 용액을 희석하여 517 nm에서 흡광도 값이 1.00±0.02가 되도록 하여 흡광도 값을 맞춘 DPPH 용액과 시료를 혼합한 후 30분간 암실에서 반응시켜 517 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다. 측정 후, 라디칼 소거활성은 아래의 식을 이용하여 계산하였다.
A: 흡광도 값
철 환원력을 측정하기 위해 40 mM HCl에 10 mM TPTZ을 용해시켜 제조한 혼합용액, 20 mM FeCl3과 300 mM sodium acetate buffer(pH 3.6)을 각각 제조한 뒤 일정한 비율로 배합하여 37°C에서 15분간 반응시켜 ferric ruducing antioxidant power(FRAP) 용액을 제조하였다. 이후, 시료에 제조된 FRAP 용액을 혼합하여 실온에서 30분간 반응시킨 다음 593 nm에서 흡광도(UV-1800, Shmadzu)를 측정하였다. 측정 후, 환원력은 아래의 식을 이용하여 계산하였다.
A: 흡광도 값
지질과산화물 생성 억제 활성을 측정하기 위한 마우스 뇌 조직을 얻기 위해 4주령의 수컷 institute of cancer research(ICR) 마우스를 실험동물 공급업체(Samtako, Osan, Korea)로부터 구입하여 항온(21-23°C) 및 항습(50-55%) 조건을 유지하여 12시간 간격으로 낮과 밤을 교대시키는 환경에서 식수와 사료를 공급하여 사육하였다. 이후, 사육한 ICR 마우스의 뇌를 적출하여 조직무게 10배의 20 mM tris HCl buffer(pH 7.4)을 첨가하여 균질화시켜 12,000 ×g, 15분, 4°C 조건으로 원심분리하여 얻어진 상등액을 실험에 사용하였다. 시료, 뇌 조직 상등액, 10 μM FeSO4 및 100 μM ascorbic acid를 순서대로 혼합하여 37°C에서 1시간 동안 반응시켰다. 이후 혼합용액에 30% trichloroacetic acid와 1% thiobarbituric acid를 첨가하여 80°C 항온수조에서 20분 동안 가열한 후, 원심분리하여 얻은 상등액을 532 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다. 측정 후, 억제 활성은 아래의 식을 이용하여 계산하였다. 본 동물실험은 경상국립대학교 동물윤리심의위원회 승인을 받은 후 수행되었다(경상국립대학교 동물실험 인가번호: GNU-220429-M0042, 승인일: 2022. 04. 29.).
A: 흡광도 값
HT-29 세포(한국세포주은행, Seoul, Korea)는 25 mM 10% 소태아혈청(fetal bovine serum, FBS), 50 units/mL 페니실린 및 100 μg/mL 스트렙토마이신이 포함된 RPMI 1640 배지에 배양하였으며 37°C, 5% CO2 조건을 유지하여 실험에 사용하였다.
장 상피세포의 세포 생존율을 측정하기 위해 HT-29 세포를 96-well plate에 1×104 cells/well 농도로 분주하고 24시간 동안 배양하였다. 고당에 대한 장 상피세포 보호 효과를 보기 위해 세포에 시료와 양성대조군으로 vitamin C를 처리하였고 3시간 뒤 50 mM glucose를 처리하여 24시간 동안 배양하였다. H2O2에 대한 장 상피세포 보호 효과를 보기 위해 세포에 시료와 양성대조군으로 vitamin C를 처리하였고 24시간 배양한 후 200 μM H2O2를 처리하고 3시간 배양하였다. 또한, LPS에 대한 장 상피세포 보호 효과를 보기 위해 시료와 양성대조군 fructooligosaccharide(FOS) 처리 후 30분간 배양하고 1 μg/mL의 LPS를 처리한 뒤 24시간 동안 배양하였다. 이후 MTT 시약을 처리하여 37°C에서 3시간 배양시킨 다음 배양액을 제거한 뒤, 각 well에 DMSO를 100 μL 처리하여 microplate reader(Epoch 2, BioTek Instruments Inc., Winooski, VT, USA)를 이용하여 570 nm(determination wave)와 655 nm(reference wave)에서 흡광도를 측정하였다. 측정 후, 세포 생존율은 아래의 식을 이용하여 계산하였다(Moon 등, 2022).
A: 흡광도 값
장 상피세포 내 산화스트레스를 측정하기 위해 HT-29 세포를 black 96-well plate에 1×104 cells/well 농도로 분주하고 24시간 동안 배양한 뒤 시료와 양성대조군으로 vitamin C 및 FOS를 각각 처리하였다. 이후 3시간 배양 후에 50 mM glucose를 처리하고 24시간 동안 추가 배양하였다. H2O2의 경우, 24시간 배양한 후 200 μM H2O2를 3시간 배양하였다. 또한, LPS의 경우 30분간 배양한 뒤 1 μg/mL LPS를 처리 후 24시간 배양하였다. 이후 50 μM DCF-DA 시약을 처리하여 50분간 반응시킨 뒤, fluorometer (Infinite F200, TECAN, Mannedorf, Switzerland)을 이용하여 485 nm(excitation wave) 및 535 nm(emission wave)의 파장으로 형광강도를 측정하였다. 측정 후, 활성 산소종 생성 억제 활성은 아래의 식을 이용하여 계산하였다.
F.I.: 형광강도 값
L. brevis KCTC 3498(한국생명공학연구원 생물자원센터, Jeongeup, Korea)는 MRS 고체배지에 도말하여 생성된 단일 콜로니를 MRS 액체배지에 접종하여 37°C에서 48시간 배양한 뒤 사용하였다.
생균수 측정을 위해 균주 배양액을 13,000 ×g으로 원심분리 후, pellet을 0.85% NaCl 용액으로 현탁시켰다. 이후 microplate reader(Epoch 2, BioTek Instruments Inc.)를 이용하여 660 nm에서 0.2의 흡광도 값이 나오도록 희석하였다. L. brevis의 생육곡선은 glucose가 없는 MRS 액체배지에 시료와 양성대조군을 각각 2%(w/v) 첨가하였고 대수기 균주를 1%(w/v)가 되도록 접종하여 37°C에서 48시간 동안 배양하며 측정하였다. 이후, 최초 배양 시간을 0시간으로 하여 0, 4, 8, 12, 24, 48시간의 배양액을 0.85% NaCl 용액으로 단계희석하여 평판배지에 0.1 mL씩 도말하였고 37°C에서 배양하여 콜로니 형성 단위를 측정하여 계산하였다.
적정산도 측정을 위해 0, 4, 8, 12, 24, 48시간 동안 배양한 배양액을 1 mL를 10배 희석하여 1%(v/v) 페놀프탈레인 시약을 첨가하였다. 이후, 0.1 N NaOH 용액으로 적정하여 10초간 지속되는 연한 홍색이 될 때까지 소모되는 0.1 N NaOH 용액의 소모량을 젖산 함량으로 환산하여 아래 식으로 계산하였다.
a: 0.1 N 수산화나트륨의 소비량(mL)
f : 0.1 N 수산화나트륨액의 역가
0.009: 유산계수(0.1 N 수산화나트륨 1 mL)
96-well plate에 0.1 M sodium phosphate buffer (pH 6.9), 시료와 0.5 unit/mL α-glucosidase를 차례대로 넣고 10분간 반응시킨 후 3 mM 4-nitrophenyl-α-D-glucopyranoside를 기질로 하여 첨가하였다. 이후 5분간 반응시킨 후 microplate reader(Epoch 2, BioTek Instruments Inc.)를 이용하여 405 nm에서 흡광도를 측정하였다. 측정 후, α-glucosidase 억제 활성은 아래의 식을 이용하여 계산하였다.
ASE: 시료 + 효소 흡광도 값
ASO: 시료 흡광도 값
AE: 공시료 + 효소 흡광도 값
AO: 공시료 흡광도 값
50 mg/mL BSA와 0.02% sodium azide를 1:3으로 혼합하여 넣고 1.25 M fructose, 0.2 M sodium phosphate buffer(pH 7.4), 시료를 차례대로 넣고 혼합하였다. 이후 37°C에서 3일간 반응시킨 후 black 96-well plate에 분주한 후 fluorometer(Infinite F200, TECAN)를 이용하여 360 nm 들뜸 파장 및 430 nm 방출 파장의 형광을 측정하였다. 측정 후, 최종당화산물 생성 억제 활성은 아래의 식을 이용하여 계산하였다.
F.I.SE: 시료 + 효소 형광강도 값
F.I.SO: 시료 형광강도 값
F.I.E: 공시료 + 효소 형광강도 값
F.I.O: 공시료 형광강도 값
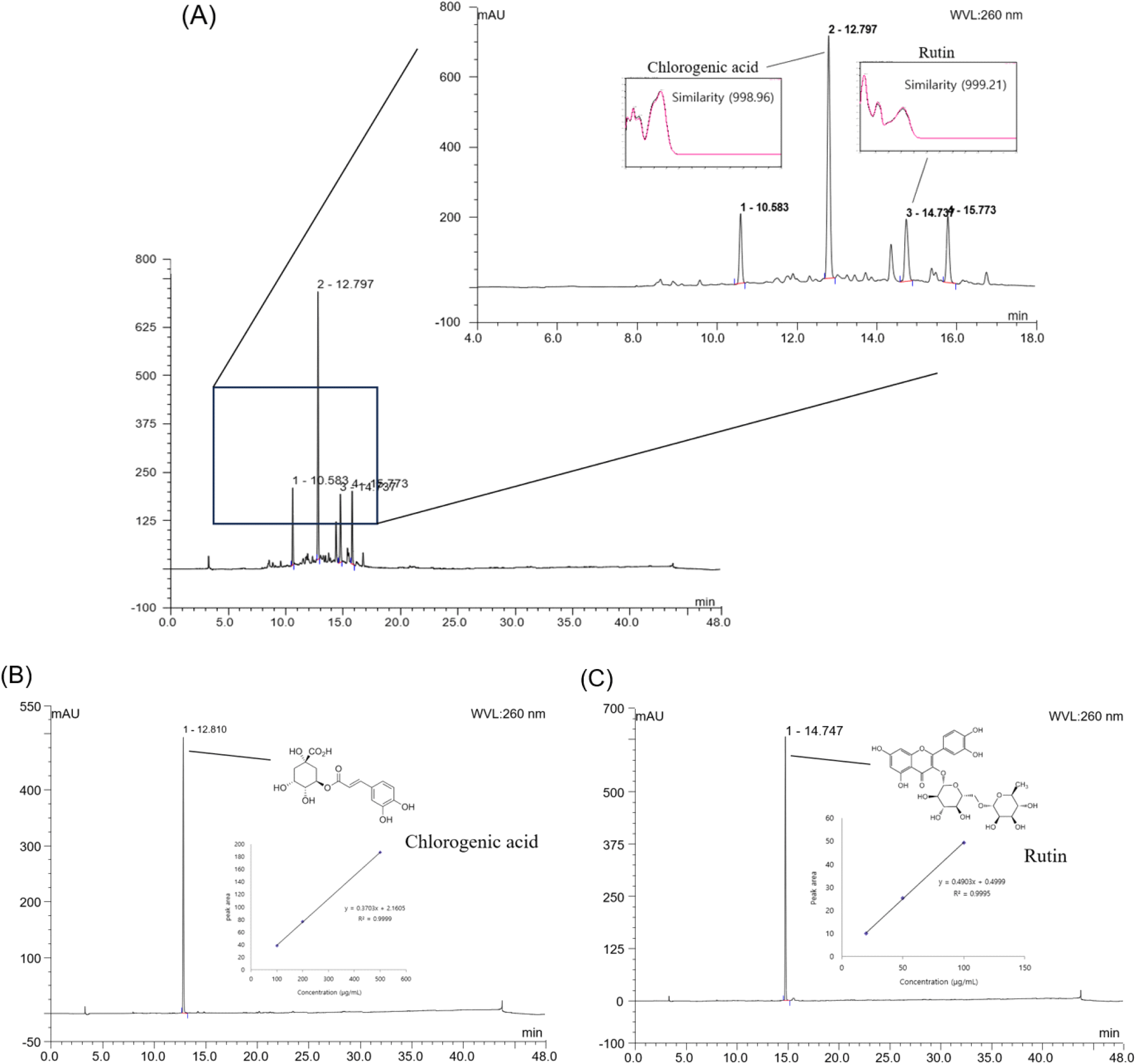
시료를 50% MeOH에 용해시킨 후 0.45 μm filter를 이용해 여과하여 고성능 액체크로마토그래피(high performance liquid chromatography, Ultramate 3000 series, Dionex, Sunnyvale, CA, USA)를 이용하여 분석하였다. 컬럼은 YMC-Triart C18(250×4.6 mm, 5 μm, YMC Korea, Seongnam, Korea)를 이용하였고 이동상은 0.1% formic acid가 포함된 증류수(A), 0.1% formic acid가 포함된 acetonitrile(B)의 조성비를 0-100%(0-35 min), 100% (35-40 min), 100-0%(40-48 min)로 총 48분간 분석하였다. 시료의 주입량은 20 μL, 유속은 1 mL/min으로 하였으며 260 nm의 UV 파장을 diode array detector(DAD, Ultimate 3000 rapid seperation diode array detector, Dionex)를 이용하여 측정하였다. 이후, 검출 파장에 대한 UV 스펙트럼을 저장하고 chlorogenic acid 및 rutin을 표준물질로 하여 UV 스펙트럼과 비교하여 유사성을 판단하였다. 검출된 생리활성 물질의 정량 분석을 위해 표준물질을 단계 희석하여 시료와 같은 방법으로 물질을 분석하였으며 분석된 표준물질의 각 농도별 크로마토그램 peak의 면적에 대한 검량곡선을 작성하여 검량선 대비 농도를 확인하였다.
3. 결과 및 고찰
본 연구에서 AEEL의 항산화 활성을 측정한 결과는 Fig. 1과 같다. ABTS 라디칼 소거활성을 측정하였을 때 AEEL의 2,000 μg/mL 농도에서 75.60%의 라디칼 소거 활성을 나타냈으며 IC50은 1,270.35 μg/mL로 나타났다. DPPH 라디칼 소거활성 측정 결과에서는 AEEL의 2,000 μg/mL 농도에서 57.67%의 활성을 나타내었고 IC50은 1,689.63 μg/mL로 나타나 AEEL이 DPPH 라디칼 소거 활성에 비해 ABTS 라디칼 소거 활성이 우수함을 확인하였다(Fig. 1(A), (B)). 또한, Lee와 Lee(2021)의 연구에서 수행된 두충과 같은 약용 작물인 두릅 물 추출물의 ABTS 및 DPPH 라디칼 소거활성의 IC50(2,660.1 μg/mL; 3,274.7 μg/mL)보다 AEEL이 우수함을 확인하였다. 철 환원력 측정 결과로 AEEL의 2,000 μg/mL 농도에서 1.41의 철 환원력을 가지는 것으로 나타났고 지질과산화물 생성 억제 활성 측정 결과에서는 500 μg/mL 농도에서 81.07%의 억제 활성을 가지며 IC50은 167.88 μg/mL으로 확인되었다(Fig. 1(C), (D)).
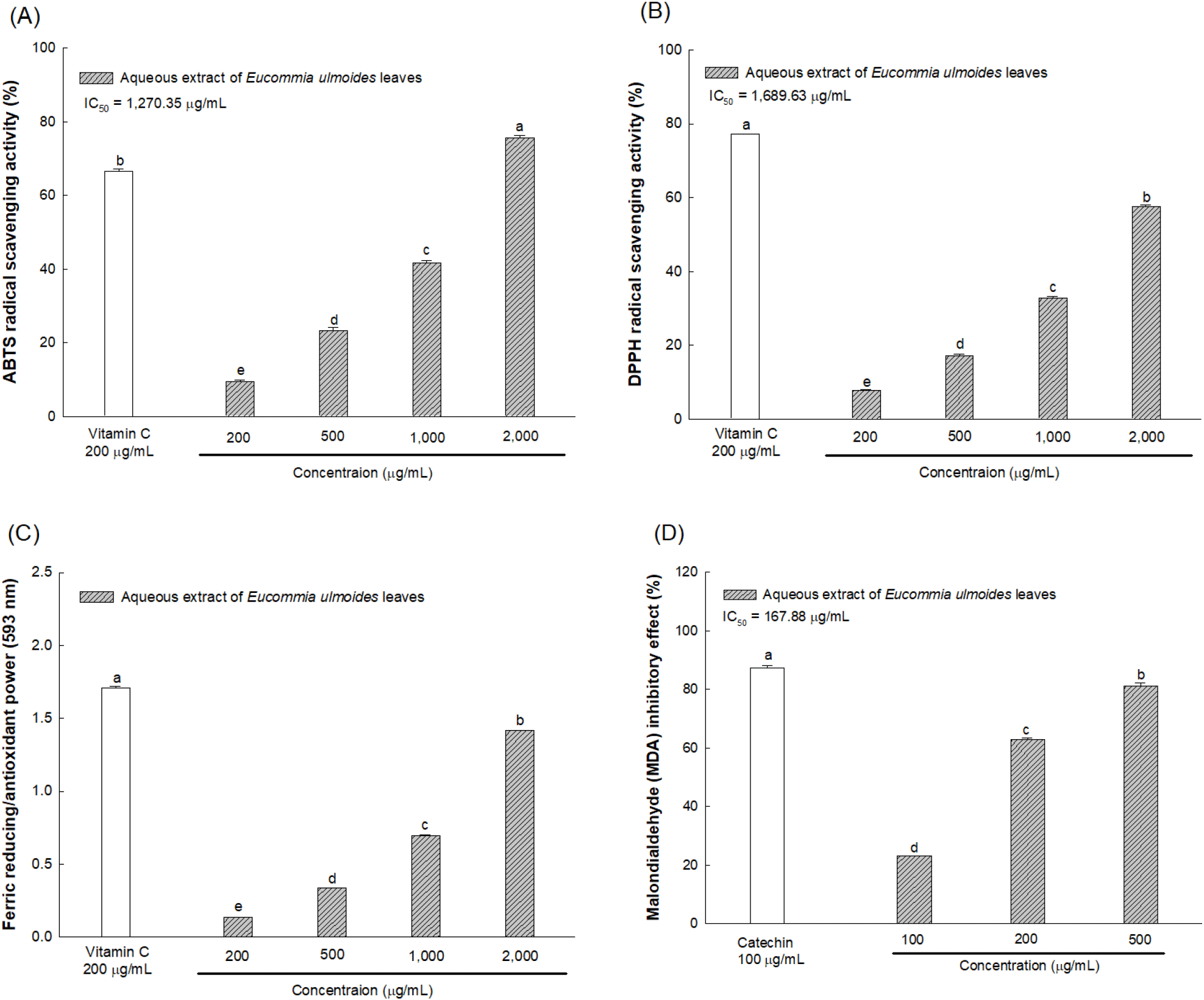
천연 물질에는 방향족 고리에 하이드록실기(-OH)를 포함하는 폴리페놀이 다량 함유되어 있으며 활성 산소종을 비롯한 반응성이 강한 라디칼에 전자를 제공함으로써 라디칼을 환원시켜 소거하는 항산화 효과를 통해 산화적 스트레스를 억제할 수 있다고 알려져 있다(Habtemariam과 Lentini, 2018). Xue 등(2022)의 연구에서 두충에는 lignan, iridoid quercetin, kaempferol 등의 폴리페놀이 함유되어 있어 이들 물질의 환원력에 의한 강력한 항산화 효과를 가지는 것으로 보고되었다. 또한 Kim 등(2021)의 연구에서는 두충 잎의 분획물을 이용하여 라디칼 소거 활성을 측정하였을 때 우수한 소거 활성을 나타냈으며 산화적 스트레스의 대표적인 지표인 지질과산화물의 생성을 효과적으로 억제한다고 보고되었다. 따라서 본 연구에서도 AEEL의 항산화 활성을 확인하였고 이러한 활성은 두충 잎이 가지고 있는 다양한 폴리페놀 화합물에 의해 나타나는 것으로 판단된다.
체내에 과도한 당이 유입되면 장에서는 단백질 산화와 지질과산화를 일으켜 의해 장 세포에서 활성 산소종이 유발되고 catalase나 glutathione(GSH)과 같은 항산화 효소의 수준 감소에 따라 발생하게 되는 산화적 스트레스는 세포에 손상을 일으킨다(Park 등, 2017). 또한 LPS는 장의 산화적 스트레스를 증가시키고 장 상피에 손상을 일으켜 병원성 미생물의 전위가 발생해 면역의 불균형을 일으킨다(Ferro 등, 2020). 하지만 fructooligosaccharide(FOS)와 같은 난소화성 탄수화물이 장내에서 LPS에 의한 활성 산소종과 지질과산화를 억제시키고 전염증성 사이토카인의 수준을 낮춰 장 상피의 손상을 억제한다고 알려져 있다(He와 Shi, 2017). 따라서 본 연구에서는 천연 물질인 AEEL을 이용하여 장 상피세포(HT-29 세포)에 대한 세포 생존율 및 세포 내 산화적 스트레스 수준을 MTT 및 DCF-DA 방법을 이용해 측정하였으며 결과는 Fig. 2와 같다.
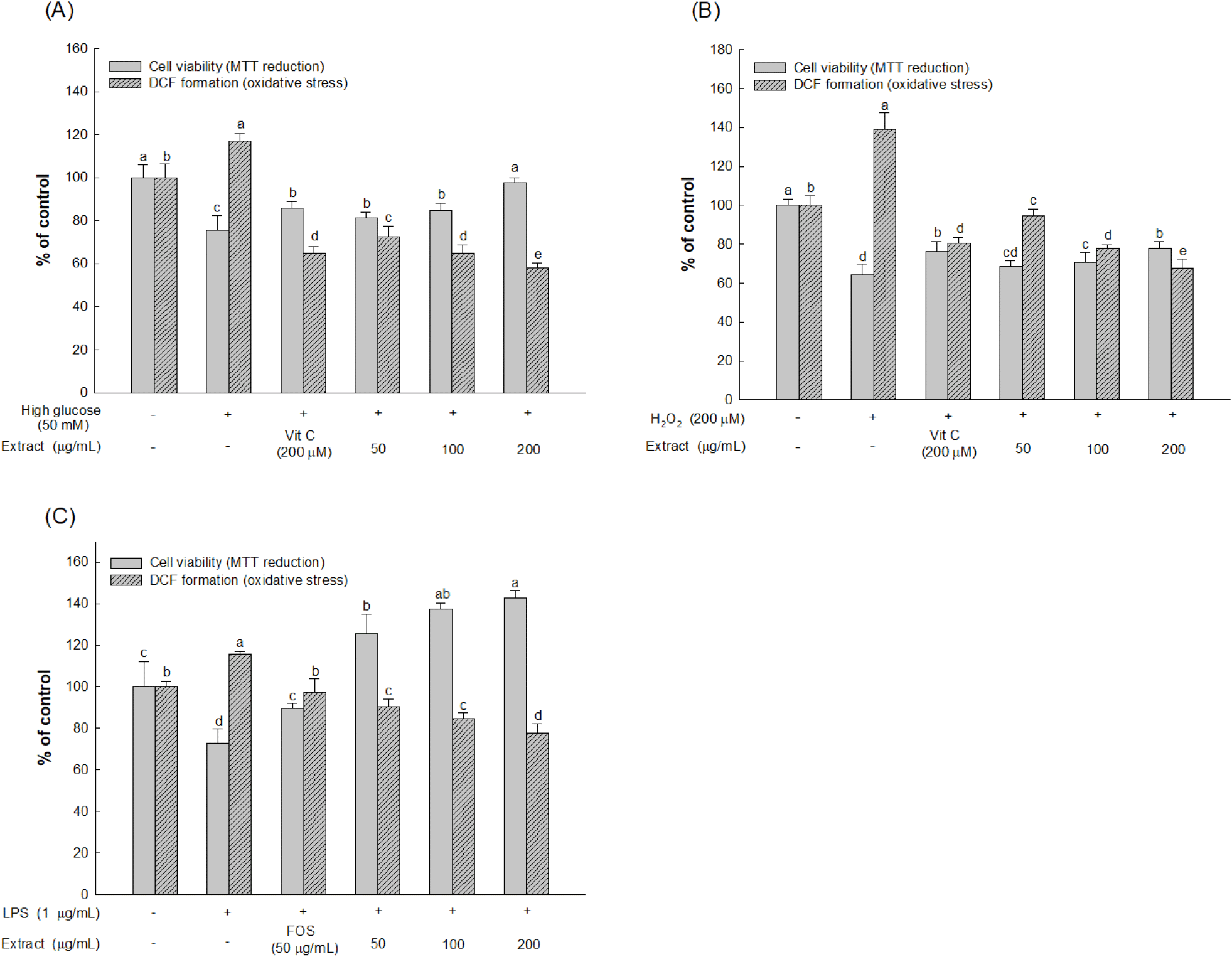
본 연구에서 대조군으로 사용된 세포에는 증류수만을 처리하였으며, 고당 처리 농도는 Moon 등(2022)의 선행 연구에 따라 결정되었다. 고당으로 유도된 HT-29 세포 생존율 결과의 경우, 대조군(100%) 대비 고당으로만 유도하였을 때 세포 생존율은 75.64%로 나타났으며 양성대조군인 vitamin C(85.69%)에 비해 AEEL의 200 μg/mL 농도를 처리하였을 때 97.67%의 우수한 세포 생존율을 확인하였다(Fig. 2(A)). H2O2로 유도한 HT-29 세포 생존율의 결과에서는 대조군(100%) 대비 H2O2만 처리했을 때 세포 생존율이 64.11%로 나타났으며 AEEL의 200 μg/mL 농도에서 78.10%의 우수한 세포 생존율을 가지는 것으로 나타났다(Fig. 2(B)). LPS로 유도한 HT-29 세포 생존율의 결과로 대조군(100%) 대비 LPS만 처리하였을 때 세포 생존율은 72.95%로 나타났으며 AEEL의 50 μg/mL, 100 μg/mL, 200 μg/mL 농도에서 세포 생존율이 각각 125.38%, 137.52%, 142.78%로 나타나 모든 농도에서 양성대조군인 FOS(89.52%)에 비해 우수한 세포 생존율을 나타내었다(Fig. 2(C)).
고당으로 유도된 HT-29 세포에서 활성 산소종 생성 억제 활성을 측정한 결과는 대조군(100%) 대비 고당만 처리하였을 때 117.04%로 나타났으며 양성대조군인 vitamin C(64.72%)에 비해 AEEL의 200 μg/mL에서 58.18%의 우수한 억제 활성을 나타내었다(Fig. 2(A)). H2O2로 유도된 HT-29 세포에서 활성 산소종 생성 억제 활성을 측정하였을 때 대조군(100%) 대비 138.89%로 나타났고 AEEL의 200 μg/mL 농도에서 67.76%의 억제 활성을 나타내 양성대조군인 vitamin C(80.55%)에 비해 우수한 활성을 확인하였다(Fig. 2(B)). LPS로 유도된 HT-29 세포에서 활성 산소종 생성 억제 활성을 측정할 결과는 대조군(100%) 대비 LPS만 처리하였을 때 115.66%로 나타났으며 50 μg/mL, 100 μg/mL, 200 μg/mL 농도로 처리한 모든 AEEL 그룹에서 각각 90.45%, 84.53%, 77.79%로 양성대조군인 FOS (97.49%)에 비해 우수한 억제 활성을 확인하였다(Fig. 2(C)).
Anthocyanin, flavonoid, chlorogenic acid, quercetin 등의 폴리페놀이 많이 함유되어 있는 천연 물질은 고당과 LPS에 의한 산화적 스트레스 수준을 감소시키고 세포사멸을 억제한다고 보고하였다(Iwamoto 등, 2021). 이에 Hussain 등(2020)의 연구에서는 천연 물질인 두충 잎에서 추출한 flavone을 이용하여 돼지 장 상피세포인 intestinal porcine enterocyte cells(IPEC-J2)에 처리하였을 때 세포 내 superoxide dismutase(SOD)의 활성을 증가시켰고 LPS를 처리하였을 때 세포사멸을 억제하여 산화적 스트레스를 억제한다고 보고되었다. 또한, Zhang 등(2015)의 연구에서는 두충의 에탄올 추출물이 인간 장 상피세포인 CACO-2 세포에서 SGLT1, GLUT2 및 GLUT5와 같은 포도당 수송체를 불활성화시키는 것으로 나타나 장에서 고당으로 인한 산화적 스트레스 및 장 상피세포의 손상을 억제할 수 있는 것으로 보고되고 있다. 따라서 이전 연구와 더불어 본 연구에서 AEEL이 가지고 있는 항산화 활성과 LPS, H2O2 및 고당을 장 상피세포에 처리하였을 때 우수한 세포 보호 효과를 나타내는 것으로 보아, AEEL이 고당에 의한 산화적 스트레스 및 장 상피세포 손상을 보호할 수 있을 것으로 판단된다.
L. brevis는 장에 서식하는 그람 양성균으로 젖산을 만들어내는 유산균이며 장내 pH를 낮춰 장내 유해균이 서식하지 못하게 하는 역할을 한다(Abdelazez 등, 2018). 또한, L. brevis는 억제성 신경 전달 물질로 항고혈압 효과가 있는 γ-aminobutryic acid(GABA)를 생산하는 대표적인 미생물로 알려져 있다(Hossain 등, 2022). 또한 세포벽 외부에 점질 형태로 발효 중에 축적되는 미생물 다당류인 exopolysaccharide라는 대사산물을 생산하며 이는 α-glucosidse 억제 활성을 가지고 있다고 알려져 있다(Wu와 Shah, 2017). α-Glucosidase는 소장 상피세포에 존재하는 탄수화물 가수분해 효소로 올리고당과 이당류의 α-1,4-글리코사이드 결합의 가수분해를 촉진시켜 포도당으로 전환시키는 역할을 함으로써 혈당을 상승시킨다(Kim 등, 2015). 이후 포도당과 같은 환원당이 체내에서 과도하게 증가하게 되면 단백질과 비효소적 결합을 통해 최종당화산물을 형성하게 되는데, 형성 이후 분해되지 않아 계속 체내에 잔존하게 되며 세포의 수용체와 결합하여 활성 산소종을 생성함으로써 세포를 손상시켜 당뇨 합병증을 유발한다고 알려져 있다(Jeong과 Kim, 2017). 따라서 본 연구를 통해 AEEL이 장내 유익균으로 알려진 L. brevis의 생육에 효과를 가지고 있는지 확인하고, 더불어 α-glucosidase 억제 활성 평가를 통한 체내 단당류 형성 및 최종당화산물의 형성 억제 활성을 확인하고자 수행되었으며 결과는 Fig. 3과 같다.
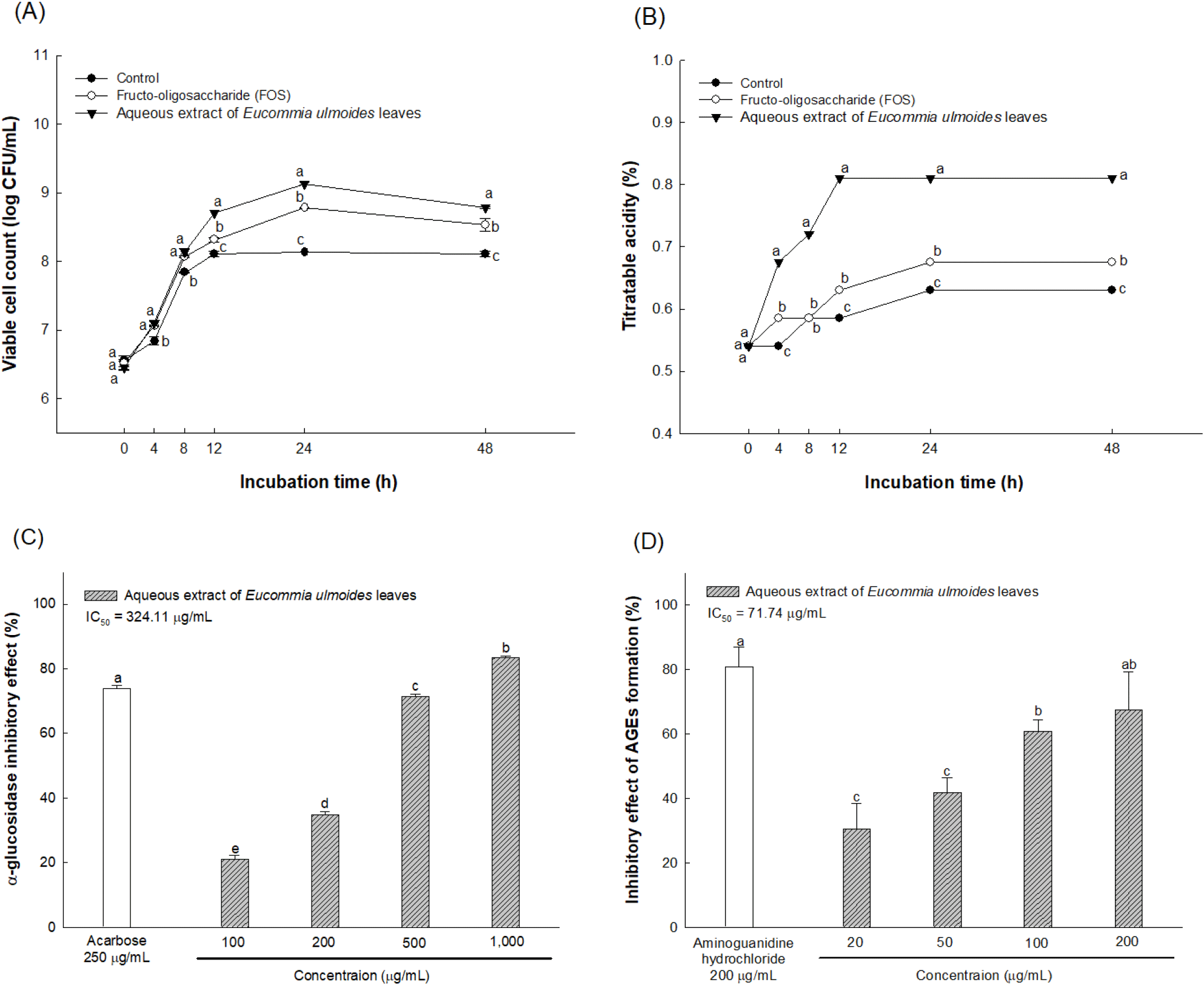
L. brevis의 생균수를 확인하였을 때 최초 배양한 0시간대에서는 양성대조군(FOS), AEEL을 첨가한 배지에서 대조군과 유의적인 차이가 확인되지 않았다. 하지만 시간이 경과함에 따라 AEEL 첨가 그룹이 대조군 및 FOS 첨가 그룹에 비해 생균수가 증가하였으며 배양 12시간 후에 FOS를 첨가한 그룹(2.05×108CFU/mL)에 비해 AEEL 첨가 그룹(5.00×108CFU/mL)에서 우수한 생균수가 나타났다(Fig. 3(A)). 적정산도의 경우, 배양 4시간 후부터 AEEL을 첨가한 배지(0.67±0.00)가 FOS를 첨가한 배지(0.58±0.00)에 비해 유의적으로 높은 산도가 나타났으며 시간이 경과함에 따라 모든 그룹에서 증가하는 경향이 나타났다. 하지만 배양 24시간 후부터는 산도의 증가 정도가 감소하였으며 이때 AEEL을 첨가한 배지(0.81±0.00)에서 가장 우수한 산도를 가지는 것을 확인하였다(Fig. 3(B)). 또한, AEEL의 α-glucosidase 억제 활성에서는 AEEL의 1,000 μg/mL 농도에서 82.50%의 우수한 억제 활성을 나타내었고 최종당화산물 생성 억제 활성에서 AEEL의 200 μg/mL 농도에서 67.39%의 우수한 생성 억제 활성을 나타내었다(Fig. 3(C), (D)).
Zhao 등(2020)의 연구에서 두충 잎의 0%, 30%, 60%, 75% 90% 에탄올 추출물을 각각 MRS 배지와 혼합한 후 유산균으로 알려져 있는 Limosilactobacillus reuteri(L. reuteri), Lactobacillus bulgaricus(L. bulgaricus), Lacticaseibacillus rhamnosus(L. rhamnosus) 및 Lacticaseibacillus paracasei (L. paracasei)를 분주하여 37°C에서 24시간 배양했을 때 두충 잎 물 추출물에서 다른 에탄올 추출물에 비해 가장 우수한 유산균 증식 효과를 가지는 것으로 보고하였다. 또한, Fotschki 등(2022)의 연구에서는 랫에 anthocyanin과 tannin 등이 함유된 폴리페놀 제재를 섭식시켰을 때 장내 대표적인 유산균으로 알려진 Lactobacillus 속과 Bifidobacterium 속의 상대적인 비율이 랫의 장에서 증가하여 폴리페놀이 유산균의 증식에 영향을 미쳤다고 보고하였다. 따라서 본 연구의 AEEL에 함유되어 있는 다양한 폴리페놀에 의해 L. brevis의 생육에 영향을 미친 것으로 판단되며 L. brevis는 탄수화물 가수분해 억제 활성을 가지고 있다고 알려져 있기 때문에 혈당 상승 억제에 도움이 될 것으로 보인다. 탄수화물 가수분해 억제제는 탄수화물의 가수분해 속도를 감소시켜 탄수화물이 소장 하부까지 퍼지게 하는데 이러한 소화 과정의 확산은 포도당이 혈액으로 흡수되는 전반적인 속도를 지연시킴으로써 식후 혈당의 상승을 억제시킨다(Kim 등, 2015). Assefa 등(2019)의 연구에서는 phenolics와 flavonoid를 비롯한 다양한 phytochemical이 α-glucosidase 억제 활성을 가져 혈당 상승을 억제하며 항당뇨 치료제로 알려진 acarbose가 가지고 있는 복통, 설사와 같은 부작용을 동반하지 않는다고 보고되고 있다. 또한, Zhang 등(2015)의 연구에서 두충 잎으로 0%, 20%, 40%, 60%, 80% 에탄올로 추출하여 α-glucosidase 억제 활성을 측정하였고, 물 추출물에서 다른 에탄올 추출물보다 우수한 억제 활성을 나타내어 본 연구에서와 같이 AEEL의 탄수화물 가수분해 억제제로써 효과를 나타냈다. 따라서 부작용을 동반하지 않는 천연 소재인 AEEL이 L. brevis의 생육을 자극하고 탄수화물 가수분해를 억제하여 체내 혈당의 상승과 최종당화산물의 형성을 억제할 수 있는 소재로써 이용 가능성이 있다고 판단된다.
고성능 액체크로마토그래피를 통해 AEEL의 생리활성 물질을 분석한 결과는 Fig. S1과 같다. HPLC를 통해 물질을 분리하였을 때 260 nm의 파장에서 크로마토그램을 확인하였을 때 12.797분과 14.737분에서 두 가지 주요 peak를 확인하였다(Fig. S1(A)). 이후 chlorogenic acid와 rutin을 시료를 분석한 방법으로 분석하여 retention time과 UV 스펙트럼을 비교했을 때 각각 998.96, 999.21의 similarity를 나타내 chlorogenic acid와 rutin이 각 peak에 해당하는 물질임을 확인하였다(Fig. S1(B), (C)). 이후, AEEL에 함유된 chlorogenic acid와 rutin을 정량 분석하였고 함량은 각각 138.31 μg/mg of dried weight, 32.83 μg/mg of dried weight로 확인되었다(Table 1).
| No. | RT1) (min) | Compound | Contents (μg/mg of dried weight) |
|---|---|---|---|
| 1 | 12.797 | Chlorogenic acid | 138.31±0.532) |
| 2 | 14.737 | Rutin | 32.83±0.12 |
Chlorogenic acid는 caffeic acid와 quinic acid가 ester 결합을 통해 생성되는 폴리페놀 화합물이며 구조적으로 5개의 하이드록실기(-OH)와 1개의 카르복실기(-COOH)가 다양한 생리활성에 영향을 미친다고 알려져 있다(Wang 등, 2022). Zhou 등(2016)의 연구에서는 마우스의 장에서 미토콘드리아를 얻은 후 chlorogenic acid가 장 조직에서 H2O2를 처리한 미토콘드리아의 막 전위 변화를 완화시키고 활성 산소종의 생성을 억제하며 체내 항산화 효소인 SOD 및 GSH의 감소를 억제하는 것으로 보고되었다. 또한, Singh 등(2021)의 연구에서 chlorogenic acid가 우수한 α-amylase 및 α-glucosidase의 억제 활성을 가지며 streptozotocin(STZ)으로 유도된 당뇨 마우스 모델에서 혈당을 측정하였을 때 식후 혈당을 효과적으로 감소시키는 것으로 보고되었다.
Rutin은 이당류인 rutinose와 flavonol인 quercetin이 글리코사이드 결합한 구조를 가지는 flavonoid이며 항산화 및 항당뇨 활성이 있다고 보고되고 있다(Ganeshpurkar과 Saluja, 2017). Liu 등(2019)의 연구에서는 rutin이 high-fat-diet(HFD) 유도 마우스에서 장내 유익균으로 알려진 Bifidobacterium 속의 증식을 자극하고 단쇄지방산의 생산을 촉진시키며 혈장 LPS 수준을 감소시켜 염증을 완화할 수 있다고 보고되었다.
이를 통해 AEEL이 항산화 활성을 나타내는데 기여한 다양한 폴리페놀 화합물 중 일부가 chlorogenic acid와 rutin임을 확인하였고 본 연구에서 chlorogenic acid와 rutin이 가지고 있는 생리활성 효과로 인해 항산화 활성뿐만 아니라 AEEL을 이용하여 수행한 다양한 실험에서 우수한 활성을 나타내는데 영향을 나타낸 것으로 판단된다. 결과적으로 본 연구에서 AEEL이 항산화 활성, 장 상피세포 보호효과, L. brevis 증식 효과 및 탄수화물 가수분해 효소 억제 활성을 가지고 있는 것으로 나타났으며 이러한 활성이 chlorogenic acid와 rutin 등의 주요 생리활성 물질에 의해 기인한 것으로 판단된다. 하지만 두충 잎이 보유한 다양한 생리활성 효과를 검증하기 위해서 추가적인 분석을 통해 chlorogenic acid와 rutin 뿐만 아니라 다른 생리활성 물질을 확인해야 할 것으로 판단된다.
4. 요약
본 연구에서는 AEEL의 고당으로 유도되는 장 상피세포 보호효과 및 L.brevis의 증식에 대한 영향을 확인하기 위해 수행되었다. AEEL은 우수한 환원력, 라디칼 소거 활성 및 지질과산화물 생성 억제 활성을 나타냈으며 고당, H2O2, 및 LPS로 유도된 HT-29 세포에서 우수한 세포 생존율 및 산화적 스트레스 억제 활성을 가지는 것으로 나타났다. 또한, AEEL은 항당뇨 활성을 가진 장내 유익균인 L.brevis의 증식에 효과를 보였으며 탄수화물 가수분해 효소인 α-glucosidase 및 최종당화산물 생성에서도 우수한 억제 활성을 나타냈다. 따라서, AEEL의 주요 생리활성 물질을 확인하기 위해 HPLC 분석한 결과, chlorogenic acid와 rutin 등이 확인되었다. 이러한 결과들을 통해, AEEL이 혈당 상승을 억제하고 고당으로 유도되는 산화스트레스로부터 장 건강을 보호하는 기능성 식품 소재로써 활용될 수 있을 것으로 사료된다.