1. 서론
최근 소득 수준 향상과 사회활동이 증가함에 따라 국내 화장품 산업은 약 10조 원의 대형시장을 형성하고 있다. ‘화장품법’이 시행되고, 화장품 관련 산업은 점차 높고 기능적인 기술을 요구하며 새로운 원료개발의 요구 또한 높아지고 있다. 특히 미백, 항노화 등의 기능을 가진 기능성 화장품 관련 시장이 급격하게 커질 것으로 전망된다. 환경친화적이고 자연지향적인 최근 추세에 따라 화장품 속의 유효성분도 동물 또는 식물 유래의 천연물을 기반으로 다양한 형태로 화장품에 배합되어 이용되고 있다. 천연적이고 자연적인 것을 선호하는 추세에 따라 이러한 개발 추세는 향후에도 지속될 것으로 예상된다. 현재 국내 고유의 신원료 개발 실적이 저조하지만 개발의 여지가 충분하기에 천연 원료를 이용하여 제품을 개발을 촉진한다면 이는 수출 증대로 이어져 국내 화장품 산업의 활성화와 더불어 국제 경쟁력을 향상시킬 수 있을 것이다(Sohn 등, 2004).
발효 화장품은 미생물을 발효시키는 과정에서 유효성분들을 추출함으로써 함유 성분들을 빠르게 피부에 흡수되도록 하고 기존의 효소의 효능을 배가시킨다. 발효 화장품이 국내 화장품 시장의 트렌드로 떠오르고 있으며 국내 여러 대기업에서 발효기법을 적용한 화장품들을 출시하여 높은 매출과 동시에 빠르게 성장하고 있다(Lee 등, 2010). 또한, 유산균 발효를 통한 천연물의 생리활성 및 유효 활성 성분의 증가를 목적으로 다양한 연구들도 진행되고 있다(Li 등, 2023).
생물전환(bioconversion)이란 미생물과 효소를 이용한 발효를 통해 원하는 여러 대사산물을 생산하고 제조하는 기술을 의미한다. 기존의 발효공정과는 달리 전구물질로부터 미생물 또는 효소의 기질에 대한 선택성을 이용하여 산물을 생산한다. 발효기술을 고도화시킨 생물전환 공정은 특히, 건강기능성식품, 현대 의약품이나 화장품 분야에서 여러 가지 방법으로 이용되고 있다(Fuller, 1989).
참꽃마리(Trigonotis radicans var. sericea)는 지치과에 속하며 우리나라 각처의 들과 산의 습한 곳에서 나는 다년생 초본이다. 생육환경은 양지 혹은 반그늘에서 자라며 키는 10-15 cm이고, 잎의 길이는 1.5-4 cm로 끝은 뾰족하고 난형으로 어긋나있다. 개화시기는 5-7월이며 꽃은 연한 남색으로 피고 지름은 0.7-1 cm이며 열매는 9월경에 달리고 어린순은 식용으로도 쓰이고 있다(Jung 등, 2010).
현재까지 참꽃마리의 미생물 발효에 의한 bioconversion에 대한 선행연구는 아직 전무하다. 따라서 본 연구에서는 한국 전통 발효식품인 깍두기에서 분리한 Lactobacillus brevis를 이용하여 참꽃마리를 발효하여 bioconversion을 유도하였으며, 비발효 참꽃마리와 발효 참꽃마리의 에탄올 추출물의 항산화 활성과 미백 활성 및 주름 개선효능의 변화를 확인하여 발효 참꽃마리 추출물이 향후 천연기반 기능성 화장품 소재로써의 활용 가능성을 위한 기초 자료를 제공하고자 하였다.
2. 재료 및 방법
본 연구에서 사용된 참꽃마리(Trigonotis radicans var. sericea)는 한국토종야생산야초연구소(Busan, Korea)에서 구매하여 뿌리를 제거하고 전초를 세척한 후 50°C dry oven(FO600M, Jeiotech, Daejeon, Korea)에서 건조하고 40 mesh로 분쇄한 후 4°C에서 저장하며 시료로 사용하였다.
참꽃마리 발효에 사용한 Lactobacillus brevis는 깍두기에서 분리한 젖산균으로 경북대학교 식품공학부에서 보관 중인 균주를 사용하였다. 균주의 보관은 균 배양액으로 40% glycerol(Duksan, Seoul, Korea)과 균배양액을 1:1의 비율로 혼합하여 20% glycerol이 되도록 조성하여 -80°C deep freezer에 보관하며 실험에 사용하였다. MRS broth에 접종한 후 2회 계대 배양하여 삼각 플라스크에 MRS broth 200 mL, L. brevis 배양액 2%(v/v) 접종하여 37°C incubator에서 24시간 정치배양으로 증균하였다.
삼각 플라스크에 배양한 젖산균 배양액 200 mL에 참꽃마리 발효는 건조 참꽃마리 전초 시료 40 g을 첨가하여 37°C shaking incubator에서 72시간 동안 진탕 배양하여 발효시켰다. 이후 발효시킨 시료를 동결건조하여 발효 참꽃마리 시료로 사용하였다. 추출물 제조는 Cho 등(2022)이 보고한 참꽃마리 전초의 최적 추출조건인 추출 용매로 60% ethanol을 선정하여 발효하지 않은 참꽃마리와 발효한 참꽃마리를 각각 추출하였다. 즉, 60% ethanol 100 mL에 참꽃마리 및 발효된 참꽃마리 전초 분말을 각각 1 g을 첨가하여 4°C에서 18시간 동안 교반 추출하였으며 추출물은 각각 Whatman No. 1 filter paper(Whatman Inc., Piscataway, NJ, USA)로 여과하여 시료로 사용하였다.
참꽃마리와 발효된 참꽃마리의 TPC 함량은 Folin-Denis (1912)의 방법에 준하여 측정하였으며, 각 시료 추출물 1 mL, 95% ethanol 1 mL와 증류수 5 mL를 넣고 1 N Folin-ciocalteu reagent 0.5 mL를 첨가하여 vortexing하고 5분간 방치한 후 5% Na2CO3 1 mL를 첨가하여 vortexing한 후 암실에 1시간 동안 방치하였다. 725 nm의 파장에서 UV-vis photospectrometer(Optizen 3220 UV, Merasys Co., Ltd., Seoul, Korea)를 이용하여 흡광도를 측정한 후 표준물질로 gallic acid를 이용한 표준 곡선을 통해 TPC 함량을 계산하였다.
참꽃마리와 발효된 참꽃마리의 phenolic profile의 변화를 분석하기 위해 참꽃마리 60% ethanol 추출물과 발효된 참꽃마리 60% ethanol 추출물을 disposable membrane filter unit DISMIC-13HP(0.2 μm; ADVANTEC, Tokyo, Japan)를 이용하여 여과한 후 HPLC용 methanol과 1:1 비율로 혼합하여 HPLC 분석을 위한 시료로 이용하였다. HPLC 분석은 Table 1의 분석조건에 따라 실시하였다.
DPPH radical scavenging activity는 Blois(1958)의 방법에 준하여 측정하였다. 각 시료 추출물 1 mL에 60 μM DPPH 3 mL를 첨가하고 vortexing하여 15분 동안 실온에서 반응시킨 후 517 nm에서 흡광도를 측정하였다. Butylated hydroxytoluene(BHT, Sigma-Aldrich Co., St. Louis, MO, USA)을 positive control로 사용하였으며, DPPH radical scavenging activity(%)는 (1 - sample의 흡광도 / control의 흡광도) × 100으로 계산하여 나타내었다.
ABTS radical cation decolorization은 Fellegrini 등(1999)의 방법에 준하여 측정하였다. 7 mM ABTS 용액 50 mL와 140 mM K2S2O8 용액 880 μL를 혼합하여 암실에 14-16시간 방치한 용액과 50% ethanol을 1:88 비율로 혼합하여 734 nm에서 흡광도 값을 약 0.7±0.02로 맞춘 후 이를 ABTS solution으로 사용하였다. 각 시료 추출물 200 μL와 ABTS solution 4 mL를 첨가한 후 vortexing하여 1.5분간 반응시킨 다음 734 nm에서 흡광도를 측정하였다. BHT를 positive control로 사용하였으며, ABTS radical 소거 활성(%)은 (1 - sample의 흡광도 / control의 흡광도) × 100으로 계산하여 나타내었다.
Antioxidant protection factor는 Andarwulan과 Shetty(1999)의 방법에 준하여 측정하였다. Chloroform 10 mL에 β-carotene 0.01 g을 녹인 용액 5 mL를 빛을 차단한 농축용 수기에 water bath 40°C에서 농축시킨 후 tween 40 920 μL, linoleic acid 100 μL와 DW 250 mL에 H2O2 880 μL를 첨가한 후 모두 혼합하여 emulsion을 제조하였다. 각 시료 추출물 100 μL에 제조한 emulsion 5 mL를 넣고 vortexing하여 water bath 50°C에서 빛을 차단한 후 30분간 반응시키고 5분간 ice water에서 방치한 후 470nm에서 흡광도를 측정하였다. Positive control은 BHT를 사용하였으며, PF는 (sample의 흡광도 / control의 흡광도)로 계산하여 나타내었다.
Tyrosinase 저해 효과는 Vicent와 Hearing(1987)의 방법에 준하여 측정하였다. 각 시료 추출물 200 μL와 0.1 M sodium phosphate buffer(pH 6.8) 용액 2.3 mL, 1.5 mM L-tyrosine 기질 용액 400 μL를 첨가하고 buffer (pH 6.8)로 제조한 250 U/mL mushroom tyrosinase (Sigma-Aldrich Co.) 100 μL를 넣은 후 vortexing하고 37°C water bath에서 20분간 반응시킨 후 475 nm에서 흡광도를 측정하였다. Positive control은 kojic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였으며, tyrosinase 저해 효과(%)는 (1 - sample의 흡광도 / control의 흡광도) × 100으로 계산하여 나타내었다.
Collagenase 저해 효과는 Wunsch과 Heidrich(1963)의 방법을 준하여 측정하였다. 각 시료 0.1 mL, 4 mM CaCl2를 0.1 M Tris-HCl buffer(pH 7.5)에 첨가하여 제조한 용액으로 녹인 4-phenylazobenzyloxycarbonyl-Pro-Leu-Gly-Pro-D-Arg(Sigma-Aldrich Co.) 0.4 mM의 기질 용액 250 μL를 혼합한 후 buffer(pH 7.5) 0.15 mL를 넣고 buffer(pH 7.5)를 이용하여 100 U/mL collagenase from Clostridium histolyticum(Sigma-Aldrich Co., St. Louis, MO, USA)을 0.15 mL 첨가하였다. 시약 반응은 20분간 water bath 25°C에서 반응시킨 후 6% citric acid 0.5 mL를 넣어 반응을 정지시킨 후 ethyl acetate 2 mL를 첨가하여 vortexing하고 320 nm에서 흡광도를 측정하였다. (-)Epigallocatechin-3-O-gallate(EGCG)를 positive control로 사용하였으며, collagenase 저해 효과(%)는 (1 - sample의 흡광도 / control의 흡광도) × 100으로 계산하여 나타내었다.
Elastase 저해 효과는 Kraunsoe 등(1996)의 방법에 준하여 측정하였다. 각 시료 0.1 mL, 0.2 M Tris-HCl buffer(pH 8.0) 1 mL, 기질 용액으로 0.8 mM N-succinyl-(Ala)3-ρ-nitroanilide를 0.1mL를 혼합한 후 1.0 U/mL porcine pancreatice elastase(Sigma-Aldrich Co.) 0.1 mL를 첨가하여 vortexing하였다. 시약 반응은 water bath 37°C에서 20분간 반응시킨 후 410 nm에서 흡광도를 측정하였다. (-)Epigallocatechin-3-O-gallate(EGCG)를 positive control로 사용하였으며, elastase 저해 효과(%)는 (1 - sample의 흡광도 / control의 흡광도) × 100으로 계산하여 나타내었다.
3. 결과 및 고찰
수많은 phytochemical이 식물체 내에 존재하는데 대다수가 2차 대사산물로 이루어져 있다. 이 중 phenolic compounds는 널리 알려져 있는 식물체에 존재하는 2차 대사산물의 한 종류인 천연 항산화제이며 대부분의 식물체에 존재하기 때문에 추출과 정량이 비교적 간편하다(Hossain 등, 2013). 참꽃마리 60% ethanol 추출물과 L. brevis 발효에 따른 발효 참꽃마리 60% ethanol 추출물의 TPC 함량 분석 결과는 Table 2에서와 같이 참꽃마리 추출물은 18.6 mg/g, 발효 참꽃마리 추출물은 18.2 mg/g으로 L. brevis 발효에 따른 참꽃마리 추출물의 TPC 함량의 용출량에서는 변화가 크게 나타나지 않는 것으로 확인되었다.
| Sample | Contents of total phenolics (mg/g) |
|---|---|
| T. radicans 60% ethanol extract | 18.6±0.02 |
| Fermented T. radicans 60% ethanol extract | 18.2±0.00*1) |
L. brevis 발효에 의한 bioconversion으로 참꽃마리와 발효 참꽃마리 추출물의 유용성분 phenolics profile의 변화를 확인하기 위해 참꽃마리 60% ethanol 추출물과 발효 참꽃마리 60% ethanol 추출물을 이용하여 HPLC를 통해 분석하였다. 그 결과 Fig. 1(A)와 같이 60% ethanol 참꽃마리 추출물 chromatogram에서는 총 4종의 peak가 분리된 것으로 확인되었으며 retention time 2.78분에서 112.2 mAU, 3.22분에서 258.7 mAU, 3.27분에서 261.6 mAU, 3.91분에서 29.5 mAU의 peak를 나타내었다. 발효 참꽃마리 60% ethanol 추출물은 Fig. 1(B)에서와 같이 총 8종의 peak가 분리된 것으로 확인되었으며 retention time 2.72분에서 88.5 mAU, 3.2분에서 121.4 mAU, 3.56분에서 23.2 mAU, 3.62분에서 23.7 mAU, 3.95분에서 55 mAU, 4.28분에서 31.2 mAU, 4.82분에서 6.2 mAU, 이후 23.76분에서 1.2 mAU의 peak가 분리된 것으로 확인되었다. 따라서 L. brevis 발효를 통한 bioconversion에 의해 추출물 간의 유용물질의 phenolics profile 차이가 존재하는 것을 확인할 수 있었고 그 결과, 발효 참꽃마리 추출물에서 더 다양한 phenolics가 생성되었고 이러한 결과가 발효 참꽃마리의 항산화, 미백, 주름 개선 활성에 영향을 미칠 것으로 예상되었다. 향후, 미생물에 의한 참꽃마리 발효과정에서 생물전환되는 물질에 관한 연구가 필요할 것으로 사료된다.
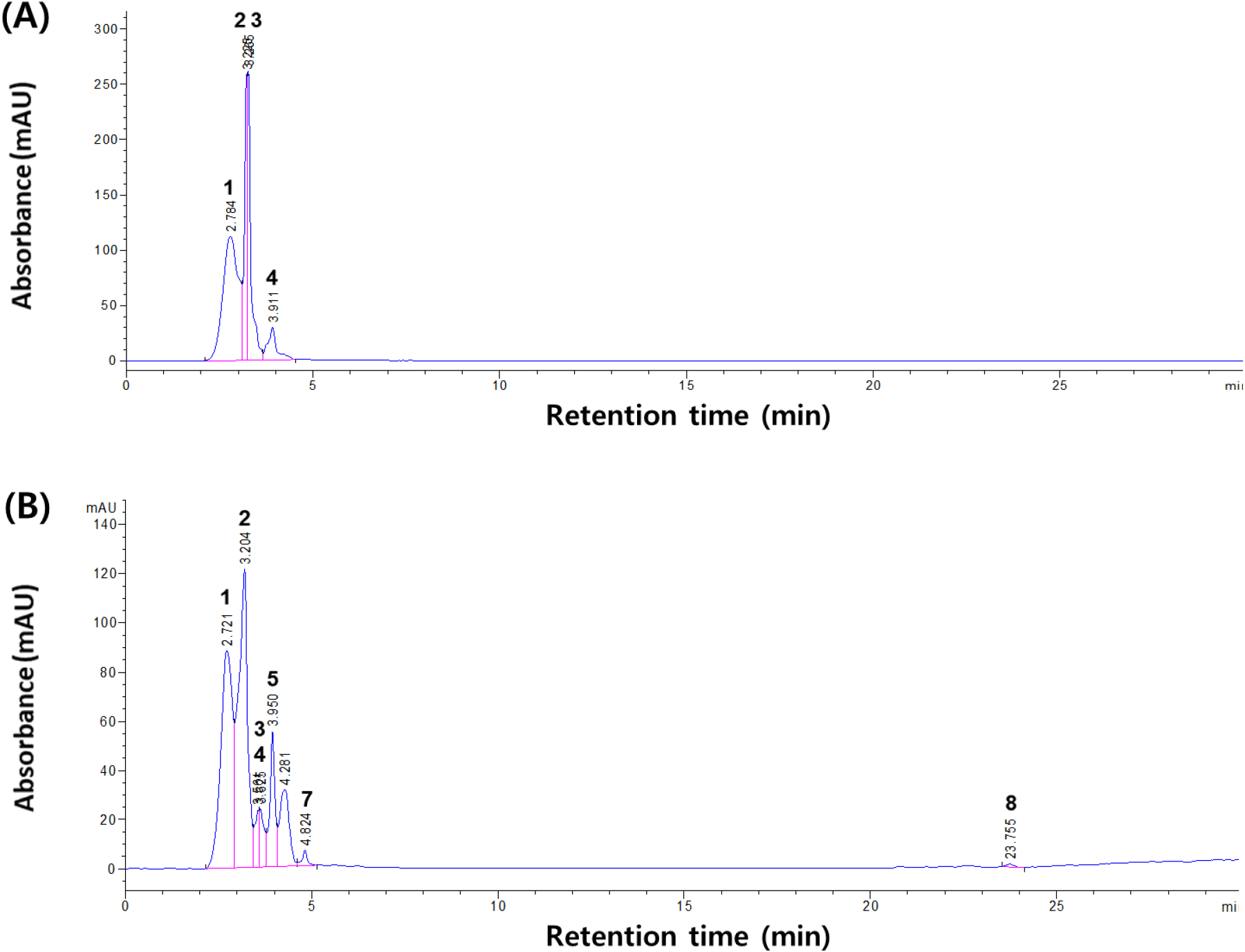
이와 유사하게 식물 시료의 유산균 발효를 통한 생물전환으로 인하여 항산화, 주름 개선, 미백 효과를 증진시킬 수 있으며, 미생물을 통한 천연물의 발효는 기능성 화장품에서 요구하는 기능성 효과를 증가시킬 수 있는 매우 유용한 기술이라 판단된다(Park 등, 2019; Um 등, 2017).
DPPH에 의한 항산화 활성은 화합물이 DPPH radical에 전자를 공여함으로써 천연물질 추출물의 DPPH free radical의 소거능을 측정하는데 널리 활용되고 있으며 소수성 물질의 항산화 효능을 측정할 수 있다(Arnao 등, 2000; Kang 등, 2004; Kyu, 2010). 참꽃마리 및 발효 참꽃마리의 DPPH radical scavenging activity를 측정한 결과는 Fig. 2(A)에서와 같이 각각 60% ethanol 추출물 50, 100, 150, 200 μg/mL phenolics 농도에서 참꽃마리 추출물은 71.21, 67.70, 64.90, 62.33%의 소거 활성을 나타내었고, 발효 참꽃마리 추출물은 88.56, 88.72, 88.17, 87.78%의 소거 활성을 나타내어 발효 참꽃마리 추출물에서 bioconversion에 의한 DPPH 소거 활성의 증대가 관찰되었다. BHT는 동일한 농도에서 52.14, 63.35, 67.00, 67.78%로 상대적으로 발효 참꽃마리 추출물이 DPPH radical에 대한 항산화 활성이 낮은 농도에서부터 매우 우수한 것으로 확인되었다.
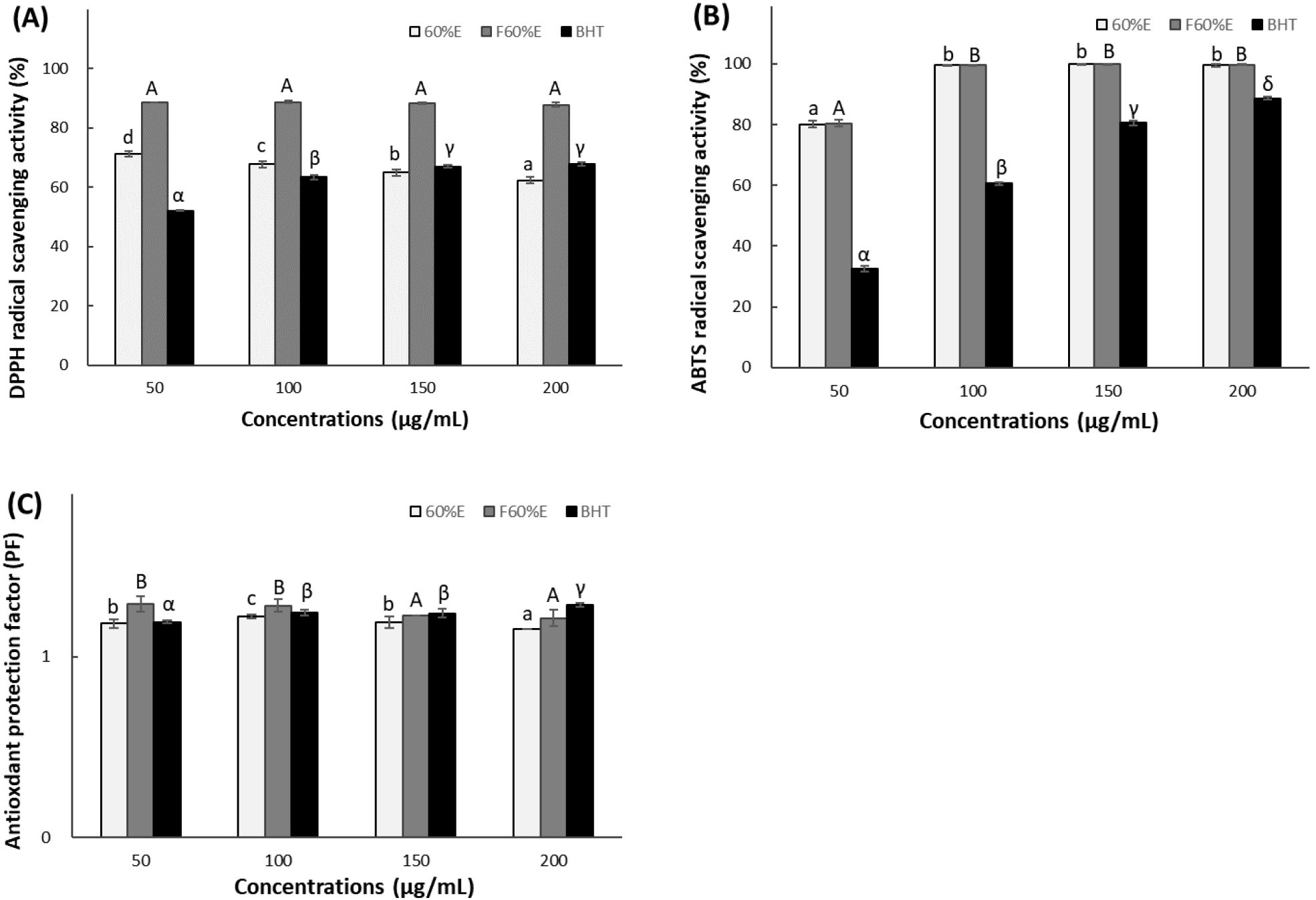
ABTS는 DPPH와 유사한 항산화 효능의 지표이지만 친수성과 소수성 물질의 항산화 효능을 측정할 수 있고, DPPH와 달리 흡광도 측정 시 시료의 색소에 의한 문제점이 없으며 반응이 비교적 빠르다(Arnao 등, 2000). ABTS radical cation decolorization 활성을 측정한 결과는 Fig. 2(B)에서와 같이 50, 100, 150, 200 μg/mL 농도에서 참꽃마리 추출물은 80.05, 99.59, 99.80, 99.49%의 활성을 나타내었고, 발효 참꽃마리 추출물은 80.36, 99.64, 99.85, 99.74%의 활성을 나타내었다. BHT는 동일한 phenolics 농도에서 32.53, 60.56, 80.59, 88.64%로 참꽃마리 및 발효 참꽃마리가 BHT보다 높은 항산화 활성을 나타내었다. 따라서 참꽃마리 및 발효 참꽃마리 추출물 모두 낮은 농도에서도 ABTS radical cation decolorization 활성이 높아 우수한 항산화력을 나타내는 것을 확인하였다.
Antioxidant protection factor는 불포화지방산의 산패 중에 생성되는 free radical과 β-carotene이 반응하여 산화되면서 반응성을 잃게 되고 연쇄 산화반응이 중단되는 원리를 활용한 측정법으로 지용성 물질의 항산화 효능을 측정한다(Andarwulan 등, 1999; Toyosaki, 2002). 지용성 항산화 효능의 지표인 antioxidant protection factor의 경우 Fig. 2(C)에서와 같이 50, 100, 150, 200 μg/mL 농도에서 참꽃마리 추출물은 1.15-1.22 PF를 나타내었고 발효 참꽃마리 추출물은 1.21-1.29 PF를 나타내어 bioconversion에 의해 발효 참꽃마리의 지용성 물질에 대한 항산화력이 더 높아진 것이 확인되었다. 또한, 발효 참꽃마리의 PF 결과는 BHT보다 우수한 것으로 확인되었다.
표피 기저층에 존재하는 멜라닌(melanin)은 멜라닌 세포(melanocyte) 내의 멜라닌소체(melanosome)에서 합성되며 멜라닌 생성의 주요 효소 중 하나인 tyrosinase의 활성을 저해함으로써 멜라닌 생성을 억제하면서 미백 효과를 유도할 수 있다. 멜라닌 합성은 멜라닌을 생성하는 중요한 효소인 tyrosinase의 활성도 및 이후 과정에 작용하여 최종산물인 멜라닌 양에 의해 결정된다(Busca 등, 2000; Im 등, 1999; Jung 등, 2008).
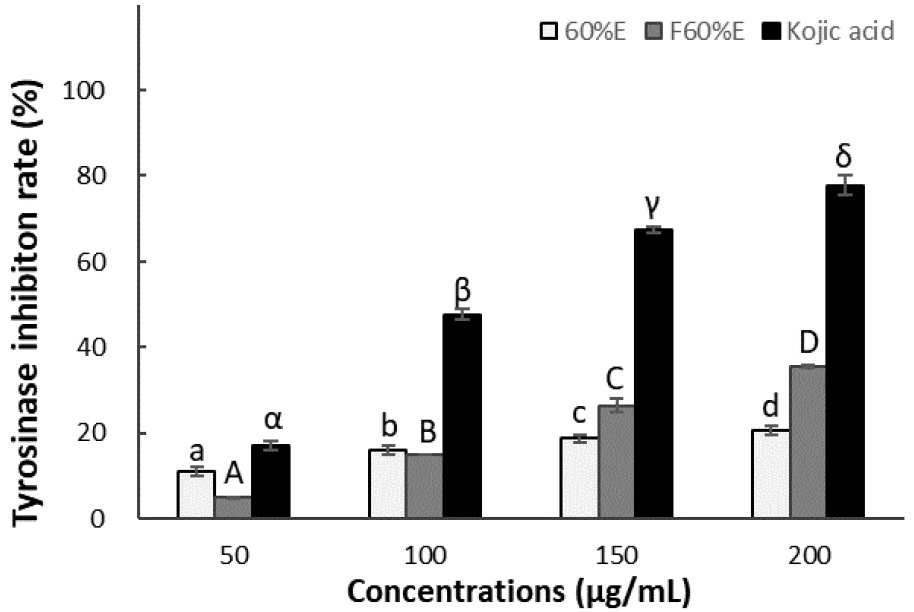
참꽃마리 및 발효 참꽃마리의 미백 효능을 확인하기 위해 tyrosinase 저해 효과를 알아보았다. 그 결과는 Fig. 3에서와 같이 50, 100, 150, 200 μg/mL의 농도에서 참꽃마리 추출물은 11.01, 16.07, 18.76, 20.65%의 저해 활성을 나타내었고 발효 참꽃마리 추출물의 경우 4.95, 14.96, 26.50, 35.51%의 저해 활성을 나타내어 bioconversion에 의해 생성된 물질에 의해 저해 효과가 높아진 것으로 판단되었으며, 이는 발효 참꽃마리 추출물이 미백 기능성 화장품에 더 적합한 소재인 것으로 확인되었다.
피부의 진피층의 90%가 collagen으로 구성되어 있으며 이는 피부 노화와 매우 밀접한 관계를 가지고 있다. 또한, 탄력 섬유인 collagen은 elastin과 함께 그물망 구조로 진피에 존재하며 피부 노화의 특성 중 하나인 주름의 원인 collagen을 분해하는 collagenase 활성 저해 효과와 elastin을 분해하는 elastase 활성 저해 효과 측정을 통해 주름 개선효능을 확인할 수 있다(Fisher 등, 1999; Geerts 등, 1990; Tsukahara 등, 2006).
참꽃마리 및 발효 참꽃마리의 주름 개선효능을 확인하기 위해 collagenase 저해 효과를 알아보았다. 그 결과는 Fig. 4(A)에서와 같이 50, 100, 150, 200 μg/mL 농도에서 참꽃마리 추출물은 12.47, 21.41, 38.03, 48.22%의 저해 활성을 나타내었고 발효 참꽃마리 추출물은 9.80, 24.67, 39.70, 50.61%의 저해 활성을 나타내었다. EGCG는 동일 농도에서 5.12, 8.38, 14.98, 16.40%의 저해 활성을 나타내어 참꽃마리에 비해 발효 참꽃마리 추출물이 collagenase 저해 효과가 더 우수한 것으로 확인되었다. 또한, 발효 참꽃마리 추출물의 농도를 더 높인다면 참꽃마리 추출물보다 collagenase 저해 활성이 더 높아질 것으로 예상되었다. 따라서 발효 참꽃마리 추출물이 주름 개선을 위한 기능성 화장품에 적용이 가능할 것으로 판단되었다.
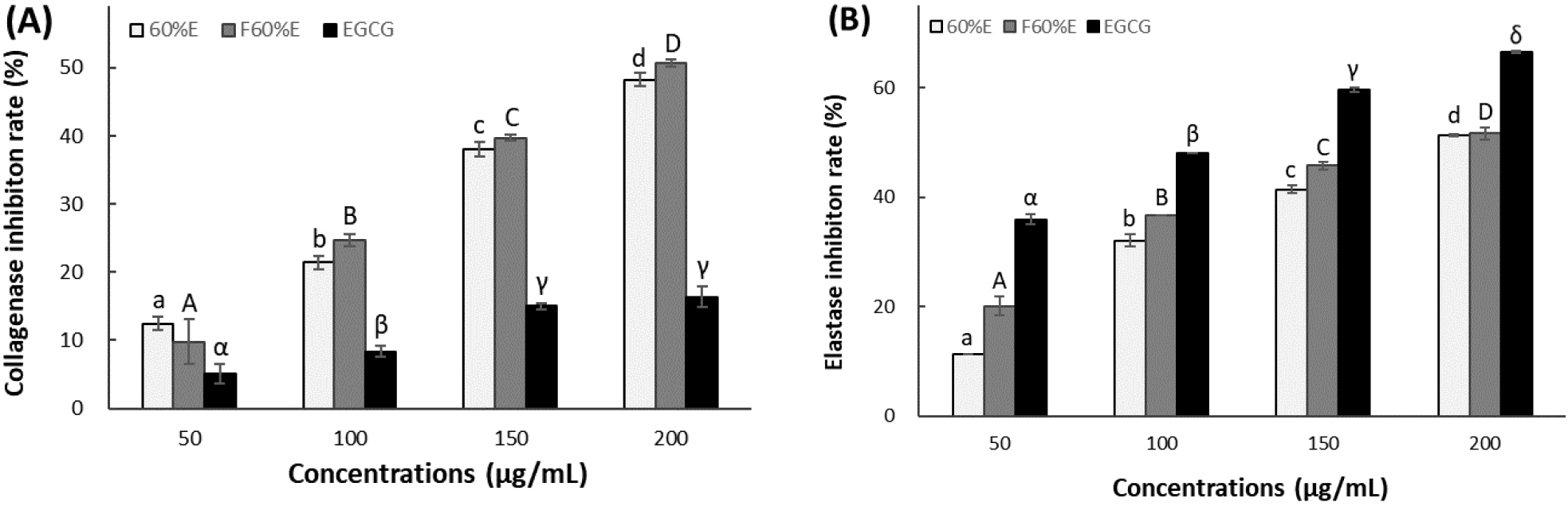
참꽃마리 및 발효 참꽃마리의 주름 개선효능을 확인하기 위해 elastase 저해 효과를 알아보았다, 그 결과 Fig. 4(B)에서와 같이 50, 100, 150, 200 μg/mL 농도에서 참꽃마리 추출물은 11.40, 32.07, 41.40, 51.35%의 저해 활성을 나타내었고 발효 참꽃마리 추출물은 20.10, 36.58, 45.75, 51.66%의 저해 활성을 나타내었다. 동일 농도에서 EGCG는 35.96, 48.08, 59.59, 66.58%의 저해 활성을 나타내었다. Bioconversion에 의해 발효 참꽃마리가 참꽃마리에 비해 낮은 농도에서부터 elastase 저해 효과가 더 우수한 것으로 확인되었다. 따라서 발효 참꽃마리 추출물이 주름 개선을 위한 기능성 화장품에 더 적합하며 적용이 가능할 것으로 판단되었다.
4. 요약
본 연구에서는 참꽃마리(Trigonotis radicans var. sericea) 전초를 이용하여 참꽃마리와 L. brevis로 발효한 참꽃마리를 각각 60% ethanol로 추출하여 항산화 및 미백과 피부 주름 생성에 관여하는 효소 저해 효과를 비교해보았다. 최적의 추출조건인 참꽃마리 60% ethanol과 발효 참꽃마리 60% ethanol의 total phenolics compounds 함량은 각각 18.6 mg/g, 18.2 mg/g으로 TPC 함량의 용출량에서는 큰 차이가 나타나지 않았다. HPLC를 이용하여 L. brevis 발효를 통한 발효 참꽃마리 추출물의 유용성분 변화를 관찰한 결과, 발효 과정 중 bioconversion에 의해 추출물 간의 phenolics profile 차이가 존재하는 것을 확인할 수 있었고 발효 참꽃마리 추출물에 더 많은 phenolics가 생성된 것을 확인하였다. 그 결과, 추출물간의 항산화, 미백, 주름 개선 활성의 차이에 영향을 미칠 것으로 예상되었다. 발효 참꽃마리 추출물의 DPPH radical scavenging activity를 측정한 결과 50, 100, 150, 200 μg/mL phenolics 농도에서 88.56, 88.72, 88.17, 87.78%로 높은 소거 활성을 나타내었다. 또한, ABTS radical cation decolorization activity는 100, 150, 200 μg/mL phenolics 농도에서 참꽃마리와 발효 참꽃마리 추출물 모두 100%에 근접하며 매우 우수한 항산화 활성을 나타내었다. Antioxidant protection factor의 경우 발효 참꽃마리 추출물은 1.21-1.29 PF를 나타내었으며 참꽃마리 추출물은 1.15-1.22 PF를 나타내었다. 발효 참꽃마리 추출물의 tyrosinase 저해 활성은 150, 200 μg/mL에서 26.50, 35.51%의 저해 활성을 나타내었고 참꽃마리 추출물의 경우 18.76, 20.65%로 두 추출물간의 유의적인 차이를 보였으며 발효 참꽃마리 추출물의 미백 효과가 더 우수한 것으로 확인되었다. Collagenase 저해 활성에서도 발효 참꽃마리 추출물이 다소 높은 것으로 확인되었으며 elastase 저해 활성은 50, 100, 150 μg/mL에서 발효 참꽃마리 추출물 20.10, 36.58, 45.75%, 참꽃마리 추출물 11.40, 32.07, 41.40%로 참꽃마리 추출물과 비교하였을 때 유의적인 차이를 보여 발효 참꽃마리 추출물의 주름 개선 효과가 더 우수한 것으로 확인되었다. 따라서 발효하지 않은 참꽃마리 추출물과 비교하였을 때, bioconversion을 통한 발효 참꽃마리 추출물의 항산화, 미백 및 주름 개선 효과가 더 우수한 것을 확인할 수 있었고, 발효 참꽃마리 추출물을 이용하여 항산화 활성과 미백 및 주름 개선 효능에 우수한 기능성 화장품의 소재로써 이용이 가능할 것으로 기대된다.










