1. 서론
쌀은 한국을 포함한 아시아 지역에서 주식으로 활용되고 있으며 밀, 옥수수와 함께 세계 3대 식량작물로 꼽히는 중요한 식물체로 전분의 함량이 90% 이상으로 구성되어 있다(Juliano, 1985). 전분은 식물체의 광합성 작용에 의해 생성된 glucose가 사슬 및 분지형태로 결합된 저장 탄수화물로 인간의 에너지 대사에 중요한 영양원이다(Amagliani 등, 2016; Patindol 등, 2015). 전분은 glucose로 구성된 사슬형의 amylose와 분지형의 amylopectin으로 이루어져 있으며 이러한 glucose 단위체는 대부분 α-1,4 glycosidic 결합으로 연결되어 체내 소화효소에 의해 쉽게 분해되어 에너지로 사용되거나 다시 glycogen으로 합성되어 간, 근육에 저장된다(Adeva-Andany 등, 2016; Ball 등, 1996). 한편 입, 소장에서 분비되는 주요 전분 분해효소로 α-amylase, α-glucosidase가 있으며 소장 점막의 α-glucosidase에 의해 최종적으로 glucose가 생성, 흡수되어 혈당을 올리게 된다(Dhital 등, 2013; Gray, 1975).
Dextran은 주로 Leuconostoc mesenteroides 균주 유래의 glucosyltransferase로 알려진 dextran sucrase (DSase; EC 2.4.1.5) 효소에 의해 sucrose의 glucosyl 잔기가 transglucosylation을 통해 dextran으로 당전이되어 제조된 미생물 다당류로 보고되어있다(Lawford 등, 1979; Lindberg와 Svensson, 1968; Robyt 등, 1979). Glucose의 homopolysaccharide인 dextran은 전분과 달리 주요 사슬에 상당한 수의 연속적인 α-1,6 결합을 가지는 것이 특징이며 일반적으로 전체 결합의 50% 이상을 차지한다. 이러한 α-D-glucan은 유산균 유래의 경우 α-1,2, α-1,3 형태의 측쇄를(Hehre, 1941), 초산균 유래의 경우 α-1,4 분지 결합에서 유래하는 측쇄를 가지고 있으며(Yamamoto 등, 1993) 특정 생산 미생물 균주에 따라 dextran의 정확한 구조가 달라지게 된다(Misaki 등, 1980; Naessens 등, 2005).
Dextran dextrinase(DDase; EC2.4.1.2)는 G. oxydans 균주에 의해 생산된 ropy 맥주의 점성 물질에서 발견되었으며(Hehre, 1951) 효소작용을 통해 maltodextrin과 같은 짧은 maltooligosaccharide의 비환원성 말단의 glucose 잔기를 당전이하여 dextran으로 전환시키는 transglucosidase로 알려져 있다(Sadahiro 등, 2015). 이 효소는 배지의 조건에 따라 균주 내 세포 외막 및 주변 세포질 공간의 표면에 존재하며(Sadahiro 등, 2015) 공여체에서 수용체 분자로 α-1,4 연결된 glucosyl 단위 물질의 전달을 촉매하여 α-1,6 결합을 형성하고 연속적인 glucosyl 전달로 인해 maltodextrin에서 고분자 dextran이 형성되는 것으로 알려져 있다(Naessens 등 2005). 이에 대해 많은 연구자들이 dextran의 구조를 특성화하고 DDase 작용에 대한 메커니즘 연구를 수행하였다(Mountzouris 등, 1999; Suzuki 등, 1999; Wang 등, 2011; Wichienchot 등, 2009).
이와 같이 생산된 dextran 및 유도체는 제약 ․ 화학 업종에서 널리 사용되고 있으며(Mao 등, 2012; Tsuchiya 등, 1952) 우수한 생체적합성, 보습 특성 등으로 화장품 성분(Vettori 등, 2012) 및 식품 산업에서는 베이커리(Korca와 Vargga, 2021)나 임상 영양, 과당 시럽 및 사탕과 아이스크림 같은 제품의 첨가제로도 사용되고(Food, 2000) 지소화성을 지닌 식이섬유로서의 활용(Yamamoto 등, 1993) 등 많은 잠재적인 용도가 있는 것으로 알려져 있다. 효소 및 dextran을 생산하는 산업적 발효 공정 외에도 효소 제제가 각각 sucrose나 maltodextrin을 dextran으로 전환시키는 생물공학 기술 또한 개발되고 있다(Naessens 등, 2005). 이에 따라 쌀에 포함된 다량의 전분을 dextran으로 생물전환하여 지소화성을 높이는 시도가 가능하다.
따라서 본 연구에서는 dextrin 유래 dextran 합성 당전이 효소활성이 있는 초산균 발효를 통해 쌀 전분 가수분해물을 이용하여 미생물 다당류인 dextran으로 전환하기 위한 연구를 수행하였으며, pH를 일정하게 유지하고 기질의 추가적 feeding을 실시한 특정 조건에서 발효조 배양 중 균주의 생장특성과 생성물의 물리적, 구조적, 소화특성을 확인함으로써 생물전환을 통해 농산물 유래 유용물질을 합성하기 위한 기초정보를 제공하고자 하였다.
2. 재료 및 방법
본 실험에서 배지 제조를 위해 사용한 bacto peptone, yeast extract는 Difco Laboratories(Detroit, MI, USA)사의 것을 사용하였고 maltodextrin은 DE값 14-20의 Serimfood(Seoul, Korea)의 것을 사용하였다. 쌀 가수분해에 사용된 Termamyl® 120 L와 Promozyme D2는 Novozyme(Bagsvaerd, Denmark)의 것을 사용하였고 표준물질 dextran(Mw=40,000)은 TCI(Tokyo, Japan)에서 구입하여 사용하였다. HPLC 용매로 사용한 water는 Thermo Fisher Scientific(Waltham, MA, USA)의 HPLC-grade 시약을 활용하였고 이 외의 시약들은 Sigma-Aldrich(St. Louis, MO, USA)의 제품을 사용하였다.
본 연구에 사용된 가루쌀(품종명: 바로미2)는 그린농산에서 구입하여 사용하였다. 쌀가루를 30%의 농도로 증류수에 분산시킨 후 stirring하며 용액 온도를 100°C까지 가열하여 70-80°C에서 쌀가루의 호화를 확인하였으며 Termamyl® 120 L를 쌀 무게 대비 0.5%로 처리하고 80-85°C의 온도에서 1시간 동안 액화시켰다. 1시간 반응 이후 용액의 온도를 60°C로 냉각시킨 후 Promozyme® D2를 같은 농도로 처리하여 4시간 동안 반응시켰다. 반응 후 최종 용액은 95°C, 5분의 조건으로 효소를 불활성화시키고 원심분리(7,119 ×g, 15분)하여 상층액을 분리하였다. 추후 발효조 배지에 적용시킬 때 기존 배지 및 쌀 가수분해 상등액의 °Brix를 측정하여 동일한 값이 적용되도록 희석하여 사용하였다.
본 연구에 사용된 초산균주 G. oxydans KACC 19357는 국립농업과학원 미생물은행(KACC, Wanju, Korea)으로부터 분양받아 사용하였으며, 플라스크 배양 배지는 기초 Acetic acid bacterium(AAB) 배지(peptone 5 g/L, yeast extract 5 g/L, glucose 5 g/L, MgSO4 · 7H2O 1 g/L, 증류수 1 L, pH 6.6-7.0)를 사용하였다. 균주는 −70°C의 deep freezer에 세포 배양액 1 mL에 100% glycerol 0.5 mL를 혼합하여 보관하였고, 사용 시에는 AAB 고체 배지에 용해된 균주를 도말한 후 30°C, 72시간의 조건으로 배양한 후 나타난 single colony를 AAB 액체 배지에 전배양하여 활용하였다. 균주의 전배양은 AAB 액체 배지 및 shaking incubator에서 30°C, 200 rpm 및 24시간의 조건으로 배양하였으며 이후 60 mL의 AAB 배지가 담긴 플라스크에 1%(v/v) 접종하여 배양하였다.
본 실험에서 사용한 JAR fermenter는 5 L 발효조 (Kobiotech, Incheon, Korea)를 이용하여 배양하였다. Maltodextrin을 기질로써 활용한 발효조 배양을 위한 배지 조성의 경우 yeast extract 5 g, KH2PO4 0.5 g, K2HPO4 0.5 g, glucose 5 g, MgSO4 · 7H2O 1 g, maltodextrin (MD; Maltodextrin, Serimfood) 50 g, 2% glycerol (v/v), 증류수 1 L를 혼합하여 pH 6.0-6.5로 제조하여 사용하였다. 쌀 가수분해물을 기질로 활용한 경우 앞선 배지의 °Brix 값을 측정한 후 쌀 가수분해물을 동일한 °Brix 값으로 희석하여 maltodextrin 대신 넣어 제조하였으며 발효조의 자세한 가동조건은 Table 1에 나타내었다. 배양은 60 mL의 AAB 배지가 담긴 플라스크에서 균을 전배양(30°C, 200 rpm, 20시간)한 후 발효조 배지 1.2 L에 5%(v/v)의 농도로 접종하여 본배양을 진행하였다. 발효조 배양은 총 72시간 동안 수행되었고 초산균의 생육곡선을 확인하기 위해 0, 6, 12, 24, 48, 72시간에 해당하는 배양액을 회수하여 600 nm에서 흡광도를 측정하였다. pH의 조정은 최종농도가 10%(v/v) NaOH 및 50%(v/v) glycerol이 되도록 제조하여 이용하였으며 소포제는 anitifoam(Antifoam 204, Sigma-Aldrich)을 최종농도가 0.05%(v/v)가 되도록 제조하여 배양에 사용하였다. JAR fermenter로 공급되는 기체는 air pump를 통해 공급되었으며, air pump를 통해 공급된 공기는 air filter를 통과시켜 0.5 vvm으로 일정하게 유지하였다. 또한 dextran 생산성을 높이기 위하여 기질(Maltodextrin 60 g, MgSO4 · 7H2O 2 g, distilled water 100 mL) 용액을 제조하여 12, 24시간에 추가적으로 50 mL씩 feeding line을 통해 공급해주었으며 배지 제조와 마찬가지로 추가 기질 용액의 Brix를 측정하여 쌀 가수분해물을 동량 공급하였다.
| Samples | Composition | Culture condition | ||||
|---|---|---|---|---|---|---|
| Substrate concentration | Volume (L) | Agitation (rpm) | pH | Time (h) | Aeration (vvm) | |
| MD-F21) | 120 g | 1.2 | 600 | 4.5 | 72 | 0.5 |
| RH-F22) | °Brix 10 | |||||
배지의 종류(Maltodextrin, 쌀 가수분해물)에 따른 초산균 유래 다당류 생성 차이를 검증하기 위하여 회수된 배양액의 유변학적 특성을 분석하였다. 배양액을 원심분리(7,119 ×g, 10분)하여 배양 상등액을 Rheometer(Discovery HR-1, TA instrument, New Castle, DE, USA)를 사용하여 측정하였고, geometry는 40 mm peltier plate를 사용하였으며 온도는 25°C, shear rate는 0.1-300의 범위 내에서 총 30번 측정하였다.
배지의 종류(Maltodextrin, 쌀 가수분해물)에 따라 생성된 다당류의 분자량 분포 분석을 위하여 gel permeation chromatography(GPC)를 수행하였다. 배양 회수액에 cold 에탄올을 90%(v/v) 처리하여 침전, 회수된 물질을 동결 건조하여 시료(10 mg/mL)를 증류수에 녹여준 뒤 0.22 μm syringe filter(13 mm, 0.22 μm, NYLON, Thermo Fisher Scientific Co.)로 여과하여 분석시료로 사용하였다. HPLC(Agilent Technologies 1260 Infinity, Waldbronn, Germany)에 TSK gel G3000PW column(7.8 mm×30 cm, Tosoh, Tokyo, Japan)을 장착하였고, column 온도는 40°C, 시료 주입량은 10 μL, 용매는 distilled water를 사용하여 0.5 mL/min의 유속으로 분석하였다. 표준물질은 Sigma-Aldrich사의 glucose, maltose와 pullulan standard set를 사용하여 용출된 시간에 따른 분자량 크기를 확인하였다.
배지의 종류(Maltodextrin, 쌀 가수분해물)에 따라 생성된 고분자 다당류의 분자 간 α-1,4 및 α-1,6 결합의 함량을 분석하기 위하여, 1H-NMR spectroscopy(500MHz FT-NMR, JEOL, Tokyo, Japan)를 수행하였다. 배양액의 에탄올 침전물을 동결 건조한 시료(20 mg/mL)를 산화중수소(D2O)에 녹인 후 40°C에서 10분간 반응시킨 후, 1H-NMR 분석을 수행하였다.
배양액의 소화율 특성을 확인하기 위해 mammalian α-glucosidase인 RIAP(rat intestinal acetone powder)에 함유된 소화효소를 이용하여 분해된 glucose 함량을 Um 등(2023)의 방법을 일부 변형하여 측정하였다. 배양액으로부터 에탄올 침전, 회수된 고분자 물질을 동결 건조한 시료를 6.7 mM NaCl과 0.2% sodium azide가 함유된 100 mM phosphate buffer(pH 6.0)에 0.1%(w/v)의 농도로 녹인 후 RIAP와(10 mg/mL, w/v) 37°C에서 반응시켰으며 반응 중 미생물의 성장을 막기 위하여 ampicillin(0.0005%, w/v)을 처리하였다. 기질 및 효소 혼합물은 0, 1, 2, 3, 6, 12, 24시간에 수집하였으며 95°C, 5분의 조건에서 효소의 활성을 중지시키고 원심분리(7,119 ×g, 5분)하였다. 이후 효소 처리로부터 분해된 glucose의 양은 D-Glucose Assay Kit(Megazyme Co., Bray, Wicklow, Ireland)를 활용하여 분석하였고 maltodextrin, dextran을 control로 적용하여 비교 · 분석하였다.
3. 결과 및 고찰
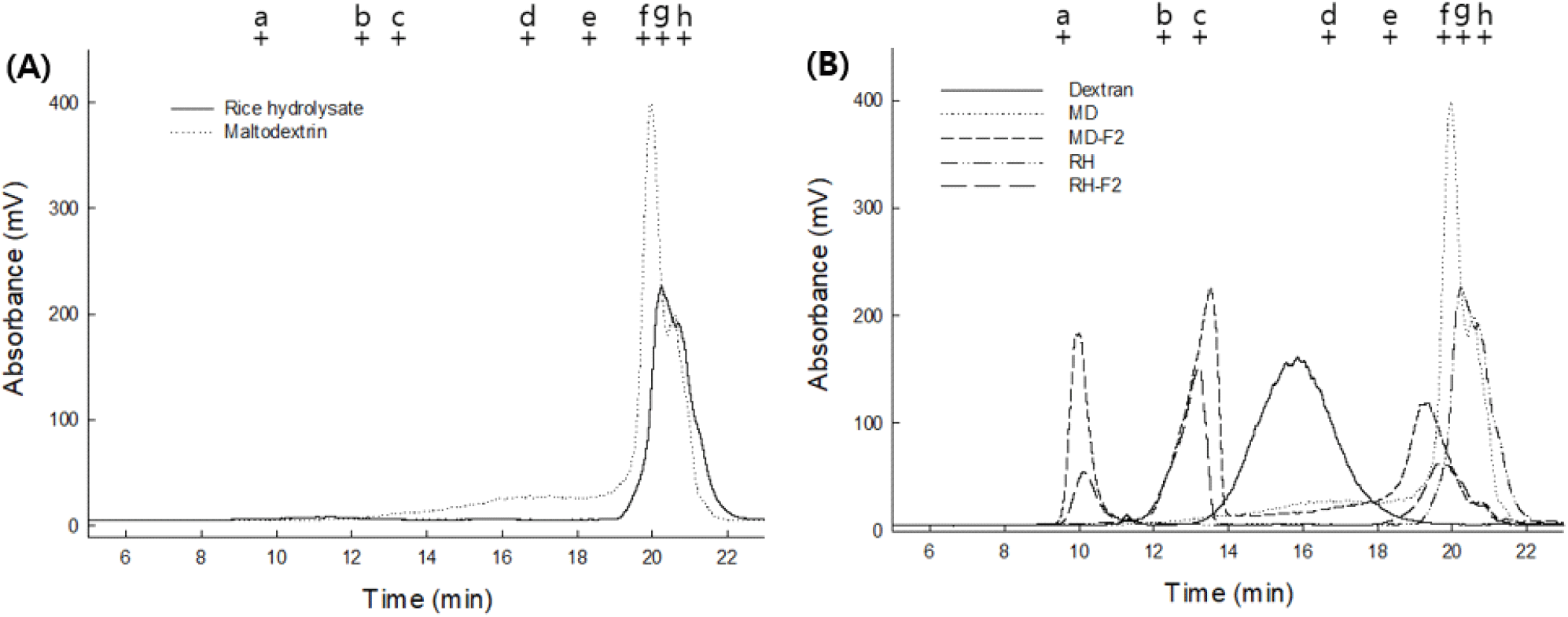
G. oxydans 균주 내 dextran dextrinase 효소의 기질로 사용되는 dextrin을 쌀 유래물로 대체하여 초산발효에 의한 쌀 유래의 dextran을 제조하기 위하여 쌀 가수분해물을 제조하였으며 이의 구성당을 시판 maltodextrin(MD)과 비교하기 위하여 gel permeation chromatography (GPC) 분석하여 Fig. 1(A)에 나타내었다. Maltodextrin은 전분의 가수분해 생성물로서, 주로 glucose, maltose와 같은 당류의 혼합물과 maltotriose 및 maltotetraose의 혼합물과 같은 올리고당 및 다당류로 구성되므로 분자량이 넓게 분포되어 있다. 일반적으로 최대 20 범위의 DE 값으로 분류되며 DE가 높을수록 가수분해 전환율이 높고 평균 분자수가 낮다는 것을 의미한다(Chronakis, 1998; Takeiti 등, 2010). GPC 분석 결과 MD는 약 20분과 21분에 2개의 peak가 용출되었으며 이는 MD의 분자량 분포가 bimodal 형태를 나타낸다는 기존 연구와 일치하였으며(Sun 등, 2010) 표준물질에 의해 각 peak의 분자량을 유추한 결과 최고분자량(Mp)이 1,000 Da으로 중합도 5-7 정도를 가지는 것으로 나타났다. 또한, 50-100 kDa에 달하는 물질도 함께 포함되어 상대적으로 큰 물질 또한 포함되어 있는 것을 확인하였다. 쌀 가수분해물의 구성 분자량 분포는 전분의 α-1,4 결합을 분해하는 α-amylase 및 α-1,6 결합을 분해하는 pullulanase에 의해 절단되어 maltooligosaccharide (MOS)를 형성하여 중합도 5-7 정도를 형성하였고 MD와 유사한 시간대에 주요 peak가 용출되었다. 다만 MD에 비하여 peak가 오른쪽에 형성되어 저분자 물질의 함량이 더 많은 것을 확인하였다. 또한, 쌀 가수분해물의 분자량 분포에서 고분자 물질에 해당하는 peak가 용출되지 않은 것으로 보아 가수분해가 문제없이 이루어진 것을 확인할 수 있었고 MD의 분자량 분포와 비교하였을 때 큰 차이를 보이지 않았기에 이를 토대로 발효조 배양을 진행하였다.
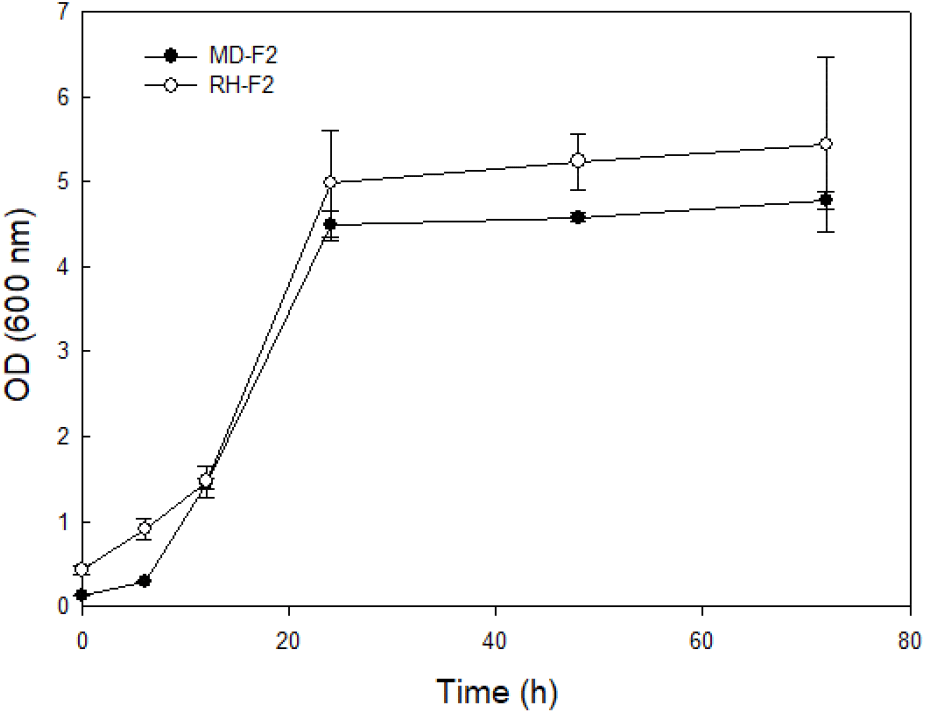
당전이 효소활성이 있는 G. oxydans 균주를(Jeong 등, 2021) pH 및 aeration이 일정하게 조정된 lab scale 발효기를 통해 MD 및 쌀 가수분해물이 포함된 배지에서의 G. oxydans 균주의 생육 정도를 측정하여 Fig. 2에 나타내었다. 각 사용 배지의 종류(MD, 쌀 가수분해물)에 따른 G. oxydans의 발효조 배양 생육도를 비교한 결과 배양 시작 시점(0h)에 MD를 이용한 군에서 OD600값이 0.125, 쌀 가수분해물 실험군에서는 0.427로 차이가 발생하였다. 이는 쌀을 가수분해한 경우 발생하는 기본적인 탁도의 영향으로 판단된다. 배양 중 균주가 대수기에 들어서는 12시간 및 정지기에 해당하는 24시간 시점에 dextran의 생산성을 높이기 위하여 기질을 추가로 주입하였으며, 이후 두 실험군의 OD600값은 24시간까지 급격히 증가하였고 MD가 포함된 배지와 쌀 가수분해물이 포함된 배지에서의 값이 각각 4.49, 4.98을 나타내었다. 이는 G. oxydans 균주 배양 시 24시간 이내에 급격한 증가 경향을 보인다는 기존 연구 결과(Naessens 등, 2005)와 일치하며 배양 초기와 비슷한 OD600값차이를 보였다. 최종적으로 MD가 활용된 실험군과 쌀 가수분해물이 활용된 실험군은 각각 4.78과 5.44의 OD600값을 보였다. Wei 등(2009)의 연구에 따르면 3.7 L 발효조 및 pH 5.5에서 배양한 경우 배양 20시간에 OD600값 10의 생육도라고 보고되어 있으며 이는 본 실험과 차이가 있으나 균주의 배양조건의 차이 때문이라고 사료된다. 이에 따라 본 실험의 초산균 배양 중 쌀 가수분해물을 추가하여도 생육에 저해가 일어나지 않는 것을 확인하였으며, 더 높은 생육도(OD600 value) 조건을 확립하기 위해서는 추가 연구가 필요할 것으로 판단되었다. 한편 초산균은 배양 중 산을 생성하므로 base line을 통해 pH를 조절하지 않는 경우 배지내 pH가 2.5 수준까지 감소하는 것을 확인하였으며(data not shown), pH는 초산균의 생육 및 DDase 작용에 영향을 미친다는 것을 알 수 있었다(Silberbach 등, 2003). 또한, G. oxydans의 생육도가 우수하면서 우리가 목적하는 당전이효소 활성이 우수한 조건을 도출하기 위하여 다양한 pH 조건에서 배양한 결과 pH 4.5에서 dextran 생성이 활발하였기에 본 배양조건을 참고하여 생육도가 효과적으로 증가한 것으로 판단된다(Jeong, 2022).
각 배지에 첨가될 기질을 구성하는 MOS의 분자량 분포 유사성을 확인한 이후 이들을 활용하여 초산균 배양에 활용하였으며 72시간 동안 발효조 운전 후 회수된 배양액의 분자량 분포를 Fig. 1(B)에 나타내었다. 사용된 초기 배양액의 GPC chromatogram에서 약 20분과 21분에 모든 peak가 나타난 반면, 배양 후 MD-F2와 RH-F2의 최종 배양시간인 72시간 차 chromatogram에서는 3개의 main peak가 관찰되었다. 초기 기질 대비 peak가 고분자를 의미하는 초기 시간대에 용출되어 고분자 다당류가 생성됨을 확인하였으며 MD-F2와 RH-F2 모두 같은 위치에 peak가 용출되어 배양 후 분자량 분포에서도 비슷한 양상을 보였다. 이는 배양 균주인 G. oxydans가 MOS를 dextran으로 전환하는 당전이 효소(DDase) 활성이 있음을 입증한 것으로(Hegre, 1951) MOS가 당전이 기질로 작용 및 소비되어 peak가 감소한 것으로 사료되며, glucose 위치의 peak 또한 감소한 것으로 보아 이는 초산균의 생육을 위한 탄소원으로도 활용된 것으로 판단되었다. 생성된 가장 큰 고분자 물질 peak의 분자량은 430 kDa 및 중분자 물질은 50 kDa으로 G. oxydans로부터 합성된 dextran의 분자량이 96.8 kDa인 기존 보고(Wang 등, 2011)와는 다른 양상을 보였다. 그러나 합성된 다당류의 peak가 늘어남에 따라 기질 peak의 감소양상이 확인되었으며 이러한 결과는 배양 중 기질로 사용된 MOS의 peak는 감소하고 고분자에 해당하는 peak가 합성되는 기존 연구결과와 일치하며(Lang 등, 2022; Wang 등, 2011) DDase의 활성에 의한 당전이 반응이 원활하게 이루어진 것을 확인할 수 있었다. 또한 배양 중 주로 감소된 peak의 위치는 1.3 KDa-0.342 KDa 부분인 것으로 보아 G. oxydans 균주에 의해 주로 기질로 소비되는 당류는 maltose 및 DP(degree of polymerization) 8 이하의 MOS로 판단되며, Lang 등(2022)의 연구에 따르면 G6가 주요 기질로 사용된다는 보고와 일치하는 경향을 보였다. 초산균 유래의 dextran을 효과적으로 생성하기 위해서는 주로 사용되는 기질의 DP 및 전환 생성된 다당류의 구성비율 등을 상세히 탐구하는 등 추가적인 연구가 필요할 것으로 사료된다.
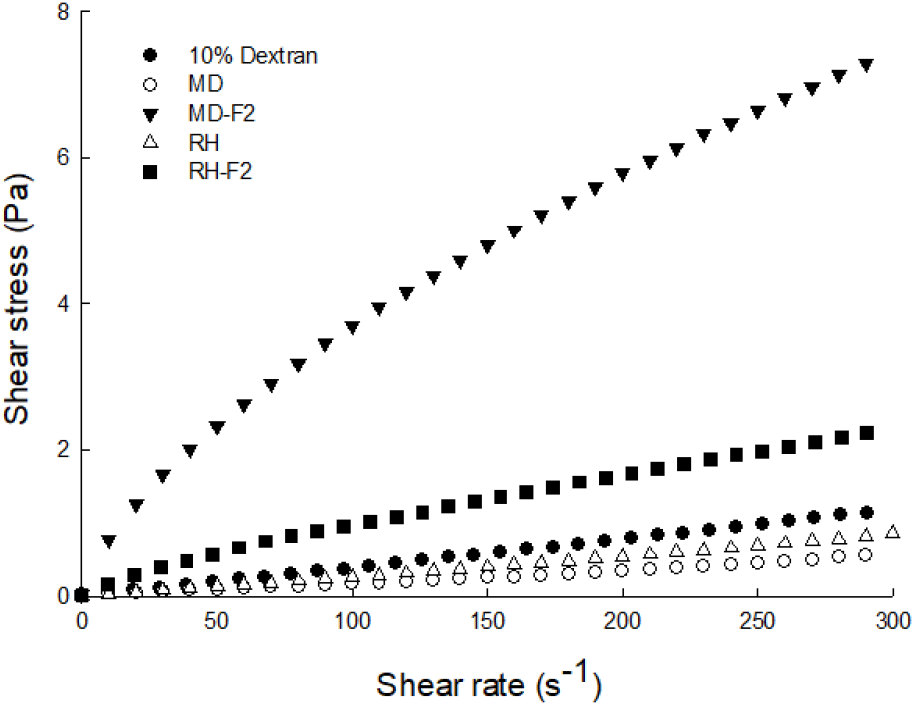
MD 및 쌀 가수분해물을 기질로 활용하여 배양한 당전이 활성 균주의 유변학적 특성 결과는 Fig. 3과 Table 2에 나타내었으며 배양 전, 후 점도의 차이를 확인하기 위하여 초기 배양액(0시간) 및 최종 배양액(72시간)의 점도를 비교하여 나타내었다. 배양 전 배지의 겉보기 점도는 MD와 쌀 가수분해물이 0.57, 0.85 mPa · s로 낮은 수치를 보였으며 또한 고분자 물질의 부재로 인해 shear rate와 shear stress가 비례하여 증가하는 newtonian 성질의 유체로 나타났다(Kamal과 Mutel, 1985). 반면 MD 및 쌀 가수분해물 기질 첨가 72시간 배양 회수물은 각각 7.44, 2.23 mPa · s으로 배양 전에 비하여 눈에 띄게 증가된 겉보기 점도 수치를 나타내었으며 10% dextran 수용액의 1.13 mPa · s보다 유의적으로 높은 수치를 보여(p<0.05) 고분자 물질 수용액의 특성을 보였다. 이는 G. oxydans 균주 내 DDase 효소의 작용으로 인해 기질인 dextrin을 활용하여 dextran을 생산하며 점도가 높아지는 shear-thinning 특성을 보이는 기존 보고(Naessens 등, 2004; Sims 등, 2001)와 일치하는 결과이다. 또한 매우 낮은 shear rate에서 점도가 일정하고, 중간 shear rate에서는 전단율에 따라 점도의 상승폭이 감소하며, 매우 높은 shear rate에서는 점도가 일정하게 나타나는 non-newtonian 유체 중 pseudoplastic 유체의 특성을 보인다(Boger, 1977). 이는 고분자 물질인 dextran이 낮은 shear rate에서는 무작위로 배치된 물질들로 인하여 높은 저항을 나타내어 shear stress값이 크게 나타나고 shear rate가 점차 증가하면서 고분자 물질들이 일정하게 정렬되면서 shear stress의 상승폭이 감소하는 경향의 그래프를 나타내기 때문이다(Veljkovic 등, 1988). 그러나 MD를 기질로 사용한 배양회수액의 겉보기 점도 7.44 mPa · s에 비하여 쌀 가수분해물 배양 회수액의 점도는 2.23 mPa · s으로 비교적 낮은 겉보기 점도 수치를 보이는데 이는 쌀 가수분해물 제조 시 전분이 α-amylase에 의해 무작위로 가수분해되며 MD 대비 비교적 짧은 사슬의 MOS가 제조되었기 때문에 초산발효된 쌀 가수분해물 기질 배양액의 길이가 MD 기질 배양액에 비해 짧기 때문인 것으로 사료된다.
| Samples | Apparent viscosity (mPa · s) |
|---|---|
| 10% dextran solution | 1.13±0.02c5) |
| MD1) media | 0.57±0.01e |
| MD-F22) | 7.44±0.31a |
| RH3) media | 0.85±0.03d |
| RH-F24) | 2.23±0.01b |
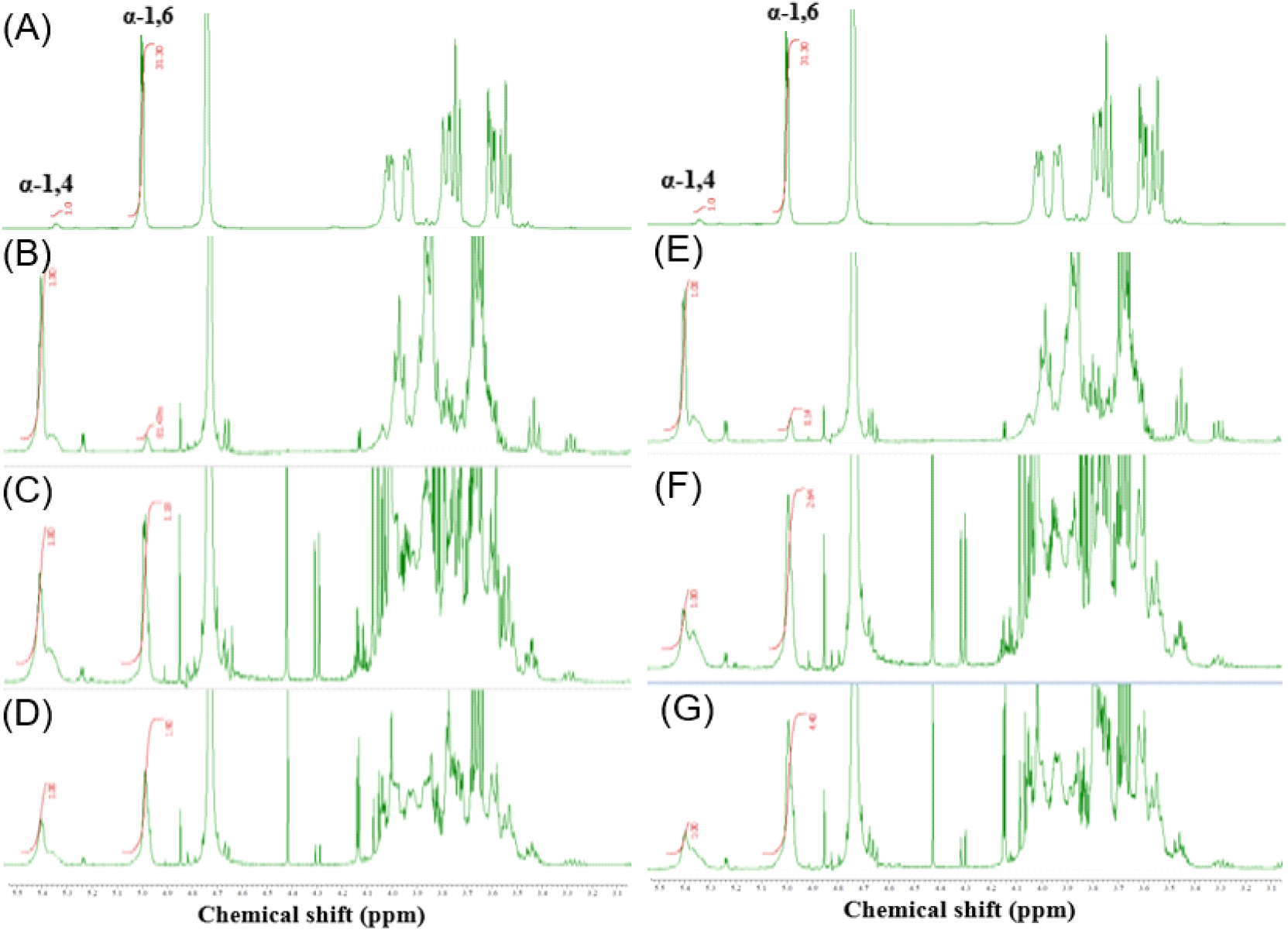
MD 및 쌀 가수분해물을 기질로 첨가하여 G. oxydans KACC 19357로부터 발효를 통해 생산된 고분자 다당류의 분자 간 구조 분석을 위하여 1H-NMR을 실시하였다. 1H-NMR 분석법은 NMR spectra(TOCSY, NOESY, ROESY, HSQC 및 HMBC)의 적용으로 dextran의 구조 분석에 사용되는 기술이다(Purama 등, 2009). 배양시간에 따른 α-1,4 및 α-1,6 결합비율의 변화를 확인하기 위하여 0, 12, 72시간에 해당하는 배양액을 분석하였고 그 결과를 Fig. 4와 Table 3에 나타내었다. MD 및 쌀 가수분해물로 배양한 배양 상등액의 다당류 chemical shift peak 형태는 각각 4.92, 5.3 ppm 위치에서 major peak가 확인되었고, 1H-NMR 스펙트럼에서 5.3 ppm의 chemical shift peak는 α-1,4 결합에 의한 것이며(Masayuki 등, 1999) 4.92 ppm은 α-1,6 결합에 관여하는 glycosidic proton에 기인한 것으로 보고되어있다(Chakraborty 등, 2005; Kim 등, 2010). MD 및 쌀 가수분해물 0시간 배양 회수물은 α-1,4 및 α-1,6 결합비가 각각 1:0.23, 1:0.14의 비율을 보였고 이후 배양 12시간 배양 회수물은 1:1.0 및 1:2.64의 비율로 α-1,6 결합비가 증가하였다. 이후 배양 종료 시점인 72시간 배양 회수물은 1:2.37과 1:4.4로 배양 시작 대비 눈에 띄게 증가한 수치를 보였다. 이는 G. oxydans 균주 유래 DDase의 당전이효소 작용에 의한 것으로 기질을 구성하는 glucose의 결합이 α-1,4 형태에서 α-1,6 형태로 전환되었음을 의미한다. 두 기질의 초산균 배양물은 시간이 지남에 따라서 α-1,6 결합의 비율이 증가하는 동일한 양상을 나타내었으며 이러한 α-1,6 결합비율 증가 패턴의 결과는 α-1,6 결합이 연속적으로 이어진 long chain IMO에서도 전형적으로 나타나는 특성이다(Xue 등, 2022). 최종적으로 MD에 비하여 쌀 가수분해물을 사용한 경우 더 높은 α-1,6 결합비율을 나타내었으며 이는 MD와 같이 쌀 가수분해물 또한 초산균에 의한 당전이 반응의 기질로 충분히 활용되어 glucose 결합구조가 전환된 α-1,6 linked 다당류를 생산할 수 있음을 확인하였다.
| Samples | Glycosidic linkage ratio | |||
|---|---|---|---|---|
| MD culture media | RH culture media | |||
| α-1,4 linkage | α-1,6 linkage | α-1,4 linkage | α-1,6 linkage | |
| 0 h | 1.00 | 0.23 | 1.00 | 0.14 |
| 12 h | 1.00 | 1.00 | 1.00 | 2.64 |
| 72 h | 1.00 | 2.37 | 1.00 | 4.40 |
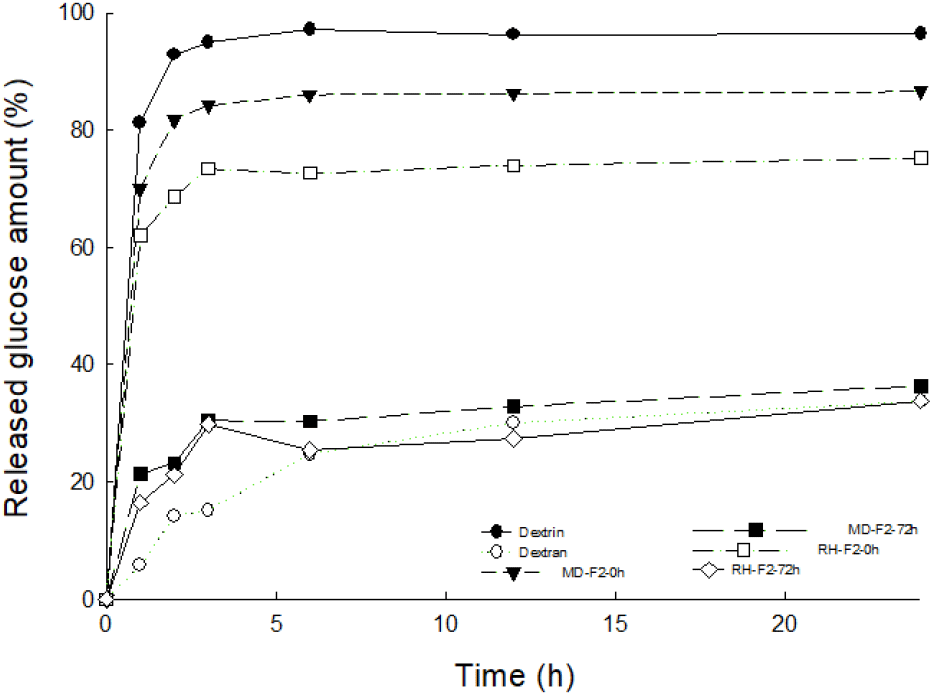
당전이 효소활성이 있는 균주에 의해 사용된 기질(MD, 쌀 가수분해물)별 생성된 다당류의 소화율 평가를 위하여 배양 상등액의 물질을 에탄올 침전, 회수하여 mammalian 유래 α-glucosidase인 RIAP 수준에서 방출되는 glucose의 양을 24시간 동안 측정함으로 소화양상을 조사하였으며 이를 Fig. 5에 나타내었다. α-glucosidase는 소장에서 다당류와 이당류를 단당류로 전화시켜주는 효소이며 생물의 진화수준별로 활성 및 작용패턴이 상이하다고 보고되어 있으므로(Lee 등, 2013; Um 등, 2023) 주로 소화평가에 사용되는 미생물 유래의 소화효소인 AMG가(MacCleary 등, 2013) 아닌 포유류 유래의 소화효소를 적용하여 glucose 방출량을 측정하였다. 위 실험에서 dextrin은 약 2시간 동안 완전히 가수분해되었으며 MD 및 쌀 가수분해물의 초기 배양액(0시간) 시료는 효소처리 1시간만에 glucose가 급속이 생성되어 총 glucose 양의 각각 70, 62%가 방출되었고, 반응 3시간만에 plateau를 현상을 나타내었다. 반면 초산발효에 의해 생성된 MD 및 쌀 가수분해물 첨가 72시간 배양 회수물은 효소반응 1시간 동안 약 20% 수준의 glucose 방출 양상을 나타내었으며 반응시간이 지남에 따라 천천히 glucose가 생성되는 패턴을 띄었고 24시간 반응 후 더이상 분해되지 않는 비슷한 양상을 나타내었다. 즉 72시간 배양 회수물은 소화율이 각각 36, 33%로 양성 대조군인 dextran의 33% 소화율과 유사한 수치의 glucose 생성 패턴을 나타내었으며 각 초기 배양액 시료와 비교하여 유의적으로 낮은 수치가 확인되었다. 이러한 결과는 초산균이 지닌 DDase 당전이 효소의 작용으로 인해 배지 내 첨가한 MD 및 쌀 가수분해물이 dextran과 같은 구조인 고분자 다당류로 전환된 까닭으로 판단되었으며 급속히 분해되는 dextrin에 비해 천천히 소화되는 특성을 나타내었다. MD 및 쌀 가수분해물을 구성하는 glucose는 α-1,4 glucan 형태로 소화효소에 의해 쉽게 분해되어 glucose를 방출하고 이는 혈당을 급격히 상승시키게 되나(Ludwig, 2002) 본 연구를 통해 MD 및 쌀 가수분해물을 구성하는 MOS를 초산발효 처리함으로써 glucose 결합형태를 α-1,6 결합으로 전환해주어 slowly digestable 소재로 전환되었음을 시사하였다. 또한 쌀 가수분해물을 이용하여 초산발효하여 생성된 고분자 다당류가 MD를 기질로 첨가한 실험군과 비교하였을 때에도 유사한 수준의 지소화성을 나타내는 것을 확인하여 쌀 가수분해물 유래의 dextran 소재 전환 가능성을 확인하였다.
4. 요약
식물에서 유래하는 전분과 달리 dextran은 미생물 기원으로 바이오폴리머로 glucose 단위체가 α-1,6 결합 형태로 연결된 다당류이며, 주로 젖산균에 의해 설탕으로부터 생산되는 것으로 알려져 있으나 dextran-dextrinase 활성을 갖는 초산균(G. oxydans)을 통해서도 얻을 수 있다. 쌀로부터 dextrin 기반의 dextran을 얻기 위해 쌀 가수분해물을 이용하여 초산균 발효를 통해 dextran을 생산하고 생성물의 특성을 연구하였다. 발효조를 이용한 dextrin 및 쌀 가수분해물 첨가 배지 배양 시, 초산균 배양 20시간 후 모두 OD600값 5 수준을 유지하였으며, 배양 72시간 후 상등액의 분자량구성을 GPC 분석한 결과 배지 내 기질의 구성과 달리 DP 480 및 400 수준의 고분자 물질이 생성된 것을 확인하였다. 다당류의 glucose 결합패턴을 1H-NMR로 확인한 결과 α-1,4:1,6 결합비율이 각각 1:2.37 및 1:4.4로 증가하여 쌀 가수분해물을 이루는 주요 결합인 α-1,4 결합이 α-1,6 결합 물질로 전환된 것으로 확인되었고, rat 유래 alpha-glucosidase 소화효소 처리결과 glucose가 천천히 방출되는 것으로 나타났다. 이를 통해 쌀 가수분해물은 당전이 활성이 있는 초산균 발효를 통해서 미생물 유래의 dextran으로 전환시켜 수용성 식이섬유 소재와 같이 소화를 지연시키는 고부가 생물소재로 제조할 수 있음을 시사하였다.










