1. 서론
한국 사회는 식생활이 서구화됨에 따라 비만 환자가 증가하는 추세에 있으며, 이는 사회 전체에 심각한 위협으로 인식되고 있다(Williams 등, 2015). 비만은 백색 지방조직의 수와 크기가 증가하여 지방이 축적된 상태를 의미하며, 에너지 섭취와 소비의 불균형, 유전적, 환경적, 행동적인 요인 등 복잡한 상호작용에 영향을 받아 발생한다(Visscher와 Seidell, 2001). 이와 더불어 비만은 제2형 당뇨병, 심혈관 질환을 비롯한 다양한 대사 질환의 원인으로 작용하며, 암과 같은 만성질환의 발병 빈도 증가와도 관련이 있는 것으로 알려져 있다(Buettner 등, 2007).
비만의 주요 원인은 지방세포 생성(adipogenesis)의 활성화로 인해 세포 내 트라이글리세라 이드(triglyceride)가 과도하게 축적되는 것을 의미한다(Chen과 Farese Jr., 2005). 지방 생성은 미분화 지방 전구세포(undifferentiated preadipocytes)가 성숙한 지방세포(mature preadipocytes)로 분화되는 과정에서 발생하며, 이는 CCAAT/enhancer- binding protein(C/EBP) 및 peroxisome proliferator activated receptor-γ(PPAR-γ)와 같은 전사 인자(transcriptional factors)들이 지방산 합성 및 수송을 촉진하여 트라이글리세라이드 축적을 유도하게 된다(White와 Stephens, 2010). 이러한 전사인자의 활성화는 지방산 합성 효소(fatty acid synthase), fatty acid-binding protein 4(FABP4), 지방 트라이글리세라이드 리파아제(adipose triglyceride lipase)와 같은 지질대사 및 지방세포 기능과 관련된 주요 유전자의 발현을 증가시킨다(Rosen과 MacDougald, 2006). 또한, 지방세포는 아디포넥틴(adiponectin)을 비롯한 다양한 아디포카인(adipokine)을 분비하여 인슐린 민감성과 포도당 조절에 영향을 주며, 성숙한 지방세포 내에서 상향 조절된 지방 생성은 지방산 산화 및 포도당 대사의 조절에 기여하여 포도당 흡수 및 인슐린 감수성에 영향을 미친다(Lakota 등, 2012). 따라서, 지방세포 분화를 조절하는 과정은 비만을 포함한 대사성 질환 예방에 효과적인 전략이 될 수 있다.
임상에서 식이 요법과 운동을 포함한 생활 방식의 개선이 많은 비만 환자에게 유익한 것으로 인정되고 있으나, 이러한 능동적인 변화를 위해서는 여러 행동 요인을 달성하고 유지하기 어렵기 때문에 종종 약물 선택이 요구된다(Truong 등, 2019). 현재 다양한 비만 억제제가 사용되고 있지만, 장기간 복용에 따른 심각한 부작용이 보고되고 있다(Kang과 Park, 2012; Li와 Cheung, 2011). 이에 따라 안전성과 생리학적 기능성을 가진 천연소재의 섭취와 비만 및 관련 합병증 발병 감소 간의 관련성을 입증하는 연구들이 진행되고 있다(Kim 등, 2023; Lee 등, 2021; Lee 등, 2022a). 실제로, Garcinia cambogia, Momordica charantia 추출물들은 비만 치료 및 관련 질환을 위한 약물 대체제로 활용되고 있다(Al-Snafi와 Aluraiji, 2023). 또한, 이눌린과 같은 식이섬유는 식욕을 억제하는 데 도움이 되며, 키토산, 플라보노이드와 같은 물질들은 지질 분해와 체내 흡수를 억제하여 지방 대사를 조절하는 데 도움을 주며, 고추의 캡사이신과 녹차의 카테킨 등은 지방의 갈색화를 유도하여 체지방 대사를 조절하는 데에도 효과적으로 작용한다고 알려져 있다(Lee 등, 2008). 2023년 기준으로 식품의약품안전처(MFDS)에서는 체지방 감소를 도와주는 고시형 건강기능식품 기능성 원료로 가르시니아 캄보지아 추출물, 공액 리놀레산, 녹차 추출물, 키토산/키토올리고당이 등록되어 있으며, 이러한 식품 추출물들은 지방세포 분화 억제, 지방 합성 억제, 에너지 대사 촉진 등 다양한 기전을 통해 체지방 감소에 도움을 줄 수 있다고 보고 되었으며, 새로운 개별 인정형 소재 등록도 꾸준히 이루어지고 있다(MFDS, 2023).
감초(Licorice, Glycyrrhiza uralensis)는 한국 및 중국을 포함한 아시아 지역에서 다년생 초본으로, 주로 뿌리 및 줄기 건조물이 한약재로 사용되어 왔으며, 예로부터 해독, 근육 이완, 이뇨 작용, 항염 작용에 대한 효능이 알려져 있다(Karahan 등, 2016; Lee 등, 2019). 또한, 감초는 감미성이 높아 제빵(Park, 2008), 정통주(Kim 등, 2008), 장류 (Park 등, 2012) 등에도 널리 사용되고 있으며, 숙취 해소 음료 및 화장품 원료로도 활용되고 있다(Lee 등, 2022b). 감초의 주요 기능성 성분으로는 licoricidin, glabridin 등의 이소플라보노이드(Gafner 등, 2011), glycyrhizic acid 및 glycyrhizinate와 같은 triterpenoid saponin 계열 성분들이 포함되어 있다(Fenwick 등, 1990). 이러한 생리활성 물질을 포함하고 있는 감초는 항산화 작용(Kim 등, 2018), 항노화 효과(Jang 2019), 세포 보호 효과(Cao 등, 2017) 등이 보고되고 있으며, 황련-감초 복합 추출물의 지방간 억제를 통한 비알코올성 지방간 개선 효과가 보고된 바가 있다(Ahn과 Kim, 2019). 그러나, 감초의 항비만 효과는 세포 수준뿐만 아니라 동물모델에서의 연구가 부족한 실정이다. 따라서 본 연구에서는 감초주정추출물(Glycyrrhiza uralensis ethanol extract, GUE)의 고지방 식이로 유도된 비만 마우스 모델 및 3T3-L1 지방 전구세포 모델에서의 분화 및 지방축적에 미치는 영향을 분석하였고, 이를 통해 감초의 항비만 기능성 식품 소재로의 활용 가능성을 확인하고자 한다.
2. 재료 및 방법
본 연구에서 사용된 GUE는 한국식품연구원 농산물우수관리(GAP) 인증 농식품 추출물 은행으로부터 시료를 제공받아 사용하였다. 감초는 세척 후, 건조하여 분쇄하였다. 감초 분말은 70% 발효주정(100 g/L)을 사용하여 50°C에서 3시간 동안 환류 냉각추출법을 통해 2회 반복 추출하였다. 추출물은 여과, 감압 농축 및 동결건조하였으며, 추출 수율은 30.73%로 확인되었다. 이후 추출물은 −20°C에서 보관하면서 실험에 사용하였다.
LC-MS/MS 분석에 사용된 물과 메탄올은 Merck사(Darmstadt, Germany)에서 구입한 LC-MS 등급을 사용하였다. 마우스 유래 3T3-L1 지방 전구세포는 ATCC (American Type Culture Collection, VA, USA)에서 구입하였다. Bovine calf serum(BCS), fetal bovine serum (FBS), penicillin-streptomycin, phosphate buffered saline(PBS), Dulbecco’s modified Eagle’s medium (DMEM)은 Welgene사(Gyeongsan, Korea)에서 구매하였다. 3-Isobutyl-1-methylxanthine(IBMX), dexamethasone (DEX), insulin, Oil Red O(ORO) 시약은 Sigma-Aldrich Chemical Co.(St. Luis, MO, USA)에서 구입하여 사용하였다. 또한, western blot 분석에 사용된 1차 항체 C/EBPα(#8187), PPARγ(#2443), β-actin(#sc-47778) 및 2차 항체로 rabbit, mouse는 Santa Cruz Biotechnology Inc.(Santa Cruz, CA, USA) 및 Cell Signaling Technology (Beverly, MA, USA)에서 구입하여 사용하였다.
생후 5주령 수컷 C57BL/6J 마우스를 (주)오리엔트바이오(Seong-Nam, Korea)에서 구입하였으며, 12시간 주/야간 주기(light/dark cycle), 온도 24±1°C, 습도 55±2%의 환경을 유지하며 사육하였다. 반입 후, 마우스는 1주일간의 순화 및 환경 적응 후 실험에 사용되었다. 마우스는 일반 사료(10 %kcal fat diet, D12450B, Research Diets, New Brunswick, NJ, USA)를 섭취한 정상군(normal diet, ND), 고지방 식이(60 %kcal fat diet, D12492, Research Diets)를 공급받은 대조군(high-fat diet, HFD) 및 고지방 식이+GUE 식이군으로 나누어 실시하였다. GUE는 정제수에 녹인 후, 고지방 식이로 비만이 유도되는 8주 동안 100 mg/kg of body weight의 농도로 매일 경구투여 하였으며, 정상군(ND) 및 고지방 식이군(HFD)은 동일한 양의 정제수를 경구투여하였다. 체중변화는 8주 동안 매주 1회 일정한 시간에 마우스의 체중을 측정함으로써 확인하였다. 모든 실험 절차는 동물관리규정을 준수하였으며, 본 연구는 한국식품연구원 동물실험 윤리위원회의 승인(IACUC-KFRI-M-22039)하에 수행되었다.
3T3-L1 세포배양을 위해 사용한 배지는 10% BCS와 1% penicillin-streptomycin 용액이 첨가된 DMEM을 사용하였다. 3T3-L1 세포의 분화를 유도하기 위해 6-well plate에 1×105 cells/well로 seeding한 후, 세포가 80% 이상 confluent 상태가 될 때까지 배양을 진행하였다. 이후 48시간 동안 10% FBS와 MDI(0.5 mM IBMX, 1 μM DEX 및 1 μg/mL insulin)가 포함된 DMEM으로 세포를 처리하여 분화를 유도하였다(day 0-2). 2일 후부터는 10% FBS와 1 μg/mL insulin이 포함된 DMEM으로 2일마다 3회 배지를 교체하며, 지방세포 내 지질축적을 유도하였다.
GUE의 세포독성은 MTT assay를 사용하여 평가하였다. 3T3-L1 세포를 96-well plate에 2×104 cells/well의 농도로 배양한 다음, 48시간 후에 기존 배지를 제거한 후, GUE를 농도(0, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 50 mg/mL)별로 처리하여 48시간 동안 배양하였다. 지방분화세포에 대한 세포독성을 평가하기 위해 동일한 수준으로 96-well에 지방세포 분화를 유도하고 동일한 농도별로 GUE를 처리하였다. 지방세포 분화유도 및 시료 처리가 완료된 후, 배지를 제거하고 MTT 용액을 0.5 mg/mL 농도로 첨가하여 2시간 동안 추가 배양하였다. 이후 형성된 formazan을 dimethyl sulfoxide(DMSO)로 용해한 후, 570 nm에서 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 세포독성을 평가하였다.
3T3-L1 지방세포에서 GUE의 지질축적 억제 효과를 분석하기 위해 ORO 염색법을 사용하였다. 지방 분화가 완료된 세포를 DPBS로 2회 세척한 후 3.7% 포름알데히드 용액으로 30분 이상 고정했다. 고정된 세포는 DPBS로 2회 세척한 후 60% 아이소프로필알코올(IPA)로 10분 동안 세척한 후, 30분 동안 ORO 용액으로 지방구(lipid droplet)를 염색하였다. 염색된 지방구는 현미경을 통해 관찰하고 이미지를 획득했으며, 100% IPA를 사용하여 염색된 염료를 용해한 후 505 nm에서 흡광도(Molecular Devices)를 측정하였다.
3T3-L1 지방세포에서 지방합성 관련 단백질 발현을 분석하기 위해 western blot을 수행하였다. 분화 및 GUE 처리가 완료된 세포로부터 phosphatase inhibitor와 protease inhibitor가 첨가된 RIPA buffer를 이용하여 단백질을 추출하였다. 세포는 얼음에서 20분간 방치한 후 13,000 rpm에서 30분 동안 원심 분리하여 상층액으로부터 단백질을 분리하였다. 단백질 정량은 BCA assay kit(Thermo Fisher Scientific, Sunnyvale, CA, USA)를 이용하여 측정하였다. 단백질 30 μg을 8-12% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)에 전기영동을 통해 분리한 후, 단백질을 PVDF 멤브레인(Roche Diagnostics GmbH, Manheim, Germany)에 tranfer 시키고, everyblot blocking buffer(Bio-Rad, Hercules, CA, USA)를 이용하여 상온에서 30분 동안 blocking시켰다. 1차 antibody는 5% BSA 용액에 1:1,000으로 희석한 후 4°C에서 12시간 이상 반응시켰다. 이후, TBST로 3회 세척한 후 2차 항체와 상온에서 1시간 동안 반응시켰다. 반응이 완료된 멤브레인은 TBST로 3회 세척한 후 enhanced chemiluminoesence(ECL) 용액(Thermo Fisher Scientific)을 사용하여 화학 발광 장비(chemiluminescence)를 이용하여 단백질 발현 정도를 분석하였다.
지방 분화 및 GUE 처리가 완료된 지방세포로부터 지방 억제 능력을 평가하기 위해 RNA를 추출하여 RT-PCR을 통해 유전자 발현량을 확인하였다. 세포에 trizol-agent를 첨가하여 RNA를 분리하였고, 1 μg의 RNA를 이용하여 cDNA를 합성하였다(Toyobo Co., Ltd., Osaka, Japan). RT-PCR 분석은 SYBR Green(Roche Molecular Biochemicals, Mannheim, Germany), primer, cDNA, Rnase free water를 혼합하여 다음과 같은 조건으로 시행하였다(Bio-Rad CFX Connect RealTime PCR Detection System, Bio-Rad Laboratories, Hercules, CA, USA). PCR은 95°C에서 10분 동안 초기 활성화 단계를 진행하고, 이후 95°C에서 15초 동안 열 소실 단계, 60°C에서 1분 동안 프라이머 결합 단계, 65°C에서 5초 동안 확장 단계가 45 사이클 동안 반복되었다. 각 유전자의 발현량은 RPLPO 발현량을 기준으로 상대 정량하였다. 본 실험에 사용된 프라이머 정보는 Table 1과 같다.
추출물에 존재하는 주요 생리활성 물질 분석은 SCIEX ExionLC와 결합한 Q-TOF 질량분석기(X500R, AB SCIEX, Concord, Ontario, Canada)를 사용하여 분석하였다. 컬럼은 Hypersil GOLD™ VANQUISH™ C18 UHPLC column (2.1 mm×150 mm, 1.9 μm; Thermo Scientific)을 사용하였고, electro-spray ionization(ESI) 방식으로 negative ion MS scan mode로 분석하였다. 이동상은 용매 A(0.1% formic acid in water) 및 용매 B(0.1% formic acid in methanol)로 구성되어 9.3분간(0-1분, 5.0% B; 1-3분, 5.0-25.0% B; 3-4.8분, 25.0-35.0% B; 4.8-5.8분, 35.0% B; 5.8-6.8분, 35.0-45.0% B; 6.8-7.8분, 45.0% B; 7.8-8.8분, 45.0-60.0% B; 8.8-9.3분, 100.0% B) 0.45 mL/min 유속으로 분석하였다. MS 분석 조건은 mass range 50-1,100 m/z, collision energy −10 V, ion spray voltage: −4,500 V gas temperature 500°C, declustering potential −90 V, curtain gas 30 psi, nebulizing gas 50 psi, drying gas 60 psi의 조건으로 분석하였다. MS/MS 분석은 가장 높은 m/z값을 가지는 5개의 peak를 조각내는 information dependent acquisition(IDA) 방법을 사용하여, collision energy −30 eV 조건하에 수행하였으며, 데이터 처리는 SCIEX OS 1.6.2를 통해 진행하였다. 시료의 전처리는 GUE에 메탄올을 첨가하여 농도를 8 mg/mL로 조절한 후, 1시간 동안 초음파 처리하였다. 그 후, 동량의 증류수를 추가하여 1시간 동안 초음파 처리하여 0.2 μm PVDF 필터로 여과하여 정제하여 분석에 사용하였다.
3. 결과 및 고찰
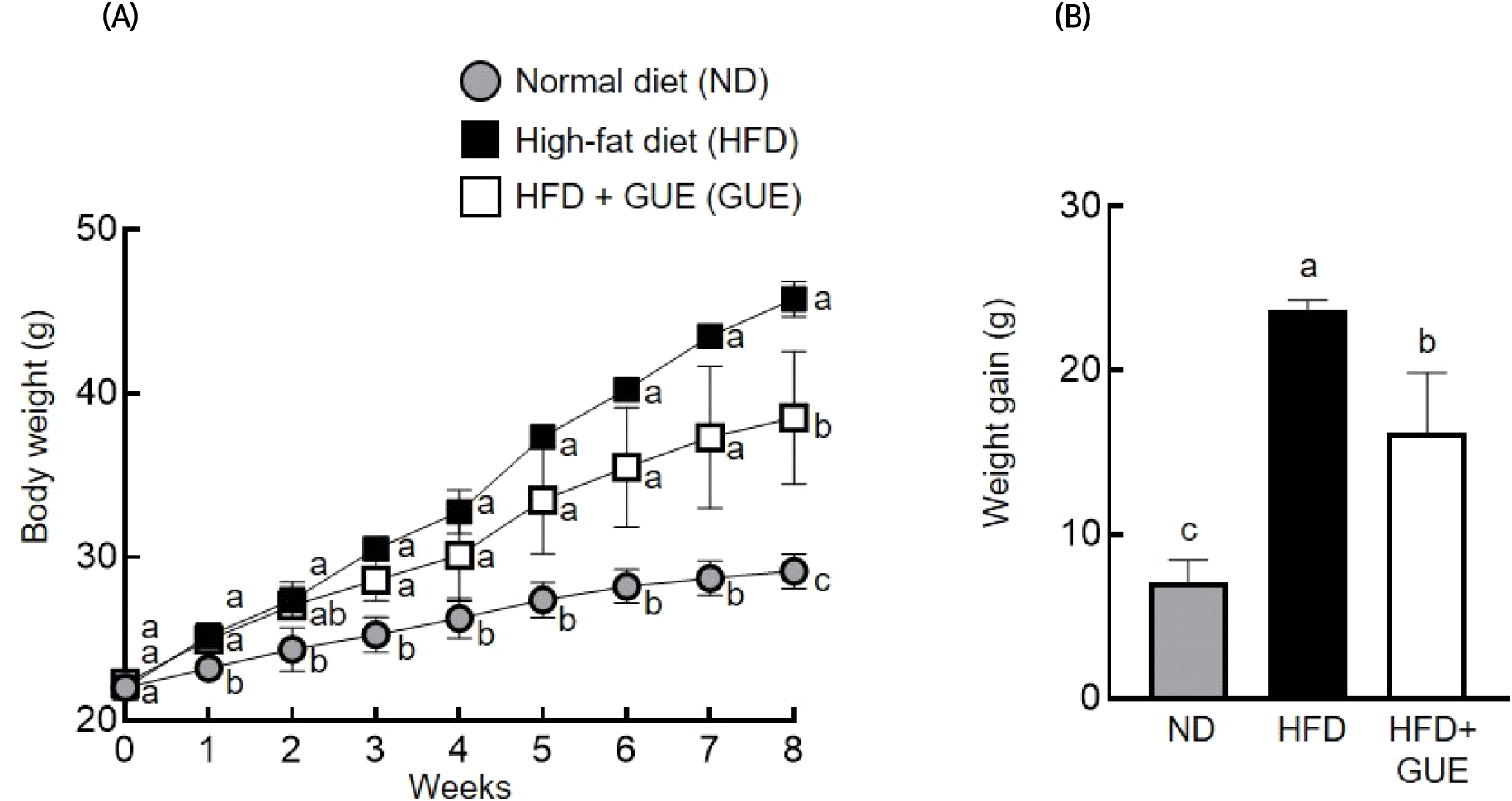
고지방 식이 유도성 비만 모델에서의 GUE 식이에 따른 체중 변화를 측정한 결과는 Fig. 1과 같으며, 8주간의 유도기간에서 모든 그룹에서 유의적인 체중 증가가 관찰되었다(Fig. 1(A)). 8주간의 비만 유도 후, 정상군(ND)은 7.1 g, 고지방 식이군(HFD)에서는 23.8 g의 체중 증가가 확인되었다(Fig. 1(B)). 반면, 고지방 식이+GUE 섭취군에서는 16.2 g의 체중 증가를 나타냈으며, 고지방 식이군(HFD) 대비 유의한 체중 감소가 관찰되었다. 이러한 결과로부터 GUE의 섭취가 고지방 식이 유도성 비만 발생을 효과적으로 억제하는 것을 확인할 수 있었으며, 비만 예방 기능성 식품소재로의 가능성을 확인한 결과로 판단된다.
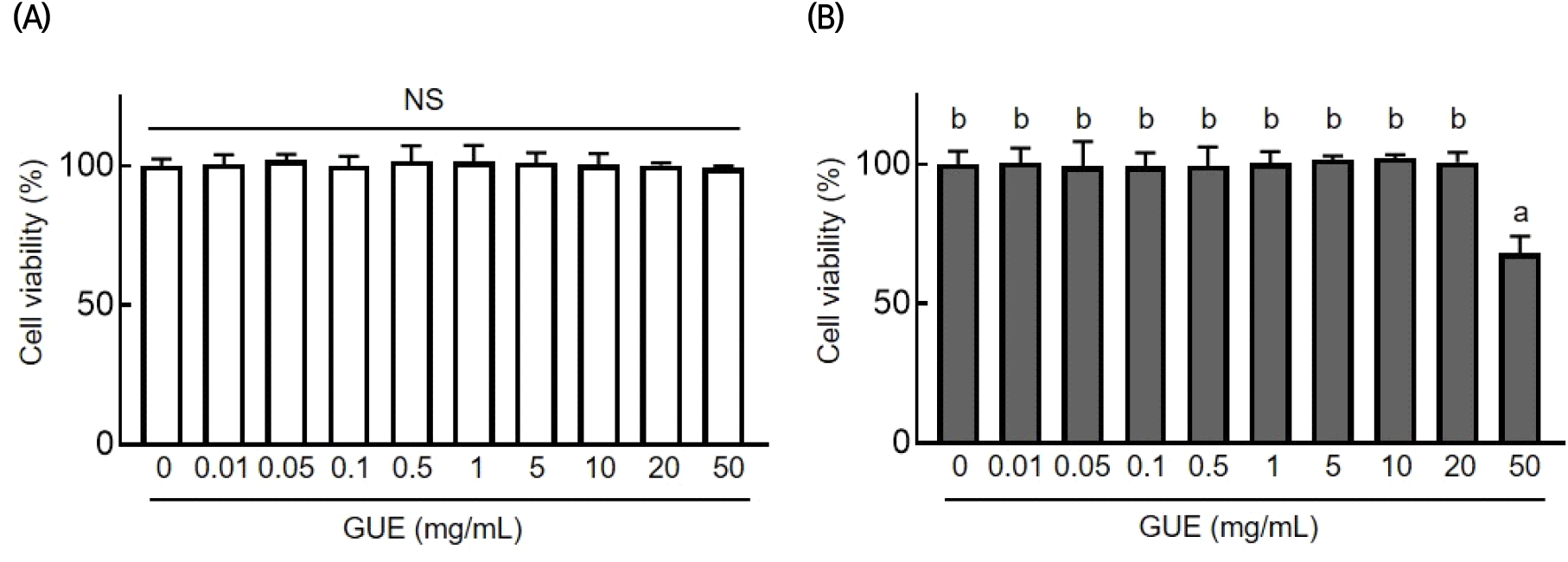
3T3-L1 지방 전구세포에 대한 GUE의 세포독성을 확인하기 위해 MTT assay를 수행하였고, 그 결과는 Fig. 2와 같다. 지방 전구세포에 GUE을 농도별로 처리한 후 세포독성을 평가하였으며, 0, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 50 mg/mL의 처리 농도에서 생존율에 유의한 차이가 관찰되지 않았다(Fig. 2(A)). 이어 분화된 3지방세포에 대한 GUE의 독성을 평가하기 위해 8일의 분화과정 동안 GUE를 농도별로 처리하고 세포독성을 확인하였다. 그 결과, 가장 높은 농도인 50 mg/mL에서 90% 이하의 생존율을 보였으며, 그 이하 농도에서는 세포 생존율에 유의한 차이가 관찰되지 않았다(Fig. 2(B)). 따라서, 3T3-L1 분화유도모델 실험에서 GUE는 20 mg/mL 이하의 농도에서 독성이 나타나지 않음을 확인하였다. 본 결과를 바탕으로 GUE의 지방분화 및 지질축적 억제효능 평가는 안전하다고 판단되는 10 mg/mL 이하의 농도에서 실험을 수행하였다.
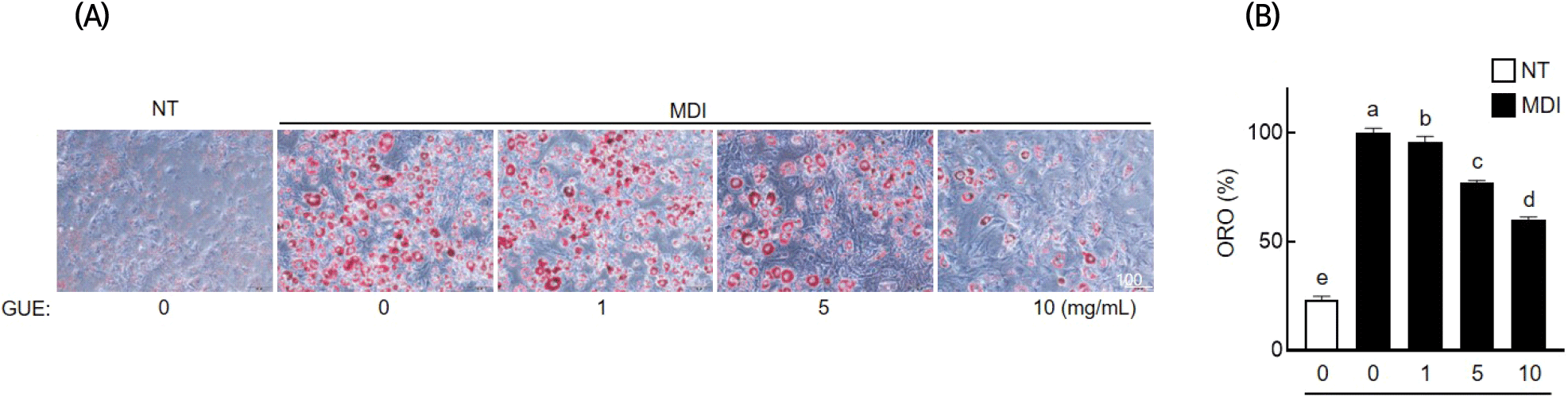
3T3-L1 세포의 지방세포 분화 과정에서 GUE의 세포 내 지질축적 억제효과를 분석한 결과는 Fig. 3과 같다. 미분화그룹과 비교하여 분화유도그룹에서는 지질축적이 현저히 증가하였으며, GUE 처리 농도가 증가함에 따라 지질축적이 감소하는 것으로 나타났다. GUE 처리 농도(1, 5, 10 mg/mL)별로 각각 4.0%, 23.1%, 39.8%의 통계 유의적인 지질축적 억제 효과를 나타냈다(p>0.05).
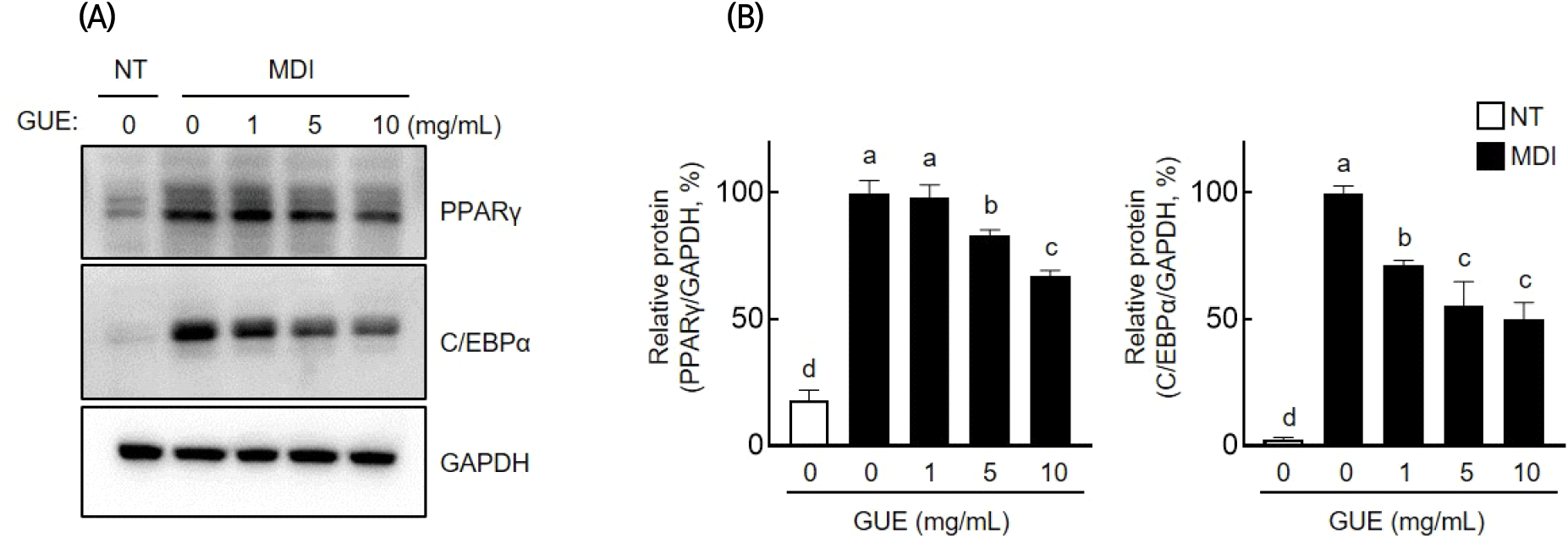
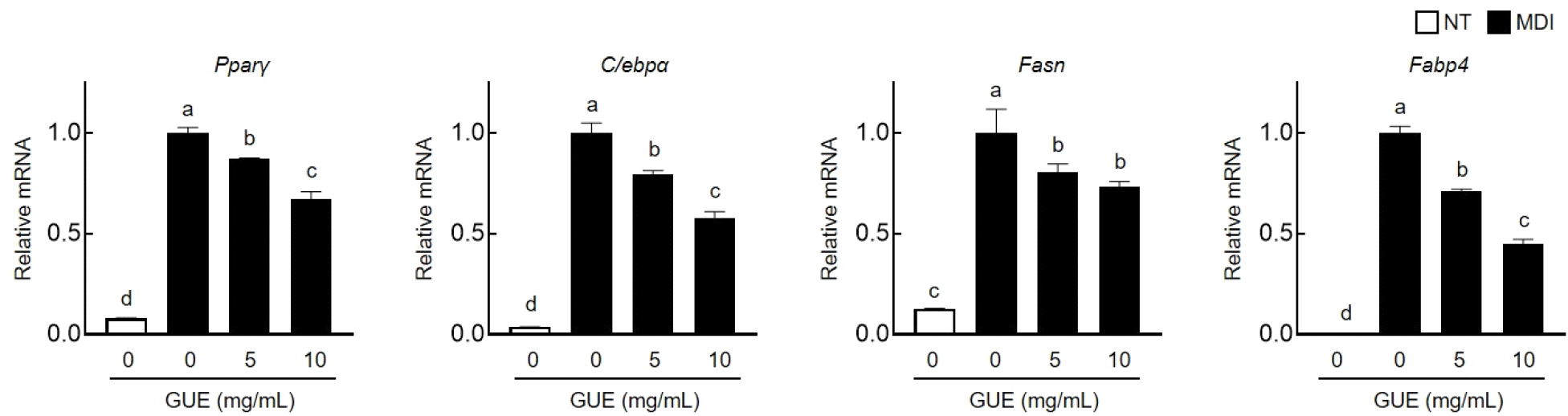
GUE의 지질축적 억제 기전을 확인하기 위하여, 지방합성 전사인자인 PPARγ와 C/EBPα의 발현 변화를 western blot 분석을 통해 확인했으며 그 결과는 Fig. 4와 같다. 분화유도 세포에서 증가한 PPARγ와 C/EBPα는 GUE(1, 5, 10 mg/mL)의 처리에 의해, PPARγ는 각각 1.8%, 16.9%, 33.1%로 감소하였고, C/EBPα는 28.7%, 44.6%, 50.1%로 발현이 감소하였다. mRNA 수준을 확인하기 위해 RT-PCR을 수행한 결과(Fig. 5), Pparγ와 C/ebpα의 발현량이 GUE 처리 농도 의존적으로 감소함이 확인되었다. 지방 합성에 관여하는 중요한 유전자인 Fasn 및 Fabp4의 mRNA 발현 또한 분화 유도에 따라 증가하였으며, 이들의 발현량은 GUE 처리 농도가 증가함에 따라 감소함이 확인되었다. 이러한 결과들을 통하여, GUE는 지방세포의 분화과정에서 증가된 지질합성 및 축적에 관련된 인자 및 유전자들을 효과적으로 억제하는 것으로 확인되었다.
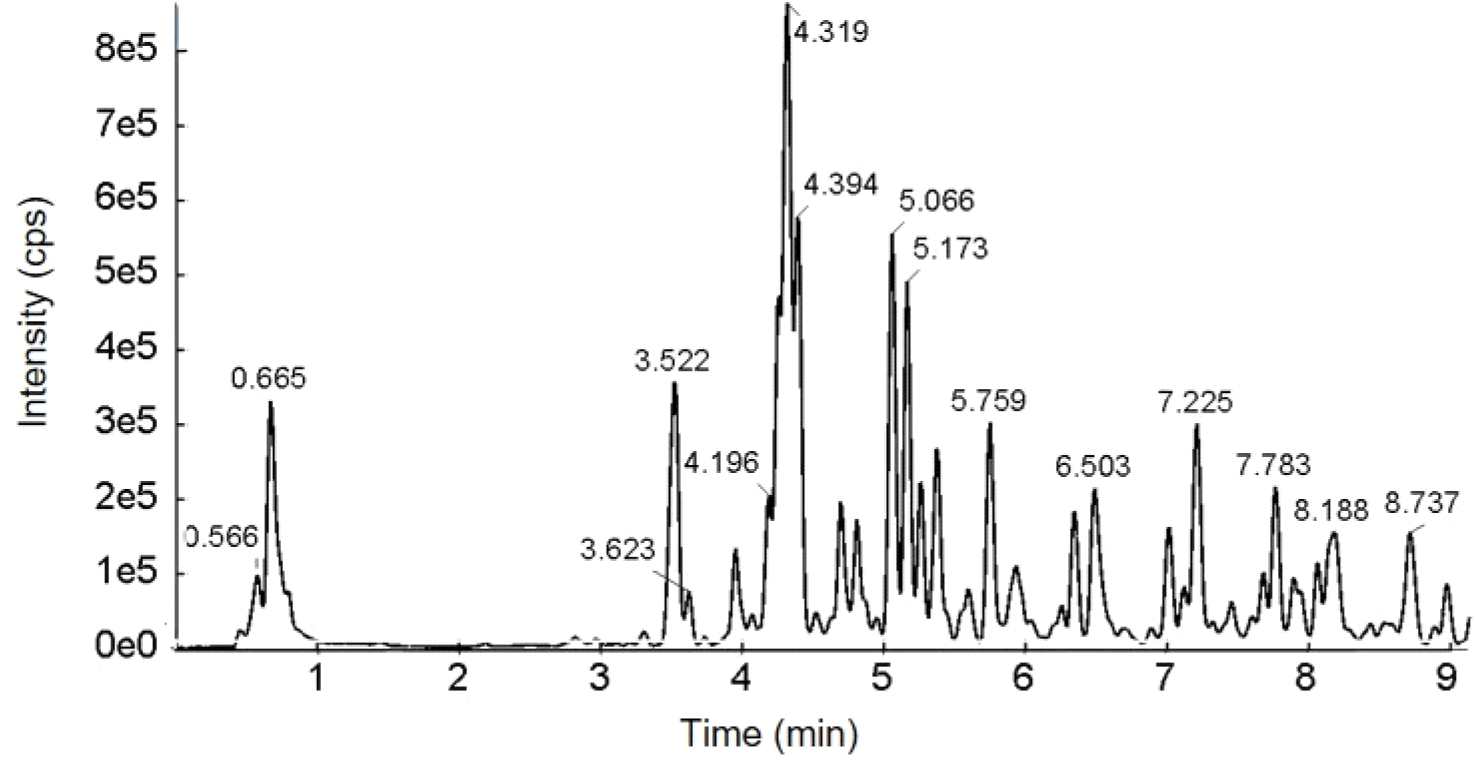
GUE의 LC/Q-TOF-MS 분석 결과를 base peak chromatogram(Fig. 6)으로 나타냈으며, MS/MS 기반의 주요 생리활성 물질을 동정 결과는 Table 2와 같다. GUE의 주요 생리활성물질은 5.757분에 검출된 liquiritigenin (m/z 255)을 기본구조로 하는 flavonoid 계열[(iso)liquiritigenin-4′-apiosyl(1→2) glucoside(m/z 549), liquiritin(m/z 417), isoliquiritoside(m/z 417) 및 neoisoliquiritin(m/z 417)]로 확인되었다. 또한, 4-hydroxyphenylpropionic acid(3.524분, m/z 165)와 isoviolanthin (4.190분, m/z 577) 2가지의 페놀성 화합물이 검출되었으며, glycyrrhizic acid(m/z 351)를 기본구조로 하는 2가지의 licorice saponin(m/z 837)류가 GUE의 주요 phytochemical 성분으로 확인되었다.
| Rt1) | Identified compounds | Formula | Molecular ion [M-H]− (m/z) | MS2 fragment ions (m/z) | References |
|---|---|---|---|---|---|
| 3.524 | 4-Hydroxyphenylpropionic acid | C9H10O3 | 165.0562 | 59, 65, 93, 119, 121, 165 | (Liu et al., 2012) |
| 4.190 | Isoviolanthin | C26H30O14 | 577.1578 | 353, 383, 457, 473, 503, 577 | (Zhang et al., 2018) |
| 4.259 | Isoliquiritigenin-4’-apiosyl (1→2) glucoside or its isomer | C26H30O13 | 549.1624 | 255, 429, 549 | (Zhang et al., 2018) |
| 4.321 | Liquiritigenin-4’-apiosyl (1→2) glucoside or its isomer | C26H30O13 | 549.1623 | 119, 135, 255, 297, 417, 549 | (Zhang et al., 2018) |
| 4.397 | Liquiritin (liquiritigenin-4’-O-glucoside) | C21H22O9 | 417.1203 | 119, 135, 255, 417 | (Zhang et al., 2018) |
| 5.065 | Liquiritigenin-4’-apiosyl (1→2) glucoside or its isomer | C26H30O13 | 549.1622 | 135, 255, 417, 549 | (Zhang et al., 2018) |
| 5.171 | Isoliquiritigenin-4’-apiosyl (1→2) glucoside or its isomer | C26H30O13 | 549.1624 | 135, 255, 429, 549 | (Zhang et al., 2018) |
| 5.268 | Isoliquiritoside | C21H22O9 | 417.1205 | 119, 135, 148, 254, 255, 417 | (Zhang et al., 2018) |
| 5.384 | Neoisoliquiritin | C21H22O9 | 417.1206 | 119, 135, 255 | (Zhang et al., 2018) |
| 5.757 | Liquiritigenin | C15H12O4 | 255.0673 | 91, 119, 135 | (Zhang et al., 2018) |
| 7.223 | Licorice saponin G2 or its isomer | C42H62O17 | 837.3928 | 837 | (Ye et al., 2007; Zhang et al., 2018) |
| 7.781 | Licorice saponin G2 or its isomer | C42H62O17 | 837.3933 | 351, 837 | (Ye et al., 2007; Zhang et al., 2018) |
감초는 국내 자생 155종의 약용식물을 대상으로 한 항비만 소재 개발연구에서 in vitro 수준에서 췌장 lipase를 효과적으로 억제함으로써 항비만 효과를 나타냈다(Kim 등, 2006). 또한, 감초 추출물의 MeCl2 분획물 및 주요 유용성분인 licochalcone A의 복강 내 투여는 6주간 고지방 식이로 유도된 마우스에서 포도당 및 콜레스테롤 수준을 감소시키고 인슐린 저항성을 개선하는 효과를 보였으며, 지방 갈변화와 관련된 지방 갈변화 인자들인 uncoupling protein 1(UCP1)과 PR/SET Domain 16(PRDM16)의 발현을 유도하였다(Lee 등, 2018). 뿐만 아니라, 감초 열수 추출물은 당뇨치료제인 메트포르민과 병용 투여했을 때, 6주간 고지방 식이로 유도된 대사이상 마우스 모델에서 AMPK의 활성화를 유도함으로써 간 및 근육조직에서 포도당 대사를 개선하는 효과가 관찰되었다(Hong 등, 2023).
본 연구 결과로부터 GUE는 3T3-L1 지방 전구세포의 분화와 지방구 형성을 효과적으로 억제하며, 이는 지방 생성 전사인자인 PPARγ와 C/EBPα의 발현을 억제하고 지방합성과 수송 및 저장에 관여하는 Fasn과 Fabp4 등의 유전자 발현을 하향 조절함으로써 이루어진 것으로 판단된다. 한편, 체중조절에 도움을 줄 수 있는 고시형 기능성 원료인 녹차 추출물(120 mg/kg) 식이는 고지방 식이로 유도된 지방간 모델에서 지방합성과 관련된 인자(PPARγ, SREBP1, FASN 등)들의 발현을 조절하여 항비만 효과를 보여주었다 (Bae 등, 2018). 이러한 결과로 보아, GUE의 Pparγ, C/ebpα, Fasn의 조절을 통한 지질축적억제효과는 GUE가 비만 예방에 효과적인 소재로 활용될 가능성을 높여줄 의미있는 결과라 판단된다.
GUE에 함유된 생리활성 화합물을 동정하기 위해 액체크로마토그래피-질량분석기를 사용하였고, negative ion mode의 chromatogram으로부터 12종의 화합물이 확인되었다. 특히, liquiritigenin 배당체들이 주요 화합물로 검출되었으며, liquiritigenin은 3T3-L1 adipocytes에서 C/EBPα, PPARγ와 같은 전사인자의 발현을 하향조절하고, SREBP-1, ACC1, FASN과 같은 지방 생성 지표의 발현을 mTOR 매개 오토파지 활성화를 통해 감소시킨다고 보고되었다(Qin 등, 2022). 또한, isoliquiritigenin은 JNK의 인산화를 억제하고 UCP1과 PRDM16 발현을 촉진하여 백색지방세포를 갈색화시키는 것으로 보고된 바 있다(Moon 등, 2020). 뿐만 아니라, isoliquiritigenin의 섭취는 45 %kcal 고지방 식이로 유도된 비만 쥐에서 AMPK 경로를 활성화해 지방간을 효과적으로 억제하는 것으로 나타났다(Yahya 등, 2022). 또한. 감초의 주요성분인 liquiritin은 신경세포 보호작용과 항산화 효과 등의 생리활성이 보고되었으며(Nakatani 등, 2017; Zhai 등, 2014), 최근 연구에서는 liquiritin의 섭취가 공복혈당 증가와 인슐린 저항을 낮추는 효과가 있는 것으로 나타났다(Li 등, 2022). 또한, liquiritin은 nuclear factor kappa B(NF-κB) 및 mitogen activated protein kinase(MAPK) 신호 경로의 억제를 통해 고과당 유발 심근 섬유증에 대한 보호 효과가 있어 당뇨병이나 비만과 같은 대사성 질환 치료에 효능을 나타냈다(Zhang 등, 2016). 또한, 감초에는 licorice saponin류도 높은 함량으로 존재하며, 고지방 식이로 유발된 비만 쥐 모델에서 licorice saponin의 투여는 인슐린 저항성을 감소시키고 지방조직의 크기와 지질 축적을 감소시킴으로써 항비만 효과를 나타낼 수 있다고 보고되었다(Abo El-Magd 등, 2018). Licorice-saponin G2는 감초에 존재하는 triterpenoid saponin glycoside 중 하나로, glycyrrhizic acid 또는 glycyrrhizin으로 알려진 물질의 일종이며, glycyrrhizic acid는 고지방 식이로 유도된 비만 쥐 모델에서 신장, 심장, 대퇴사두근, 복근, 내장, 피하지방조직에서 lipoprotein lipase 발현을 상향 조절하여 혈청 내 유리지방산, 총콜레스테롤 및 LDL콜레스테롤의 감소 및 조직 내 지질의 침착을 감소시키는 효과를 나타내어 비만 개선에 대한 가능성이 보고되었다(Eu 등, 2010). 이전의 보고들을 종합적으로 고려하면, GUE의 주요성분으로서 liquiritigenine 배당체 및 licorice saponin들이 항비만 효능에 영향을 미쳤을 것으로 추측된다. 그러나, GUE의 항비만 효과를 자세히 규명하기 위해서는 유용성분의 분리를 통해 단일 성분의 분자 수준에서의 작용 기전 연구가 필요하다. 본 연구 결과를 통해 GUE가 비만을 포함한 대사성 질환에 대한 예방 소재로의 활용 가능성을 확인할 수 있었으며, 추후 연구에 있어 과학적 기초자료로서 유용할 것으로 판단된다.
4. 요약
감초의 항비만 소재로서 가능성을 확인하기 위해 고지방 식이로 유도된 마우스 모델과 3T3-L1 지방 전구세포의 지방세포 분화과정에 GUE의 효과를 평가하였다. GUE의 섭취는 고지방 식이로 인해 증가한 마우스 체중을 유의하게 감소시켰다. 또한, GUE 처리로 인해 3T3-L1 지방 전구세포의 지방세포 분화과정에 의해 증가한 지방구 형성이 효과적으로 감소하는 것을 확인하였다. 이런 억제 효과는 GUE가 지방세포 분화과정에서 증가한 PPARγ 및 C/EBPα의 발현을 효과적으로 억제하기 때문이며, 이는 지방 대사 조절 인자들의 발현억제에도 영향을 주었다. 또한, LC-Q-TOF-MS 분석을 통해 GUE 주요 생리활성 물질을 분석한 결과, liquiritigenin 배당체 및 licorice saponins를 포함한 12종의 주요 생리활성 물질들이 동정되었다. 이러한 결과들을 종합하여 볼 때, GUE의 항비만 효과는 우수한 생리활성을 가지는 phytochemical들에 의한 지방 대사 조절 인자들의 발현조절과 관련이 깊다고 판단되며, 감초의 비만을 포함한 대사성질환 예방 소재로서 활용 가치를 높이는 데 유용할 것으로 생각된다.










