1. 서론
커피는 원두(roasted bean)를 제조한 후 물로 추출하여 음료로 이용하는 기호식품이지만, 커피에 함유된 카페인(caffeine, 1,3,7-trimethylpurine-2,6-dione), 클로로젠산(chlorogenic acid, 3-O-caffeoylquinic acid) 등 폴리페놀성분의 기능성이 입증되면서 기능성소재로서 연구가 진행되고 있다(Kim 등, 2022). 또한, 국내에서도 커피 생산이 증가하고 가공공정을 개선하여 로스팅 시 생성되는 유해물질을 저감화하거나 미생물 발효를 통한 기능성을 증가시키는 연구가 보고되었다(Hwang과 Moon, 2022; Ko 등, 2020). 최근에는 Park 등(2023)이 커피 원두추출물을 효모 발효하여 제조한 커피와인의 발효특성 및 항염증 효능평가를 보고한 바 있다.
천연 발효식초는 전분질 및 당을 함유하고 있는 원료에 효모를 이용하여 알코올을 생성시킨 후 초산균 증식을 위해 종초를 첨가하여 초산발효를 유도하는 공정으로, 초산 이외에도 휘발성 및 비휘발성의 각종 유기산류, 아미노산류, 당류, 에스터류 등 각종 영양성분과 기능성물질이 함유되어 있다(Gil 등, 2020). 특히, 알코올 생성과정과 초산으로의 산화과정인 2단계 발효공정을 거치는 동안 원료의 유기산 및 유리당, 아미노산 조성, 에스터류 생성에 의한 향기성분, 관능적인 맛의 변화 등을 동반한다(Sung 등, 2014). 또한, 초산발효 공정을 통해 생성된 물질에 의한 항균효과, 체지방 감소, 고혈압 예방, 당뇨, 피로회복 및 노화 방지와 같은 생리활성이 보고되고 있다(Park 등, 2021). 그러나 커피 원두추출물을 이용하여 이와 같은 2단 발효공정을 통해 초산발효된 커피식초의 기능성에 대한 보고는 거의 없는 실정이다.
Adipogenesis는 지방 전구세포(preadipocytes)에서 지방세포(adipocytes)로 분화하는 과정으로 adipogenesis를 효율적으로 억제 및 지연시키는 것은 비만 예방에서 중요하다(Kim 등, 2020). 지방 전구세포는 dexamethasone, insulin, 3-isobutyl-1-methylxanthine(IBMX) 등의 분화유도인자로 인해 지방세포로 분화되며, 이러한 과정에는 전사인자(transcription factors)인 peroxisome proliferator-activated receptor γ(PPARγ), CCAAT/enhancer-binding protein(C/EBPα)과 조절 매개체(coregulator)인 sterol regulatory element-binding protein 1c (SREBP-1c)가 관여한다(Kim 등, 2016). 따라서 비만 치료 및 예방은 지방 전구세포 분화 억제와 지방생성과정을 조절하는 것이 중요하다(Chen과 Farese, 2005). Triglyceride를 지방산으로 분해하는 효소인 pancreatic lipase는 비만 치료제인 orlistat에 의해 활성이 억제되지만, 이러한 화학적 저해제들은 여러 가지 부작용이 문제되고 있어 부작용 및 독성이 없는 항비만 관련 기능성 소재에 관한 연구들이 진행되고 있다(Gu와 Hong, 2020).
따라서 본 연구에서는 알코올발효가 완료된 커피와인에 Acetobacter pasteurianus CT_02 균주를 이용하여 제조한 종초를 첨가하여 초산발효를 진행하였으며, 초산발효기간에 따른 발효특성 및 지방분해효소 저해활성에 대해 평가하였다. 항비만 효능평가는 초산발효가 완료된 최종 발효 동결건조물을 마우스 유래 지방 전구세포주인 3T3-L1 세포에 처리하여 지방축적 억제효과, 렙틴 단백질 발현량, 지방 생성관련 유전자 발현량 등을 분석하여 항비만 효능에 대한 천연 기능성 소재로 활용 가능성을 평가하였다.
2. 재료 및 방법
커피 원두는 브라질산 생두를 고초균으로 발효시켜 로스팅된 것을 (재)발효미생물산업진흥원(Sunchang, Korea)으로부터 제공받아 사용하였다. 미생물 배양을 위한 배지인 YPDA, YPDB, nutrient broth(NB), nutrient agar(NA)는 Becton, Dickinson & Co.(Franklin Lakes, NJ, USA) 제품을, 균주 배양을 위한 배지 조성인 glucose는 대정화금사(Siheung, Korea), yeast extract는 Angel Yeast사(Yichang, China), agar는 BD사(Becton, Dickinson & Co., Franklin Lakes, NJ, USA), 주정은 에탄올코리아사(95.6%, Seong-nam, Korea)를 사용하였다. 유기산 및 유리당 정량을 위한 표준물질 succinic acid, citric acid, acetic acid 및 glucose는 Sigma-Aldrich사(St. Louis, MO, USA)에서 구입하여 사용하였다. Lipase 저해활성을 위한 3-morpholinopropane-1-sulfonic acid(MOPS), porcine pancreatic lipase, p-nitrophenol butyrate (p-NPB)와 orlistat은 Sigma-Aldrich 제품을 사용하였다. 지방 전구세포 배양을 위한 Dulbecco’s modified Eagle’s medium(DMEM), antibiotics(penicillin/streptomycin), fetal bovine serum(FBS)과 bovine calf serum(BCS) Dulbecco’s phosphate-buffered saline(DPBS)은 Gibco BRL(Grand Island, NY, USA) 제품을, 세포 생존율 평가는 cell counting kit-8(CCK-8, Dojindo Molecular Technologies Inc., Rockville, MD, USA)을 사용하였다. 지질축적률 측정을 위한 dexamethasone, rosiglitazone, IBMX, insulin from bovine pancreas, epigallocatechin gallate(EGCG), formaldehyde solution, Oil-Red-O solution, 2-propanol 등은 Sigma-Aldrich사 제품을 사용하였고, leptin 정량은 ELISA kit(R&D Systems, Inc., Minneapolis, MN, USA)를 이용하였다. Total RNA 추출과 cDNA 합성에는 각각 Qiagen RNeasy mini kit (Qiagen, Hilden, Germany), Go Script™ Reverse Transcription system(Promega, Madison, WI, USA) 제품을 사용하였다. 기타 분석용 시약은 Sigma-Aldrich에서 구입하여 사용하였다.
커피 원두추출물은 커피 원두를 그라인더(The Smart Grinder™ Pro, Breville, Sydney, Australia)로 0.3 mm 이하 크기로 분쇄하였으며, 증류수를 20배수(w/v) 첨가하여 항온수조(TW-PC-1, Universal Scientific Industrial Co., Ltd., Shanghai, China)에서 열수 추출(85°C, 3시간)한 후 여과(ADVANTEC Toyo Roshi Kaisha, Ltd., Tokyo, Japan)하여 회수하였다. 효모 발효를 위해 커피추출액 혼합액(20% glucose, 1% yeast extract, 70% roasted coffee extract)을 제조하였다. 커피와인 제조를 위해 이용된 효모는 Saccharomyces cerevisiae SRCM102539 균주로 (재)발효미생물산업진흥원(MIFI)에서 연구용으로 제공받았으며, YPDA(1% yeast extract, 2% peptone, 2% dextrose, 1.5% agar)에서 활성시킨 후 YPDB(1% yeast extract, 2% peptone, 2% dextrose)에 접종한 후 진탕배양(30°C, 120 rpm, 12시간)하여 전 배양액으로 하였다. 커피추출물 혼합액에 효모 전 배양액을 1%(v/v, 4.50 log CFU/mL) 접종하여 정치배양(30°C, 5일)하였고, 발효 완료 시 수용성 고형분, pH, 총산도 및 에탄올 함량은 각각 7.60 °Brix, 4.56, 0.30% 및 8.41%(w/v)이었으며, 생균수는 6.72 log CFU/mL이었다. 선행연구(Park, 2023)에서 효모발효가 완료되었음에도 효모의 생육이 확인되어 효모를 불활성화시키기 위하여 환류냉각관이 부착된 수기에 일정량 취하여 항온수조에서 열처리(85°C, 30분)하고 냉각한 후 회수하여 커피와인으로 하였다.
선행연구를 통해 제조된 커피와인(Park 등, 2023)으로 식초를 제조하기 위하여 천연 발효식초인 제주도 키위식초로부터 분리된 초산균 Acetobacter pasteurianus CT_02를 사용하였다. 분리 선발된 초산균을 식초 제조에 이용하기 위한 GRAS 균주로서의 확인은 마크로젠사에 의뢰하여 16S rRNA 유전자 서열의 일치도를 분석하였을 때, reference strain인 A. pasteurianus LMG 1591와 97.3% 일치도를 보였다. 초산균은 GY 평판배지(5% glucose, 1% yeast extract, 2.5% agar)에 도말하여 정치배양기(HB-101M, Hanbaek Scientific Co., Ltd., Bucheon, Korea)에서 1차 활성화(30°C, 2일)하였으며, 에탄올이 첨가된 GYE 평판배지(5% glucose, 1% yeast extract, 2.5% agar, 6% ethanol)에 도말하여 2차 활성화(30°C, 2일)하였다. 종초 제조는 커피추출물 및 주정이 함유된 커피추출물배지(70% roasted coffee extract, 5% glucose, 1% yeast extract, 6% ethanol, 18% distilled water)에 2차 활성이 완료된 A. pasteurianus CT_02 균주를 1 colony 접종한 후 진탕배양(30°C, 120 rpm)하여 생균수 및 총산도 변화를 분석하였으며, 배양 8일 차에 각각 7.68 log CFU/mL 및 4.41%로 배양을 종료하였다. 커피와인을 이용한 초산균의 발효는 커피와인에 종초를 30%(v/v) 첨가하여 진탕배양기(SI-2S, Universal Scientific Industrial Co., Ltd., Shanghai, China)에서 진탕배양 조건(30°C, 120 rpm, 20일)하에 수행되었고, 배양기간 동안 5일 간격으로 샘플링하여 차후 분석용 시료로 사용하였다.
생균수는 멸균 펩톤수를 이용하여 연속희석법으로 희석하고 GY 평판배지에 도말하여 배양(30°C, 2일)한 후 생성된 균집락을 계수하여 log CFU/mL로 표기하였다. 수용성 고형분 함량은 당도계(PAL-1, ATAGO Co., Tokyo, Japan)를 사용하여 측정한 후 °Brix 단위로 표기하였다. pH는 pH meter(PP-20, Sartorius, Gottingen, Germany)를 사용하여 측정하였고, 총산도는 시료 1 mL에 0.1 N NaOH를 첨가하여 pH 8.3에 도달할 때까지 소모된 NaOH 적정량(mL)에 acetic acid의 환산계수(0.006)를 곱하여 백분율(%)로 산출하였다.
유기산, 유리당 및 잔류 에탄올의 변화는 Kim과 Song (2002)의 방법을 이용하여 측정하였다. 분석을 위한 시료는 희석하여 Sep-Pak C18 cartridge(Waters Co., Milford, MA, USA)에 통과시키고 0.22 μm membrane filter (Futecs Co., Ltd., Daejeon, Korea)로 여과하여 HPLC system(Hitachi Ltd., Tokyo, Japan)으로 분석하였다. HPLC system의 분석조건은 0.008 N H2SO4를 이동상으로 Aminex HPX-87H Column(300×7.8 mm, 9 μm, Bio-Rad Laboratories Inc., Hercules, CA, USA)을 통과하는 유속은 0.6 mL/min로, 컬럼 온도는 35°C를 유지하도록 하였다. 유기산 검출기는 UV-VIS detector(5410 UV Detector, Hitachi Ltd., Tokyo, Japan)로 유리당 및 에탄올 검출기는 RID detecter(5450 RI Detector, Hitachi, Ltd., Tokyo, Japan)를 사용하였다. 분리된 유기산, 유리당 및 에탄올의 각 peak는 동일조건에서 분석한 표준물질 mixture의 peak 면적비와 retention time을 비교하여 함량을 산출하였다.
Lipase inhibition activity는 Dechakhamphu와 Wongchum(2015)의 방법을 일부 변형하여 측정하였다. Pancreatic lipase(100 unit/mL)는 0.01 M MOPS buffer(pH 6.8, 10 mM MOPS, 1 mM EDTA)에 1 mg/mL 농도로 용해하여 효소액으로 사용하였으며, 기질용액은 p-nitrophenol butyrate(p-NPB)를 dimethyl sulfoxide(DMSO)에 용해하여 0.01 M p-NPB로 사용하였다. 96-well plate에 기질용액 10 μL, 5 mM CaCl2 · 2H2O가 포함된 0.1 M Tris-HCl buffer(pH 7.0) 100 μL, 시료 100 μL 순으로 첨가하여 혼합하였다. 이에 효소액 50 μL를 첨가하여 37°C에서 30분간 반응시킨 후 microplate reader(US/Eon, BioTek Instruments, Inc., Winooski, VT, USA)를 이용하여 405 nm에서 흡광도를 측정하였다. 효소반응으로 생성된 p-NPB의 양을 대조군과 비교하였으며, pancreatic lipase 저해활성은 아래의 계산식을 이용하여 계산하였다.
식초 발효물의 지방 전구세포를 이용한 항비만 효능평가는 초산발효가 완료된 최종 발효물인 15일 차 발효물과 비발효구인 0일 차 발효물에 대해 실시하였다. 각 시료에 잔존하는 에탄올을 제거하기 위하여 회전감압농축기(RV10 B S96, IKA-Werke GmbH & Co., KG, Staufen, Germanay)를 사용하여 에탄올을 증발시킨 후 소량의 증류수를 이용하여 회수하였다. 회수된 시료는 동결건조기(FD 8508, Ilshin Lab Co., Ltd., Dongducheon, Korea)로 건조한 후 분말화하여 −20°C 냉동고에 보관하면서 차후 실험에 사용하였다. 세포평가를 위한 시료는 동결건조된 분말의 시료로 15일 차 발효물을 AFCW, 0일 차 발효물을 AUFCW로 구분하였다. 또한, AFCW에 함유된 chlorogenic acid(CGA) 양을 분석하였을 때, AFCW의 1%(w/w) 수준으로 분석되어 동일수준의 CGA 함량이 세포효능에 미치는 영향을 분석하고자 하였으며, 100 μM EGCG를 지방분화 억제의 양성대조구로 사용하였다. 10% DMSO를 용매로 하여 AFCW, AUFCW는 10 mg/mL, CGA는 0.1 mg/mL의 농도로 용해시켜, Minisart® RC25 Syringe Filter(Sartorius)로 여과한 후 10% FBS, 1% penicillin/streptomycin이 함유된 DMEM 배지로 희석하여 시료 희석액으로 하였다.
Mouse 유래 macrophage cell line인 3T3-L1 세포는 한국세포주은행(Korea Cell Line Bank, KCLB, Seoul, Korea)에서 분양받아 사용하였다. 10% BCS, 1% penicillin/streptomycin이 함유된 DMEM 배지로 5% CO2가 공급되는 37°C incubator(MCO-18AC, Panasonic Health-care Co., Ltd., Osaka, Japan)에서 배양하였다. 세포독성 평가를 위한 3T3-L1 세포는 96-well plate에 5×103 cells/well의 밀도로 분주하고 5% CO2가 공급되는 37°C incubator에서 24시간 배양하였다. 24시간 배양액에 AFCW, AUFCW는 50, 100, 200, 300 μg/mL 농도로 처리하였으며, CGA는 2 μg/mL의 농도로 처리하여 48시간 추가 배양하였다. 배양 48시간 후 상등액은 제거하고 DPBS 100 μL와 CCK-8 solution 10 μL를 첨가하여 암실의 5% CO2가 공급되는 37°C incubator에서 2시간 반응하였다. 반응 후 microplate reader를 사용하여 450 nm에서 흡광도를 측정하였으며, 세포생존율은 시료 비첨가구의 흡광도값에 대한 시료 첨가구의 흡광도값을 백분율로 산출하여 세포생존율이 80% 미만으로 확인되는 시료 처리농도를 세포독성 농도로 분류하였다.
3T3-L1 세포는 분화를 유도하기 위하여 24-well plate에 1×105 cells/well의 밀도로 분주하고 100% confluent 한 상태가 될 때까지 5% CO2가 공급되는 37°C incubator에서 48시간 배양하였다. 각 well의 배양 상등액을 vacuum aspiration system(DLAB Scientific Co., Ltd., Beijing, China)을 이용해 제거한 후 시료 희석액과 분화유도제인 MDI(0.5 mM IBMX, 1 μM dexamethasone, 1 μg/mL insulin, 2 μM rosiglitazone) 용액을 혼합하여 각 well에 처리한 후 48시간(분화 2일 차) 배양하였다. 분화 2일 차에 배양 상등액을 제거한 후 시료 희석액에 insulin을 1 μg/mL 농도로 혼합하여 처리하고, 48시간(분화 4일 차) 배양하였다. 이후, 48시간(2일) 간격으로 배양 상등액을 제거하고 시료 희석액을 처리하는 과정을 2회 반복하여 시료 처리일로부터 8일 후 지방 분화를 종료하였다.
지방 분화된 3T3-L1 세포의 시료 처리에 따른 지질축적률 평가는 Zebisch 등(2012)의 방법을 참고하여 Oil-Red-O 시약을 이용한 염색과 염색된 지질의 양을 정량하여 분석하였다. 시료 처리일부터 8일 동안 배양된 3T3-L1 세포는 DPBS를 이용해 세척하고, 4% para formaldehyde를 처리하여 30분간 정치하여 고정시켰다. 고정된 세포는 DPBS로 세척 후 60% isopropyl alcohol을 5분간 처리하고 완전히 건조하였다. 건조된 세포에 60% Oil-Red-O 시약을 첨가하여 20분간 염색하고 DPBS로 세척하였으며, 현미경(TCM400, Labo America Inc., Fremont, CA, USA)으로 지방구가 염색된 세포의 사진을 촬영하였다. 이후 DPBS를 제거한 후 완전히 건조시키고, 100% isopropyl alcohol로 염색된 지방구를 30분간 용출시키고 microplate reader를 사용하여 500 nm에서 흡광도를 측정하였다.
시료 처리일부터 8일 동안 배양된 3T3-L1 세포 배양액에 leptin 생성량은 mouse/rat leptin Quantikine ELISA를 사용하여 제조사의 지시에 따라 측정하였다. 분화 8일 차 세포 상등액과 assay diluent RD1-55를 혼합하여 shaker에서 실온상태로 2시간 반응하였다. 반응 후 wash buffer로 4회 세척하고 mouse/rat leptin conjugate를 첨가하여 shaker에서 실온상태로 추가로 1시간 반응하였다. 다시 wash buffer로 4회 세척하고 streptavidin-HRP 1을 첨가하여 shaker에서 실온상태로 추가로 30분간 반응하였다. 이후 wash buffer로 4회 세척하고 substrate solution을 첨가하여 암실 상태에서 30분간 반응 후 stop solution을 첨가하여 반응을 종결하였다. 반응 종결 후 microplate reader를 이용하여 450 nm 파장에서 흡광도를 측정하였으며, leptin 생성량은 kit 내 leptin standard를 사용하여 검량선을 그려 산출하였다.
지방 전구세포 3T3-L1 세포는 24-well plate에 1×105 cells/well의 밀도로 분주하고 100% confluent한 상태가 될 때까지 5% CO2가 공급되는 37°C incubator에서 48시간 배양하였다. 배양 상등액을 제거하고 분화유도와 동일한 조건에서 8일 동안 배양하였다. 분화 8일 차 3T3-L1 세포는 DPBS로 세척한 다음 세포를 회수하여 RNeasy mini kit를 사용하여 total RNA를 추출하였으며, GoStript™ Reverse Transcription system을 사용하여 cDNA를 합성하였다. 합성된 cDNA는 microplate reader의 Take3 micro-volume plates로 cDNA 함량을 정량하였으며, 이를 template로 사용하여 polymerase chain reaction (PCR)을 진행하였다. 분석에 사용된 PPAR-γ, SREBP-1c 및 GAPDH primer 염기서열은 Table 1과 같다. PCR 조건은 초기변성(95°C, 3분), denaturation(95°C, 30초), annealing(60°C, 30초), polymerization(72°C, 30초) 순서로 30 cycle을 진행하였고, 72°C에서 5분간 처리하여 종결하였다. PCR 결과물은 1.5% agarose gel을 사용하여 전기영동하고, Chemidoc system(c600, AZureBiosystems Inc., Dublin, CA, USA)을 사용하여 밴드의 발현 정도를 확인하였다. 결과는 Imgae J gel analysis software(NIH, Bethesda, MD, USA)를 이용하여 housekeeping gene인 glyceraldehyde 3-phosphate dehydrogenase(GADPH)에 대한 PPAR-γ 및 SREBP-1c 발현량을 분석하였다.
3. 결과 및 고찰
커피와인의 초산발효는 초산균의 초산 생성능 활성을 위해 커피 추출물과 에탄올이 함유된 배양환경(30°C, 120 rpm, 8일)에서 발효된 종초를 이용하여 커피와인에 첨가하는 방법으로 실시되었다. 종초의 발효일차에 따른 생균수 변화는 발효 4일 차에 8.47 log CFU/mL로 최대였으며, 이후 감소하여 발효 8일 차에 7.68 log CFU/mL 수준이었다. 한편 발효일차별 총산도의 변화는 발효 4일 차에 1.44%이었으며, 발효 8일 차에는 4.41%에 도달하였다(Park, 2023). 이와 같은 결과로 종초의 발효기간은 생균수가 7 log CFU/mL 이상 유지되고, 산도가 4% 이상 증가되어 내산성이 확보된 것으로 판단되어 최종 8일로 하였다(Park, 2023). 초산균의 안정적인 증식 및 초산 생성을 위하여 제조된 종초는 커피와인에 30% 첨가한 후, 발효기간에 따른 생균수 변화 및 이화학적 특성을 분석하였다(Table 2). 커피와인 초산발효물의 발효기간에 따른 생균수는 발효 0일 차 6.35 log CFU/mL에서 발효 5일 차에 6.65 log CFU/mL로 증가하였으며 이후 발효가 진행됨에 따라 점차 감소하여 발효 20일 차 3.64 log CFU/mL로 확인되었다. 발효기간에 따른 수용성 고형분 함량은 발효 0일 차 8.10 °Brix에서 발효가 진행됨에 따라 증가하였으며 발효 20일 차에 8.77 °Brix로 확인되었다. 이는 인삼농축액 발효식초와 현미 발효식초 제조에서 초산발효 기간에 따라 수용성 고형분 함량이 증가하는 결과와 유사하였다(Moon 등, 2021; Sim 등, 2021). pH의 변화는 발효기간에 따라 발효 0일 차 3.88에서 발효 20일 차에 3.11로 감소하였고, 총산도는 초산을 기준으로 하였을 때 발효 0일 차 1.29%에서 발효 20일 차 7.34%로 증가하였으며 발효 15일 차와 유의적인 차이가 없었다. pH의 감소 및 총산도의 증가는 발효과정 중 생성된 유기산에 의한 것으로 판단된다. 식초의 품질규격은 총산도 기준 4.0-20.0%(w/v)로 고지되어 있으며(KFDA, 2012), 커피와인의 초산발효의 경우, 발효 10일 차부터 4% 이상에 도달하였으나 잔류하는 에탄올 함량을 최소화하고 발효 15일 차까지 총산도의 증가가 확인되었기 때문에 총산도가 가장 높은 발효 15일 차를 최종 발효 완료시점으로 하였다.
커피와인을 이용한 초산발효 시 발효기간에 따른 유기산, 유리당 및 에탄올 함량 변화를 분석한 결과는 Table 3과 같다. 커피와인을 이용한 초산발효 초기의 유기산은 citric acid, succinic acid, acetic acid 등 3종이 검출되었으며, 종초 첨가의 영향으로 acetic acid가 주요 유기산으로 확인되었다. 발효 전(0일 차, AUFCW) 유기산 함량은 acetic acid(987.80 mg%), succinic acid(359.13 mg%), citric acid(56.61 mg%) 순이었으며, 발효 후(15일 차, AFCW)에는 각각 5,921.43, 434.96 및 69.43 mg%로 5.99, 1.21 및 1.23배 증가하였다. Bang 등(2020)은 오디 발효식초 연구에서 acetic acid를 주요 유기산으로 보고하여 본 연구와 유사한 경향을 보였다. 특히, 발효에 의해 증가된 acetic acid, succinic acid 및 citric acid 등의 유기산들은 체내 TCA cycle에서 이용되는 주요 유기산으로 생체 내 균형을 유지하는 데 도움을 주는 것으로 알려져 있다(Bang 등, 2020). 이와 같은 결과는 초산발효에 의한 유기산의 증가가 총산도 및 pH 변화에 기인하는 것으로 판단된다.
커피와인 초산발효물의 유리당 분석결과, 검출된 glucose의 농도는 1.13%-1.16%(w/v)로 발효기간에 따른 큰 유의차가 없었다. 초산발효 전(0일 차, AUFCW) 에탄올의 함량은 6.02%(w/v)로 분석되었으며, 발효기간에 따라 감소하여 최종 발효물(15일 차, AFCW)에서는 검출되지 않아 모두 소모된 것으로 분석되었다. 호기적 상태에서 초산균에 의한 초산 생성과정은 함유된 에탄올이 아세트알데히드를 거쳐 초산으로 산화되는 과정으로 초산 생성을 위한 glucose의 함량변화는 거의 없다(Kang 등, 2011). 따라서, 본 연구에 사용된 초산균 A. pasteurianus CT_02는 6.02%(w/v)의 에탄올을 5,921.43 mg%(w/v) acetic acid로 전환시켜 전환율이 약 98.36%로 분석되었다.
커피와인 초산발효물의 lipase 저해활성은 lipase 효소의 활성을 저해하는 천연소재로서의 유효성을 평가하기 위하여 항비만 효능평가를 진행하였다(Table 4). 평가방법의 양성대조구로 사용되는 orlistat은 비만 치료제로서 pancreatic lipase의 활성부위에 결합하여 중성지방의 가수분해를 방해하는 물질로 사용되지만, 지용성비타민 흡수 억제, 위장장애, 과민증 등 여러 부작용이 보고되고 있다(Jang 등, 2021a). 커피와인 초산발효물의 pancreatic lipase 저해활성은 초산 발효기간이 경과함에 따라 농도 의존적으로 증가하는 경향을 보였다. 발효 0일 차 시료의 경우, 종초로부터 유래한 유기산의 영향으로 원액을 200배 희석하였을 때도 15.11%의 활성이 확인되었고, 동일 희석배수에서 발효 15일 차 시료의 억제활성은 80.36%로 분석되었다. 이는 커피추출물 자체의 lipase 저해활성(Soares 등, 2022) 및 당근식초(Kim 등, 2018)와 아로니아식초(Jang 등, 2021a)의 초산발효 시 생성되는 acetic acid 등과 같은 유기산에 의한 lipase 저해활성에 의한 것으로 판단된다. 따라서 초산발효가 완료된 커피식초는 지방의 분해를 억제하여 소장 점막 내 지방산의 흡수율을 감소시키면서, 비만 치료제와 비교해 부작용이 적은 비만 예방 소재로 활용될 수 있을 것으로 기대된다.
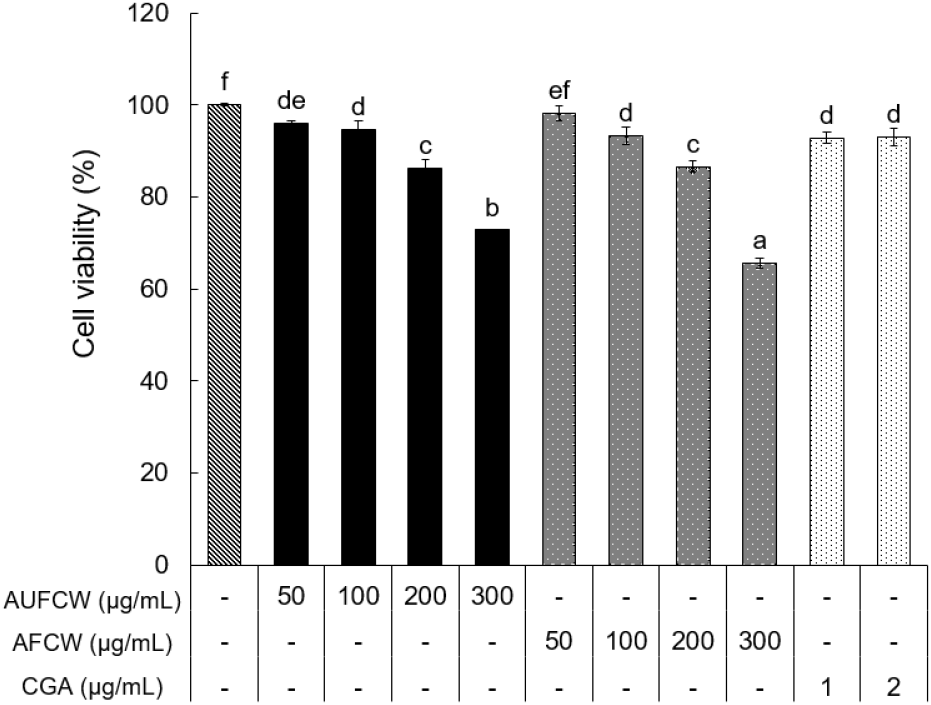
커피와인을 이용한 커피 식초발효물의 3T3-L1 세포에 대한 세포독성 평가결과는 초산발효에 의한 독성농도를 비교하고자 AUFCW 및 AFCW의 동결건조물을 50, 100, 200, 300 μg/mL 농도로 처리하여 분석하였다(Fig. 1). AUFCW 및 AFCW에 함유된 클로로젠산(CGA, 5-CGA⟷3-CGA)은 약 1% 이내로 HPLC 분석 결과 확인되었고, 초산발효에 의한 유의적인 차이는 없는 것으로 나타났다(data not shown). 본 연구에서는 3T3-L1 세포에 대한 항비만 효능의 양성대조구로 CGA를 이용하였고, 세포독성은 ISO 10993-5(2009)의 방법을 참고하여 시료 비처리구에 비해 각 시료처리구의 세포생존율이 80% 이상 유지된 처리농도를 선별하였다. AUFCW와 AFCW의 300 μg/mL 처리농도에서 각각 72.82% 및 65.62%의 생존율을 나타냈으나, 50-200 μg/mL의 농도구간에서는 80% 이상의 세포생존율을 나타내 세포독성이 유발되지 않음을 확인하였다. 한편, CGA 2 μg/mL 이하의 처리농도에서는 80% 이상의 생존율을 나타내 세포독성이 확인되지 않았다. 따라서 추후 실험에서는 AUFCW 및 AFCW의 100, 200 μg/mL 농도와 CGA의 1, 2 μg/mL 농도에서 지방분화 억제효능 실험을 진행하였다.
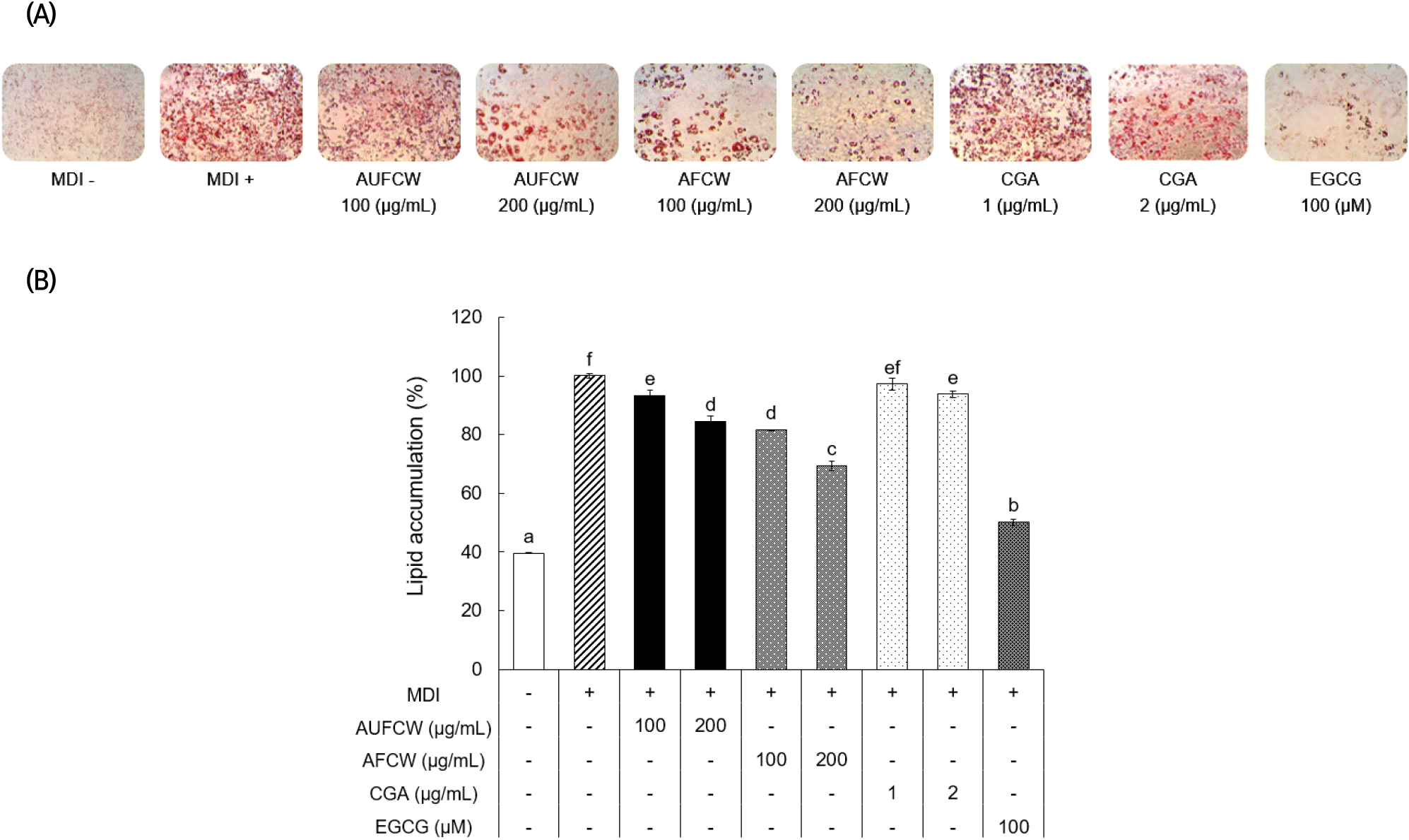
커피식초의 초산균 발효 전후 처리에 따른 지질 축적률을 평가하기 위해 3T3-L1 세포에 지방분화 유도제인 MDI로 8일 동안 지방 전구세포를 분화하여 Oil-Red-O 염색 후 지방구의 형성을 관찰한 결과는 Fig. 2(A)와 같다. MDI 단독처리구(+)에 비해 모든 처리구에서 처리농도 의존적으로 중성지질의 염색 정도가 감소하였으며, AFCW 200 μg/mL 처리농도에서 지방구의 크기와 개수가 감소하여 커피식초의 지방분화 억제효과를 확인하였다. 또한 지질 축적률을 수치화하기 위하여 Oil-Red-O로 염색된 세포를 isopropanol로 용출시켜 흡광도를 측정하였을 때, MDI 단독처리구(+) 100%를 기준으로 모든 시료 처리구에서 농도 의존적으로 중성지질 축적이 감소하였다(Fig. 2(B)). AUFCW와 AFCW의 지질 축적률은 처리농도가 증가함에 따라 농도 의존적으로 감소하였으며, 200 μg/mL 처리 농도에서 각각 84.34%와 69.37%를 나타내었다. CGA의 지질축적률은 처리 농도에 따라 유의적인 차이가 크지 않았으며, 2 μg/mL 농도에서 93.74%로 측정되었다. 이들 중 AFCW가 가장 높은 억제활성을 나타내는 것을 바탕으로 클로로젠산의 일부 영향 및 초산발효를 통해 지질 축적 억제능이 증가한 것을 확인할 수 있었다.
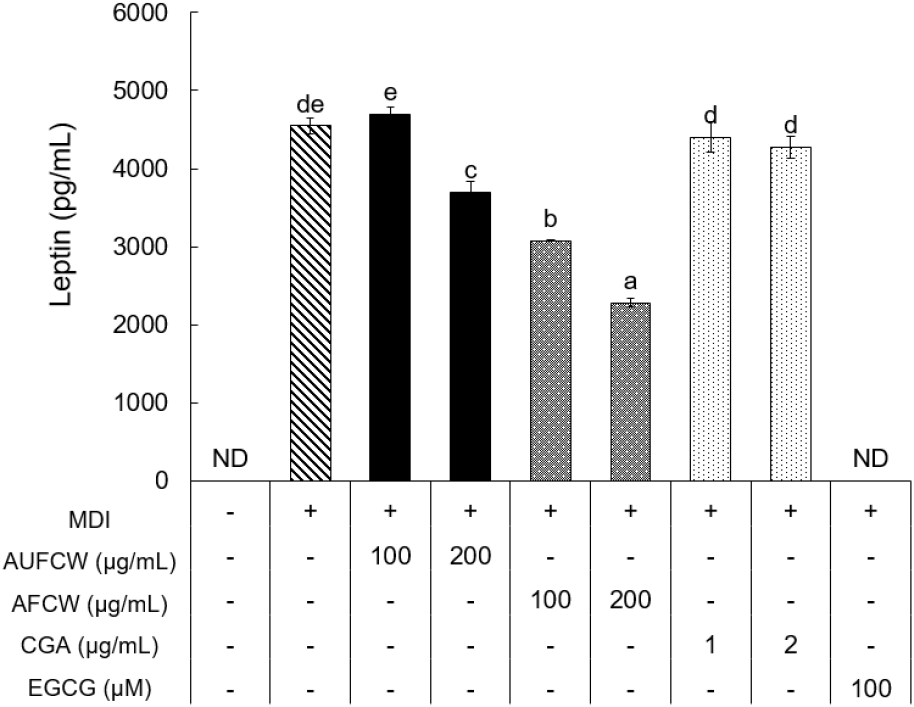
렙틴은 지방세포에서 분비되며 in vivo에서는 중추신경계에 작용하여 식욕억제 및 에너지 소비를 촉진시켜 에너지 항상성을 유지하는 역할을 하며, in vitro에서도 지방세포의 지방 축적에 비례하여 렙틴의 분비 증가를 바탕으로 지방 축적의 정도를 알 수 있는 중요 지표로 사용된다(Kim 등, 2010). 본 연구에서 3T3-L1 지방 전구세포에 커피식초의 초산발효 전후 처리에 따라 분화유도 8일 후 세포배양액에 함유된 렙틴 단백질을 정량한 결과는 Fig. 3과 같다. MDI 단독 처리구(+)에서 렙틴 단백질 발현량은 4,548 pg/mL이었으며, AUFCW와 AFCW 200 μg/mL 처리 농도에서 각각 3,693 및 2,283 pg/mL로 각각 18.80%와 49.80% 억제능을 나타냈다. CGA는 처리농도에 따른 유의적인 차이가 없었으며 2 μg/mL 처리 농도에서 4,278 pg/mL로 5.94% 억제능을 나타내었다. 이와 같은 결과는 클로로젠산의 억제효과보다는 초산발효물인 AFCW가 AUFCW에 비해 억제효과가 높았던 것으로 보아 초산발효를 통해 단백질 발현 억제효과가 증가한 것으로 판단된다.
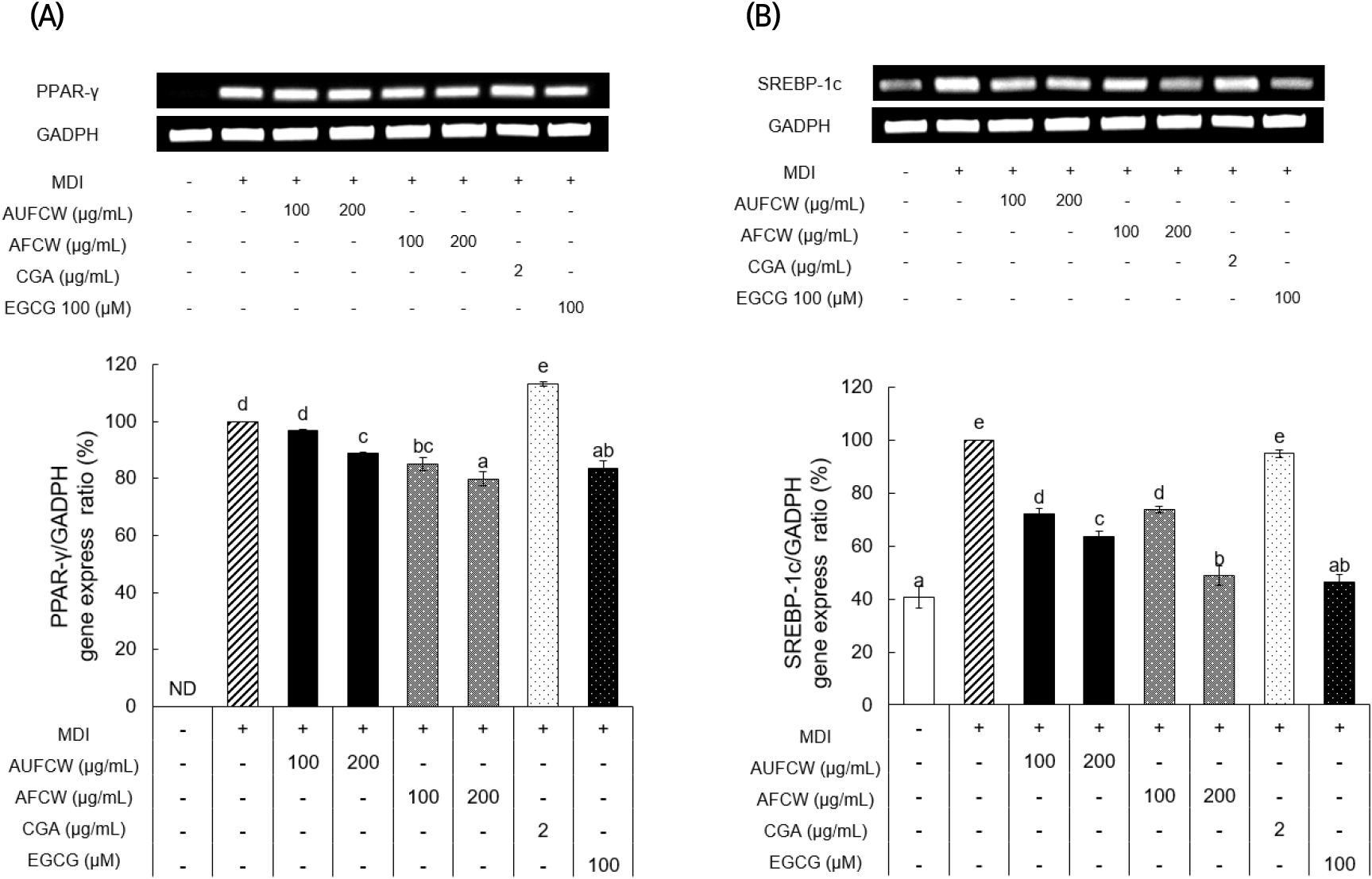
지방 전구세포(preadipocyte)가 지방세포(adipocyte)로 성숙하는 과정(adipogenesis)은 여러 가지 전사인자, 단백질 및 호르몬 등이 관여하고 있으며, 특히 PPAR-γ, C/EBPα와 SREBP-1 등은 adipogenesis 과정에 관여하는 중요한 전사인자이다(Jang 등, 2021b). Nuclear receptor superfamily에 속하는 PPAR-γ는 adipogenesis 과정을 총괄적으로 조절하는 역할을 하고, adipocyte로 분화된 상태를 유지하기 위해 필수적인 인자이다(Park 등, 2014). 지방세포 후기 분화과정에서 분화 유도인자인 MDI에 노출되면 PPAR-γ 및 C/EBPα의 발현을 촉진시켜 지방세포 내 중성지방의 축적을 증가시키며, 이러한 지방 생성관련 유전자 발현 감소로 인하여 항비만 활성을 평가한다(Kim 등, 2020). 이러한 지방 생성 관련 유전자 발현량을 조사하기 위하여 RT-PCR을 통해 mRNA 수준에서 MDI 단독 처리구(+)대비 시료 처리에 따른 PPAR-γ 발현량을 비교분석하였다(Fig. 4(A)). PPAR-γ는 MDI 단독 처리구(+)의 발현량을 100%로 하였을 때, AUFCW와 AFCW 200 μg/mL 처리농도에서 각각 88.77% 및 79.89%로 발현량이 감소하였으며, CGA를 2 μg/mL 처리하였을 경우 113.29%로 AFCW의 PPAR-γ 유전자 발현량의 저감 효과가 가장 높았다. SREBP는 콜레스테롤 및 지방산대사에 관여하는 유전자들의 발현을 조절하는 전사인자로, SREBP-1c는 지방산대사 및 lipid의 생합성에 관여한다(Sim 등, 2021). ADD1/SREBP1c의 발현은 세포가 여러 호르몬 유도제로 자극될 때 지방 생성을 촉진하는 동시에 PPAR-γ 유전자의 발현을 촉진하여 지방세포의 분화를 촉진하는 것으로 알려져 있다(Kim 등, 1998). SREBP-1c는 MDI 단독처리구(+)의 발현량을 100%로 하였을 때, AUFCW 및 AFCW의 200 μg/mL 처리농도에서 각각 63.71%와 48.81%로 발현량이 감소하였으며, CGA 2 μg/mL 처리농도에서 94.82%로 AFCW의 SREBP-1c 유전자 발현량 저해효과가 높은 것으로 나타났다. 이와 같은 결과는 커피와인으로부터 초산발효 과정을 거친 커피식초가 지방 생성관련 유전자인 PPAR-γ 및 SREBP-1c의 발현량을 감소시킨 것을 통해 결과적으로 항비만 효능이 더 증진되었던 것으로 판단된다.
4. 요약
본 연구에서는 고초균으로 발효된 브라질산 원두로 커피추출물을 제조하였으며, 효모 발효를 위한 혼합액(20% glucose, 1% yeast extract, 70% roasted coffee extract)에 Saccharomyces cerevisiae SRCM102539 균주를 접종한 후, 정치배양(30°C, 5일)하여 커피와인을 제조하였다. 커피식초는 Acetobacter pasteurianus CT_02 균주로 제조한 종초를 커피와인에 30%(v/v) 첨가하고, 진탕배양(30°C, 120 rpm, 15일)하였으며 발효기간 중 5일 간격으로 생균수, 이화학적 특성(수용성 고형분 함량, pH 및 총산도), 유기산, 유리당 및 에탄올 함량을 분석하였다. 초산균 발효 전(0일 차, AUFCW)과 후(15일 차, AFCW)의 생균수, 수용성 고형분 함량, pH 및 총산도의 변화는 각각 6.35 log CFU/mL에서 4.19 log CFU/mL, 8.10 °Brix에서 8.57 °Brix, 3.88에서 3.07 및 1.29%에서 7.45%로 나타났다. HPLC 분석을 통한 glucose의 함량은 발효기간에 따라 유의적인 차이가 없었으며, 에탄올 함량은 AUFCW에서 6.02%(w/v)였으나, AFCW에서는 검출되지 않았다. AFCW의 주요 유기산은 acetic acid(5,921.43 mg%), succinic acid(434.96 mg%)와 citric acid(69.43 mg%)로 3종이 검출되었다. 커피식초의 pancreatic lipase 저해활성은 발효기간이 경과함에 따라 증가하는 경향을 나타내었다. MDI로 지방분화가 유도된 3T3-L1 세포에 대한 AFCW의 항비만 효능평가를 지질축적률, 렙틴 단백질 발현량 및 지방 생성관련 유전자(PPAR-γ 및 SREBP-1c)의 mRNA 발현량 분석으로 진행하였다. AFCW의 항비만 효능은 200 μg/mL 농도 처리 시 MDI 단독 처리구 100%에 비해 지질축적률은 69.37%, 렙틴 단백질 함량은 50.20%로 감소하였으며, PPAR-γ 및 SREBP-1c의 mRNA 발현량은 각각 79.89% 및 48.81%로 감소하였다. 이러한 결과를 바탕으로 커피와인으로 제조된 커피식초가 초산균의 발효과정을 통해 항비만 효능을 더 증가시켰음을 확인할 수 있었다.










