Research Articles
복숭아 나뭇가지 분획추출물의 라디칼 소거 및 소화효소 저해활성 평가
이유정1
,
정경한2
,
홍주연3,*
,
김태훈1,*
Evaluation of radical scavenging and diasestive enzyme inhibitory capacities of peach twigs fraction extract (Prunus persica L. Bastch)
Youjeoung Lee1
,
Gyeong Han Jeong2
,
Ju Yeon Hong3,*
,
Tae Hoon Kim1,*
Author Information & Copyright ▼
2한국원자력연구원 첨단방사선연구소 방사선바이오연구부
1Department of Food Science and Biotechnology, Daegu University, Gyeongsan 38453, Korea
2Research Division for Biotechnology, Advanced Radiation Technology Institute (ARTI), Korea Atomic Energy Research Institute (KAERI), Jeongeup 56212, Korea
3Department of Food Nutrition, Daegu Haany University, Gyeongsan 38578, Korea
Citation: Lee Y, Jeong GH, Hong JY, Kim TH. Evaluation of radical scavenging and diasestive enzyme inhibitory capacities of peach twigs fraction extract (Prunus persica L. Bastch). Korean J Food Preserv, 30(1), 170-178 (2023)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Nov 30, 2022; Revised: Dec 20, 2022; Accepted: Dec 23, 2022
Published Online: Feb 28, 2023
4. 요약
본 연구에서는 복숭아 나뭇가지를 이용하여 열수 추출하고 얻어진 추출물에 대해 유기용매를 이용하여 극성별 분획을 실시하였으며, 열수추출물 및 분획물의 항산화 활성과 관련된 총페놀 함량, DPPH 및 ABTS+ 라디칼 소거능, α-glucosidase 및 α-amylase 저해능을 측정하였다. DPPH 라디칼 소거능 측정에서는 페놀성 물질의 함량을 가장 많이 나타낸 EtOAc 가용부의 IC50값이 3.82±1.6 μg/mL로 가장 우수한 활성을 나타내었고, ABTS+ 라디칼 소거활성 평가에서도 EtOAc 분획물에서 IC50값이 16.5±0.7 μg/mL로 강한 라디칼 소거활성을 나타내었다. 항당뇨 활성과 관련된 효소인 α-glucosidase 및 α-amylase 저해능 평가에서도 우수한 라디칼소거능을 나타낸 EtOAc 분획물에서 IC50값이 각 38.2±1.6 및 69.6±6.1 μg/mL로 다른 유기용매 분획물에 비해 우수한 저해 활성임을 확인하였다. 이러한 결과는 복숭아 나뭇가지 추출물이 항산화 및 항당뇨 효능을 가지며, 새로운 천연물 유래의 기능성 신소재 발굴을 위한 기초자료로 이용 가능할 것으로 사료된다.
Abstract
We investigated the free radical scavenging and digestive enzyme inhibitory activities of the hot water extract of peach twig (Prunus persica L. Bastch). This extract of the peach twigs was further split up into n-hexane, ethyl acetate (EtOAc), and n-butyl alcohol(n-BuOH), which resulted in three solvent-soluble fractions. Free radical scavenging activity was evaluated using 2,2-diphenyl-1-picrylhydrazyl (DPPH) and 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS+) assay systems, while hypoglycemic effect of the peach twig extract and the solvent-soluble fractions were tested using α-glucosidase and α-amylase inhibition assays. Accordingly, the EtOAc layer showed a greater free radical scavenging activity compared to other solvent-soluble fractions. Furthermore, based on the α-glucosidase and α-amylase assays, the IC50 values were determined to be 38.2±1.6 and 69.6±6.1 μg/mL for the EtOAc-soluble fractions, respectively. Taken together, these results suggest that the fractions obtained from the peach twig extract can be considered as a potential source of natural antioxidant and hypoglycaemic constituents.
Keywords: Prunus persica; DPPH; ABTS+; α-glucosidase; α-amylase
1. 서론
우리가 살아가는 환경 속에서 마주치는 자외선, 흡연, 매연, 약물 및 방사선 등의 여러 요인에 의하여 superoxide(O2−), nitric oxide(NO), nitrogen dioxide(NO2), hydroxyl(OH) 및 peroxynitrite(ONOO−) 등과 같은 활성산소종(reactive oxygen species)은 인체 내에서 산화를 유발하여 산화적 스트레스를 유발하게 된다(Fang 등, 2002; Halliwell과 Aruoma, 1991). 인체에 축적되는 과도한 산화적 스트레스는 DNA, 지질, 단백질, 당 등의 세포 구성성분 을 파괴하며, 이로 인해 노화가 촉진 및 암, 뇌질환, 심혈관계질환, 피부 질환 등과 같은 성인병을 유발하기도 한다(Lobo 등, 2010). 항산화 물질은 체내에서 불안정한 활성산소종 및 자유라디칼을 중화시키고, 각종 성인병 예방 및 노화 방지 등의 기능을 하는 성분을 말한다. 대표적인 합성 항산화제로서 butylated hydroxy anisol 및 butylated hydroxytoluene이 개발되었으나, 독성 및 발암성 등의 부작용이 발견되어 사용이 제한되고 있어 보다 안전하고 부작용이 적은 천연 항산화제의 개발이 필요한 실정이다(Farag 등, 1989; Madsen과 Bertelsen, 1995).
당뇨병은 고혈당 상태가 오랜 기간 지속됨에 따라 심근경색, 뇌졸중, 시신경 손상, 협심증 및 족부 궤양 등의 만성 합병증을 유발하는 매우 위험한 대사성 질환으로 제1형 및 제2형 당뇨병으로 구분되며, 제1형 당뇨병은 인슐린 분비를 담당하는 췌장의 베타세포에 변이가 생겨 결핍되는 인슐린 의존성이고, 제2형 당뇨병은 비의존성 당뇨로 정의된다(Israili, 2011). 일반적으로 당뇨병과 항산화 작용은 밀접한 상관관계가 있는데, 이는 췌장 베타세포의 손상이 산화적 스트레스에 의해 발생되고, 이것이 곧 인슐린 분비 감소로 이어져 항산화제가 당뇨병 개선에 관련되어 있음이 보고가 되었다(Schwarz와 Mertz, 1959). 당뇨병 치료제 개발의 목적으로 여러 작용기전 중 하나인 α-glucosidase 및 α-amylase 소화효소를 억제하는 방법이 있다. 소장 및 췌장에서 분비되는 α-glucosidase 및 α-amylase는 다당류를 단당류로 분해하는 효소로, 이 효소를 저해함으로 분해되는 단당류의 양을 감소시키고 흡수되는 당 역시 감소함으로써 식후 급격한 혈당 상승을 막아준다(Derosa와 Maffioli, 2012). 현재까지 잘 알려진 α-glucosidase 및 α-amylase 저해제로는 acarbose 및 voglibose 등이 있지만, 복부팽만, 설사 및 변비 등의 부작용들이 보고되어 있다(Kihara 등, 1997; Tsujimoto 등, 2008). 이에 보다 안전하고 부작용이 적은 천연 기능성 소재로부터 α-glucosidase 및 α-amylase 저해제의 개발이 필요한 실정이다.
복숭아나무(Prunus persica)는 장미과에 속하며, 원산지는 중국이고 전 세계적으로 약 3,000종의 품종이 있는 것으로 알려져 있다(Liao 등, 2019). 복숭아 열매에는 유기산과 미네랄 및 섬유질 등이 풍부하게 함유되어 있으며, chlorogenic acid 및 quercetin 배당체류의 페놀 유동체가 주요 성분으로 잘 알려져 있고(Bento 등, 2020), 항산화 활성이 우수한 것으로 보고가 되었다(Mokani와 Madani, 2016). 최근 복숭아 열매뿐만 아니라, 잎, 나뭇가지, 줄기 및 씨앗 등의 다양한 부위에 대한 기능성과 관련된 연구가 활발히 진행 중이다. 이전 연구에서 복숭아 잎 추출물은 혈당 상승을 억제한다는 것이 동물실험을 통해 증명되었고, 활성을 나타내는 물질의 구조가 동정되었다(Shirosaki 등, 2012). 복숭아 씨 추출물에서는 amygdalin 유도체의 구조가 동정되었으며, 우수한 항종양 활성이 보고되었다(Fukuda 등, 2003). 또한 복숭아 나뭇가지 추출물에서 항고혈압, 항비만 및 항알츠하이머 등의 활성이 보고되었으나(Kim 등, 2019; Nakagawa 등, 2018), 항산화 및 혈당상승 억제에 관련된 연구는 없었다. 이에 본 연구에서는 복숭아 나뭇가지를 이용하여 열수로 추출하였으며, 유기용매를 이용하여 분획을 수행하였다. 얻어진 추출물 및 각 분획물은 항산화 활성과 관련된 총페놀 화합물의 함량, DPPH 및 ABTS+ 라디칼 소거 활성 평가와 혈당 상승과 관련된 α-glucosidase 및 α-amylase 저해능을 평가함으로써 천연물 유래의 기능성 신소재 발굴을 위한 기초자료로 이용 가능성을 검토하고자 하였다.
2. 재료 및 방법
2.1. 실험 재료
본 실험에 사용한 복숭아 나뭇가지는 경상북도 청도군에서 2018년 1월 채취하여 건조된 복숭아 나뭇가지를 사용하였으며, 표본 시료는 대구대학교 식품공학과 천연물 신소재 실험실에 보관하고 있다. 활성의 평가에 사용된 gallic acid, (+)-catechin, acarbose, 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS+), 1,1-diphenyl-2-picrylhydrazyl (DPPH), Saccharomyces cerevisiae 유래의 α-glucosidase 및 porcine 유래 소화효소인 α-amylase(EC3.2.1.1)의 시약은 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입 후 사용하였다. 추출 및 분획에 사용된 용매는 모두 1급 이상의 등급을 사용하였다.
2.2. 추출물 제조 및 분획
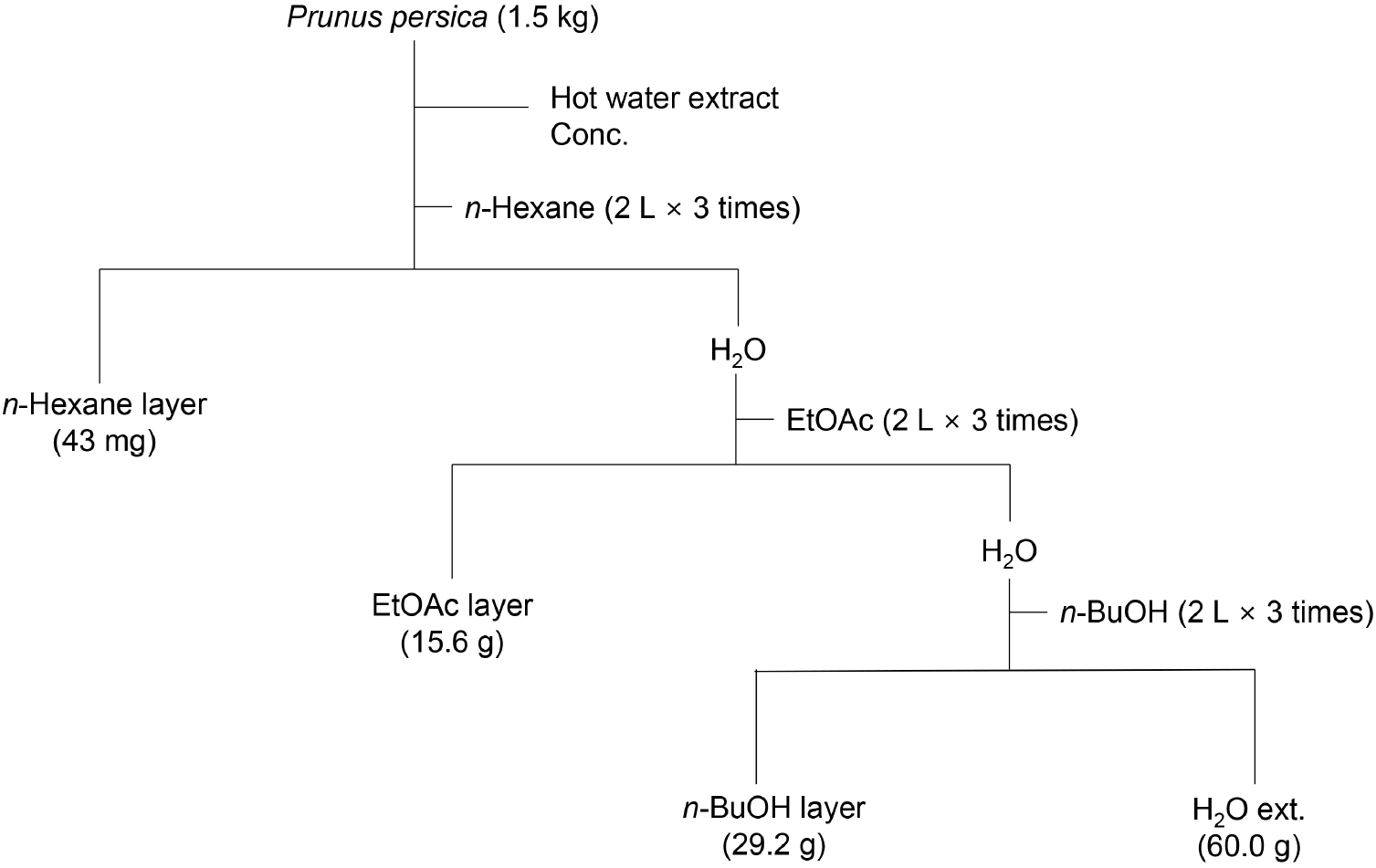
건조 복숭아 나뭇가지 1.5 kg을 분쇄기로 잘게 마쇄한 후, 증류수 10 L로 70°C에서 3시간 동안 열수 추출 후 여과 및 농축하였다. 얻어진 복숭아 나뭇가지 열수 추출물(140 g)은 10% methyl alcohol(MeOH)로 용해한 후 n-hexane으로 최초 분획하였고, 물층을 다시 ethyl acetate(EtOAc) 및 포화된 n-butyl alcohol(n-BuOH)로 3회 분획하였다. 각 유기용매 분획물은 저온 감압 농축한 후 건조하여 n-hexane 분획물(0.1 g), EtOAc 분획물(15.6 g), n-BuOH 분획물(29.2 g) 및 H2O 분획물(60.0 g)을 얻었으며, 각 분획 방법은 Fig. 1과 같다. 농축된 복숭아 나뭇가지 열수 추출물과 유기용매 분획물은 총페놀성 화합물 함량 평가, 라디칼 소거능 및 소화효소 저해능 평가용 시료로 사용하였다.
2.3. 총페놀성 화합물 함량 측정
복숭아 나뭇가지의 열수 추출물 및 각 유기용매 분획물의 총페놀성 화합물의 함량은 Folin-Denis 방법에 따라 측정하였다(Gao 등, 2000). 추출물과 분획물의 농도를 1.0 mg/mL로 한 후, 시료 50 μL와 0.7 M의 탄산나트륨 포화용액 50 μL, Folin-Denis 시액 50 μL를 차례로 넣은 후 이것을 잘 혼합하여 실온에서 60분 방치하였다. 흡광도는 ELISA reader(Infinite F200, Tecan Austria GmBH, Grödig, Austria)를 활용하여 750 nm에서 측정하였으며, gallic acid를 표준물질로 하여 표준곡선을 작성하였고, 시료 1 g당 mg gallic acid(mg GAE/g)로 결과를 나타내었다.
2.4. 라디칼 소거활성 측정
복숭아 나뭇가지 열수 추출물 및 분획물의 DPPH 라디칼 소거활성은 Blois(1958)가 행한 방법을 참고하여 측정하였다(Blois, 1958). 각 시료용액 120 μL에 0.45 mM의 DPPH(2,2-diphenyl-1-picrylhydrazyl) 용액 60 μL를 넣고 교반한 후 15분간 방치한 다음 517 nm에서 ELISA reader를 이용하여 흡광도를 측정하였다.
ABTS+ 라디칼 소거능은 Re 등(1999)의 방법을 변형하여 다음과 같이 측정하였다(Re 등, 1999). 동량의 2.4 mM 과황산칼륨와 7 mM ABTS+ 시약을 혼합 후 실온 및 암소에서 12시간 방치하여 라디칼의 생성을 유도하였다. 이후 EtOH 용매로 농도조절 후 O.D값(734 nm에서)이 0.7-0.8 정도로 조절 후 측정하였다. 먼저 희석한 ABTS+ 라디칼 100 μL와 농도별로 조제한 시험시료 100 μL를 혼합 후 실온에서 7분간 반응하여 ELISA reader로 흡광도 734 nm에서 측정하였다. DPPH 및 ABTS+ 라디칼 소거활성 평가에 사용한 양성대조군은 천연물 유래의 항산화물질인 (+)-catechin을 사용하였다. 복숭아 나뭇가지 열수 추출물 및 분획물의 라디칼 소거활성은 시료용액의 첨가군 및 무첨가군의 흡광도 감소율을 확인하였고, IC50(half maximal inhibition concentration)값은 시료가 DPPH 및 ABTS+ 라디칼을 50% 억제하는 농도로 나타내었다.
2.5. 소화효소 저해 활성 측정
α-Glucosidase 저해활성 평가는 Kim(2016)의 방법을 변형하여 효소-기질 반응을 이용한 분광학적 방법으로 측정하였다. 이때, 1 U/mL α-glucosidase 90 μL에 시료 또는 0.1 M sodium phosphate buffer(pH 6.8) 10 μL를 넣고 혼합한 후 37°C에서 15분 동안 반응하였다. 이후 기질인 1 mM의 p-NPG 100 μL를 넣고 5분 동안 반응시킨 후 기질로부터 유리되어 나오는 p-nitriphenol을 ELISA reader로 405 nm에서 흡광도를 측정하였다. 이때 양성대조군으로는 α-glucosidase 저해 활성이 우수하다고 알려진 acarbose를 사용하였다.
α-Amylase 저해활성 평가는 Kawamura-Konishi(2012)가 행한 방법을 변형하여 분광학적 방법으로 측정하였다. 90 μL의 α-amylase(1.0 U/mL)를 시험 농도별로 희석 후 시료 10 μL와 혼합한 후 37°C에서 10분 동안 반응하였다. 이후 1% 전분용액(20 mM sodium phosphate buffer, pH 6.8)을 첨가하고, 추가적으로 37°C에서 10분 동안 반응하였다. 반응 후 DNS 용액(1% 3,5-dinitrosalicylic acid, 12% sodium potassium tartrate) 100 μL를 첨가하여 반응을 정지시킨 다음 80°C에서 약 10분간 발색시킨 후 냉각한 뒤 540 nm에서 흡광도를 측정하였다. α-Glucosidase 및 α-amylase 저해활성 평가에 사용한 양성대조군은 acarbose를 사용하였으며, 복숭아 나뭇가지 열수 추출물 및 분획물의 소화효소 저해활성은 시료용액의 첨가군 및 무첨가군의 흡광도 감소율을 확인하였고, IC50(half maximal inhibition concentration)값은 시료가 α-glucosidase 및 α-amylase를 50% 억제하는 농도로 나타내었다.
2.6. 통계처리
본 연구의 결과는 3회 이상 반복 실험하여 평균과 표준편차로 나타내었고, 통계처리는 SPSS package program (version 20.0, SPSS Inc., Chicago, IL, USA)을 이용하여 각 실험군 간의 유의성 검증 후 Duncan’s multiple range test로 p<0.05 에서 사후검증을 하였다.
3. 결과 및 고찰
3.1. 복숭아 나뭇가지 추출물 및 분획물 총페놀 함량
복숭아 나뭇가지는 열수를 이용하여 추출하였고, 유기용매를 이용하여 극성별 분획을 수행하였으며, 복숭아 나뭇가지 열수추출물 및 분획물의 총페놀 함량 결과는 Table 1에 나타내었다. 복숭아 나뭇가지 열수추출물은 1 g당 140.6± 15.1 mg GAE/g을 함유하고 있었으며, EtOAc 분획물과 n-BuOH 분획물은 1 g당 각 378.3±62.5 및 192.9±36.9 mg GAE/g으로 열수추출물보다 높게 나타났으며, 상대적으로 총페놀 함량이 가장 높은 것으로 나타났다. 또한, H2O 분획물은 90.2±13.0 mg GAE/g, n-hexane 분획물은 21.9±6.9 mg GAE/g으로 상대적으로 총페놀 함량이 낮음을 보여주었다. 최근 식물에 대한 약효를 나타내는 항산화 활성 연구는 줄기, 뿌리, 잎, 열매 등 약용식물의 종류 및 부위에 따라 총페놀 함량도 매우 상이하다고 보고하였다(Jeong 등, 2019; Lee와 Yoon, 2015). Joo(2020)에 따르면 왕벚나무 껍질 분획물의 총페놀 함량을 측정한 결과, EtOAc 분획물이 가장 높은 값을 나타내었고, n-BuOH 분획물이 분획물 중에서 두 번째로 높은 함량을 나타내었다고 보고하여 본 연구 결과와 유사한 경향을 나타냈다.
Table 1.
Total phenolic contents of fraction extracts from P. persica twigs and its solvent-soluble portions
| Tested samples |
Total phenolic contents (mg GAE/g) |
| Hot water extract |
140.6±15.11)c2) |
| n-Hexane-soluble |
21.9±6.9e |
| EtOAc-soluble |
378.3±62.5a |
| n-BuOH-soluble |
192.9±36.9b |
| H2O residue |
90.2±13.0d |
Download Excel Table
3.2. 복숭아 나뭇가지 추출물 및 분획물 라디칼 소거활성
보라색을 나타내는 DPPH 라디칼은 항산화 활성을 나타내는 물질과 반응하면 탈색되며 흡광도값이 감소한다. ABTS+ 라디칼 역시 청록색을 나타내며, 항산화제와 반응 시 탈색이 되며 흡광도값이 감소하게 되는데, 이 원리를 이용하여 천연소재로부터 항산화제 개발에 많이 이용되고 있다(Dudonne 등, 2009). 본 연구에서는 복숭아 나뭇가지 열수 추출물 및 유기용매 분획물에 대하여 항산화 활성을 확인하기 위하여 DPPH 및 ABTS+ 라디칼 소거활성 평가를 수행하였고, 그 결과는 Table 2 및 Table 3에 나타내었다. 복숭아 나뭇가지 열수 추출물의 DPPH 라디칼 소거활성능의 IC50값은 119.9±7.2 μg/mL의 활성을 나타내었다. n-BuOH 및 H2O 분획물의 IC50값은 각 6.82±2.4 및 105.8±4.5 μg/mL로 열수 추출물에 비하여 조금 상승한 DPPH 라디칼 소거능을 나타내었다. 다음으로 EtOAc 분획물의 IC50값은 3.82±1.6 μg/mL로 유기용매 분획물 중 가장 우수한 활성을 나타냄을 확인하였으며, n-hexane 분획물의 IC50값은 500 μg/mL 이상으로 다소 낮은 DPPH 라디칼 소거활성을 나타내었다. ABTS+ 라디칼 소거활성 평가에서 복숭아 나뭇가지의 열수 추출물의 IC50값이 49.2±2.2 μg/mL의 활성을 나타났으며, n-BuOH 및 H2O 분획물의 IC50값은 각 34.6±3.0 및 188.9±10.4 μg/mL로 준수한 라디칼 소거활성을 나타내었다. 가장 우수한 DPPH 라디칼 소거능을 나타낸 EtOAc 분획물은 ABTS+ 라디칼 소거활성 평가에서도 IC50값이 16.5±0.7 μg/mL로 상대적으로 가장 우수한 라디칼 소거활성을 나타내었다. 이전 연구에서 아몬드 껍질(Prunus amygdalus Batsch) 및 매실나무 꽃(Prunus mume) 추출물에서 우수한 DPPH 라디칼 소거능을 나타내었으며, 활성을 나타내는 flavonoid 및 phenolic acid 유도체의 구조가 동정되었다(Matsuda 등, 2003; Sang 등, 2002). 또한, 자엽꽃자두(Prunus cerasifera)의 나뭇가지 추출물에서 우수한 ABTS+ 라디칼 소거활성이 보고되었다(Song 등, 2018). 특히 페놀성 화합물의 함량이 높으면 DPPH 라디칼 소거능도 우수하다고 보고되고 있다(Anagnostopoulou 등, 2006). 이와 같이 페놀성 화합물 함량과 항산화 활성 간의 상호작용에 대한 많은 연구결과들에서 알 수 있듯이(Choi 등, 2003; Velioglu 등, 1998), 복숭아 나뭇가지 열수 추출물 및 분획물의 DPPH 및 ABTS+ 라디칼 소거활성 평가에서 EtOAc 분획물에서 상대적으로 많은 페놀 화합물이 함유되어 있었으며, DPPH 및 ABTS+ 라디칼을 효과적으로 소거하는 우수한 항산화 소재라고 생각된다.
Table 2.
DPPH radical scavenging activities of fraction extracts from P. persica twigs and its solvent-soluble portions
| Samples |
Scavenging activity (%) |
IC50 values (μg/mL) |
| 500 μg/mL |
250 μg/mL |
125 μg/mL |
62.5 μg/mL |
31.3 μg/mL |
| Hot water |
82.7±0.162)b3) |
75.1±0.12d |
51.0±0.17d |
32.3±0.13d |
13.0±0.16d |
119.9±7.2a |
| n-Hexane layer |
-4) |
- |
- |
- |
- |
>500 |
| EtOAc layer |
99.9±0.13a |
99.9±0.14a |
80.1±0.13b |
67.9±0.12b |
44.5±0.12b |
3.82±1.6e |
| n-BuOH layer |
82.2±0.17b |
81.9±0.15c |
65.4±0.14c |
50.4±0.16c |
29.3±0.13c |
6.82±2.4d |
| H2O layer |
72.9±0.16c |
56.3±0.16e |
37.8±0.12e |
21.1±0.13e |
10.2±0.14e |
105.8±4.5b |
| (+)-Catechin1) |
99.9±0.12a |
95.8±0.12b |
92.4±0.14a |
88.1±0.12a |
72.6±0.15a |
13.0±2.0c |
Download Excel Table
Table 3.
ABTS+ radical scavenging activities of fraction extracts P. persica twigs and its solvent-soluble portions
| Samples |
Scavenging activity (%) |
IC50 values (μg/mL) |
| 500 μg/mL |
250 μg/mL |
125 μg/mL |
62.5 μg/mL |
31.3 μg/mL |
| Hot water |
99.0±0.212)b3) |
92.8±0.18d |
76.8±0.17d |
55.9±0.16d |
37.7±0.13d |
49.2±2.2c |
| n-Hexane layer |
50.4±0.16d |
34.6±0.23f |
23.3±0.26f |
17.2±0.13f |
-4) |
478.1±29.0a |
| EtOAc layer |
99.9±0.13a |
99.7±0.13a |
98.2±0.13a |
90.0±0.12a |
72.2±0.12b |
16.5±0.7e |
| n-BuOH layer |
99.9±0.15a |
96.8±0.14b |
94.6±0.15b |
66.6±0.16c |
45.6±0.14c |
34.6±3.0d |
| H2O layer |
77.0±0.23c |
59.2±0.12e |
36.4±0.16e |
20.6±0.17e |
- |
188.9±10.4b |
| (+)-Catechin1) |
99.9±0.16a |
95.0±0.14c |
92.8±0.14c |
88.4±0.16b |
76.1±0.12a |
9.5±1.9f |
Download Excel Table
3.3. 복숭아 나뭇가지 추출물 및 분획물 소화효소 저해활성
복숭아 나뭇가지 열수 추출물 및 유기용매 분획물을 대상으로 항당뇨 활성과 관련된 α-glucosidase 및 α-amylase 저해활성 평가를 수행한 결과는 Table 4와 Table 5에 나타내었다. 복숭아 나뭇가지 열수 추출물 및 유기용매 분획물의 α-glucosidase 저해활성 결과, 복숭아 나뭇가지 열수 추출물의 IC50값은 97.0±9.8 μg/mL이었다. n-Hexane 분획물은 IC50값이 500 μg/mL보다 높았고, H2O 분획물은 IC50값이 337.5±18.7 μg/mL로 n-hexane 분획물과 H2O 분획물은 비교적 낮은 α-glucosidase 저해활성을 나타내었다. 복숭아 나뭇가지 n-BuOH 분획물의 IC50값은 47.0± 0.8 μg/mL를 나타내었으며, EtOAc 분획물의 IC50값은 38.2±1.6 μg/mL로 상대적으로 우수한 α-glucosidase 저해활성을 나타내었다. 복숭아 나뭇가지 열수 추출물 및 분획물의 α-amylase 저해활성 평가 결과에서도 n-hexane 및 H2O 분획물은 상대적으로 낮은 활성을 나타내었으며, EtOAc 분획물의 IC50값이 69.6±6.1 μg/mL로 가장 우수한 α-amylase 저해활성을 나타내었다. 이전 연구에서 서양자두(Prunus domestica) 추출물에서 우수한 α-glucosidase 저해활성이 나타났으며, 활성을 나타내는 신규 homoisoflanone 유도체의 구조가 동정되었고(Kosar 등, 2009), 아몬드(Prunus amygdalus) 추출물에서 강한 α-amylase 저해능이 연구 및 보고되었다(Attaallah 등, 2021). 본 연구에서는 복숭아 나뭇가지에 대한 항당뇨 평가 중 α-glucosidase 및 α-amylase 저해활성 평가를 수행하였으며, 복숭아 나뭇가지 열수 추출물의 분획물 중 EtOAc 분획물에서 가장 우수한 소화효소 저해능을 확인할 수 있었다.
Table 4.
Inhibitory effects of fraction extracts from P. persica twigs and its solvent-soluble portions against α-glucosidase
| Samples |
Inhibition activity (%) |
IC50 values (μg/mL) |
| 500 μg/mL |
250 μg/mL |
125 μg/mL |
62.5 μg/mL |
31.3 μg/mL |
| Hot water |
81.9±0.122)c3) |
81.4±0.17c |
61.0±0.16c |
34.9±0.15c |
19.0±0.14c |
97.0±9.8c |
| n-Hexane layer |
24.7±0.16e |
14.8±0.14f |
8.3±0.16f |
4.4±0.17f |
1.0±0.12f |
>500 |
| EtOAc layer |
99.3±0.17a |
95.2±0.13b |
85.5±0.14a |
64.6±0.18a |
42.7±0.16a |
38.2±1.6e |
| n-BuOH layer |
99.1±0.16a |
96.1±0.14a |
84.1±0.13b |
61.3±0.12b |
35.1±0.18b |
47.0±0.8d |
| H2O layer |
60.4±0.18d |
44.2±0.12e |
24.6±0.14e |
13.1±0.16e |
10.2±0.16e |
337.5±18.7a |
| Acarbose1) |
91.9±0.16b |
70.1±0.16d |
49.5±0.13d |
30.4±0.18d |
16.4±0.14d |
122.2±7.6b |
Download Excel Table
Table 5.
Inhibitory properties of fraction extracts from P. persica twigs and its solvent-soluble portions against α-amylase
| Samples |
Inhibition activity (%) |
IC50 values (μg/mL) |
| 500 μg/mL |
250 μg/mL |
125 μg/mL |
62.5 μg/mL |
31.3 μg/mL |
| Hot water |
78.7±0.162)d3) |
62.3±0.15d |
43.6±0.12d |
26.5±0.13d |
9.4±0.15e |
163.9±7.4b |
| n-Hexane layer |
-4) |
- |
- |
- |
- |
>500 |
| EtOAc layer |
90.2±0.12b |
81.9±0.12b |
59.6±0.15b |
50.3±0.16b |
31.2±0.16b |
69.6±6.1d |
| n-BuOH layer |
84.8±0.15c |
74.3±0.16c |
59.2±0.16c |
41.5±0.12c |
26.9±0.13c |
88.8±0.9c |
| H2O layer |
71.0±0.13e |
55.9±0.17e |
37.0±0.13e |
18.9±0.14e |
14.5±0.12d |
213.3±11.3a |
| Acarbose1) |
99.9±0.18a |
95.8±0.16a |
92.4±0.13a |
62.0±0.12a |
32.6±0.14a |
46.7±2.1e |
Download Excel Table
Acknowledgements
This research was supported (in part) by the Daegu University, 2021.
References
Anagnostopoulou MA, Kefalas P, Papageorgiou VP, Assimopoulou AN, Boskou D. Radical scavenging activity of various extracts and fractions of sweet orange peel (
Citrus sinensis). Food Chem, 94, 19-25 (2006)


Attaallah R, Elfadil D, Amine A. Screening study of enzymatic inhibition of medicinal plant for the treatment of diabetes using a glucometer biosensor approach and optical method. J Herb Med, 28, 100441 (2021)


Bento C, Goncaves AC, Silva B, Silva LR. Peach (
Prunus persica): Phytochemicals and health benefits. Food Rev Int, 38, 1703-1734 (2022)


Blois MS. Antioxidant determinations by the use of a stable free radical. Nature, 181, 1199-1200 (1958)


Choi Y, Kim M, Shin JJ, Park JM, Lee J. The antioxidant activities of the some commercial teas. J Korean Soc Food Sci Nutr, 32, 723-727 (2003)


Farag RS, Badei AZMA, Hewedi FM, EI Baroty GSA. Antioxidant activity of some spice essential oils on linoleic acid oxidation in aqueous media. J Am Oil Chem Soc, 66, 792-799 (1989)


Fukuda T, Ito H, Mukainaka T, Tokuda H, Nishino H, Yoshida T. Anti-tumor promoting effect of glycosides from
Prunus persica seeds. Biol Pharm Bull, 26, 271-273 (2003)



Gao X, Bjor L, Trajkovski V, Uggla M. Evaluation of antioxidant activities of rosehip ethanol extracts in different test system. J Sci Food Agr, 80, 2021-2027 (2000)


Jeong KH, Ji YS, Kil KJ, Yoo JH. Antioxidant effects of ethanol extracts from different parts of
Portulacae herba. Kor J Herbol, 34, 59-65 (2019)

Joo SY. Comparison of
Prunus yedoensis Matsumura bark ethanol extract and solvent fraction antioxidant activities. Korean J Food Sci Technol, 52, 350-356 (2020)

Kawamura-Konishi Y, Watanabe N, Saito M, Nakajima N, Sakaki T, Katayama T, Enomoto T. Isolation of a new phlorotannin a potent inhibitor of carbohydrate-hydrolyzing enzymes from the brown alga
Sargassum patens. J Agr Food Chem, 6, 5565-5570 (2012)



Kim TH. A novel
α-glucosidase inhibitory constituent from
Uncaria gambir. J Nat Med, 70, 811-815 (2016)



Kosar S, Fatima I, Mahmood A, Ahmed R, Malik A, Talib S, Chouhdary M. Purunusides A-C,
α-glucosidase inhibitory homoisoflavone glucosides from
Prunus domestica. Arch Pharm Res, 32, 1705-1710 (2009)



Lee YR, Yoon N. Anti-oxidative and anti-diabetic effects of methanol extracts from medicainal plants. J Korean Soc Food Sci Nutr, 44, 681-686 (2015)


Matsuda H, Morikawa T, Ishiwada T, Managi H, Kagawa M, Higashi Y, Yoshikawa M. Medical flowers VIII radical scavenging constituents from the flowers of
Prunus mume: Structure of prunose III. Chem Pharm Bull, 51, 440-443 (2003)



Mokrani A, Madani K. Effect of solvent time and temperature on the extraction of phenolic compounds and antioxidant capacity of peach (
Prunus persica L.) fruit. Sep Purif Technol, 162, 68-76 (2016)


Nakagawa T, Allam A, Ohnuki K, Shimizu K. Biological activities of extracts from different parts of two cultivars of
Prunus persica ‘Akatsuki’ and ‘Fastigiata’. Nat Prod Commun, 13, 1293-1296 (2018)


Sang S, Lapsley K, Jeong WS, Lachance PA, Ho CT, Rosen RT. Antioxidative phenolic compounds isolated from almond skins (
Prunus amygdalus Batsch). J Agr Food Chem, 50, 2459-2463 (2002)



Song W, Qin ST, Fang FX, Gao ZJ, Liang DD, Liu LL, Tian HT, Yang HB. Isolation and purification of condensed tannin from the leaves and twings of
Prunus ceraifera and its structure and bioactivites. Appl Biochem Biotech, 185, 464-475 (2018)



Tsujimoto T, Shioyama E, Moriya K, Kawaratani H, Shirai Y, Toyohara M, Mitoro A, Yamao J, Fujii H, Fukui H. Pneumatosis cystoides intestinalis following alpha-glucosidase inhibitor treatment: A case report and review of the literature. World J Gastroenterol, 14, 6087-6092 (2008)




Velioglu YS, Mazza G, Gao L, Oomah BD. Antioxidant activity and total phenolics in selected fruits, vegetables and grain products. J Agr Food Chem, 46, 4113-4117 (1998)