Research Article
양송이버섯 생산 환경의 미생물 안전성 및 오염원 분석
김진희1,2,3
,
최송이1
,
황인준1
,
현정은1
,
김선애4
,
반가희4
,
김세리1,*
Evaluation of microbial safety and cross-contamination sources in button mushroom (Agaricus bisporus) production
Jin-Hee Kim1,2,3
,
Song Yi Choi1
,
In Jun Hwang1
,
Jeong Eun Hyun1
,
Sun Ae Kim4
,
Ga-Hee Ban4
,
Se-Ri Kim1,*
Author Information & Copyright ▼
1농촌진흥청 국립농업과학원 농산물안전성부 유해생물과
1Microbial Safety Team, Agro-Food Safety & Crop Protection Department, NAS, RDA, Wanju 55365, Korea
2Department of Food and Nutrition, Mokpo National University, Muan 58554, Korea
3Research Institute of Human Ecology, Mokpo National University, Muan 58554, Korea
4Department of Food Science and Biotechnology, Ewha Womans University, Seoul 03760, Korea
*Corresponding author Se-Ri Kim, Tel: +82-63-238-3395, E-mail:
seri81@korea.kr
Citation: Kim JH, Choi SY, Hwang IJ, Hyun JE, Kim SA, Ban GH, Kim SR. Evaluation of microbial safety and cross-contamination sources in button mushroom (Agaricus bisporus) production. Korean J Food Preserv, 29(7), 1079-1090 (2022)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 05, 2022; Revised: Nov 29, 2022; Accepted: Dec 06, 2022
Published Online: Dec 31, 2022
4. 요약
본 연구는 양송이버섯 재배에서부터 수확 후 단계까지 미생물의 오염 경로를 파악하기 위해 수행하였다. 본 연구를 위하여 양송이버섯과 직접 접촉하는 시료 234점을 수집하여 위생지표세균와 병원성미생물을 조사하였으며, 분리된 E. coli 를 대상으로 MLST를 분석하여 오염경로를 분석하였다. 그 결과, 배지 퇴비화 과정을 거친 후에도 일반세균 수는 유의적으로 감소하지 않고 7.30±0.47 log CFU/g 수준을 유지한 반면, coliform과 E. coli 는 퇴비화 및 살균 과정을 거치면서 검출 한계 이하로 감소하였다. 한편, 버섯의 발생을 유도하고 지지하기 위하여 배지 위에 첨가하는 흙이나 이끼와 같은 복토용 재료에서 일반세균; 6 log CFU/g, coliform; 3 log CFU/g을 초과하였다. 또한, 수확 및 포장단계에서는 세 농가의 작업자 장갑, 복토 및 뿌리채 뽑은 양송이버섯에서 E. coli 가 분리되었다. 분리된 68 균주의 E. coli 의 MLST 분석 결과, 수확한 양송이버섯에서 검출된 E. coli 의 유전자 패턴이 복토층에서 분리된 E. coli 가 동일한 것으로 나타나, 양송이버섯의 미생물 안전성에 가장 영향을 끼치는 것은 복토로 추정된다. 따라서 양송이버섯의 안전성을 향상시키기 위해서는 복토 살균과 개인위생관리, 생산시설 위생관리 등의 도입과 실천이 필요할 것으로 사료된다.
Abstract
This study aimed to investigate the contamination sources of button mushrooms by assessing the microbial load on the mushrooms and in the agricultural inputs that come into contact with the mushroom. A total of 234 samples including mushrooms, compost, casing soil, and tools from A, B, C, and D farms were tested for sanitary indicators (aerobic bacteria, coliforms, and Escherichia coli) and foodborne pathogens (E. coli O157:H7, Salmonella spp., Staphylococcus aureus, and Listeria monocytogenes). To identify the contamination source, E. coli was isolated and analyzed using MLST (Multi-Locus Sequence Typing). The number of aerobic bacteria remained consistent during composting (⟩7 log CFU/g); however, the occurrence of coliforms and E. coli was reduced to the detection limit (⟨1.0 log). Salmonella spp. and L. monocytogenes were detected in the raw material; however, they were inactivated during composing. More than 6.0 log of aerobic bacteria and 3.0 log of coliforms were observed in the casing soil from A, B, and C farms and in the gloves from the C farm. MLST indicated that the STs of E. coli isolated from casing soil layer and from the harvested mushrooms were identical at ST 189. Therefore, cross contamination occurred through the casing soil layer, and this could contribute to E. coli contamination in mushrooms. It is necessary to practice hygiene guidelines, such as sterilization of casing soil, worker hygiene, and facility sanitation, to minimize the potential of microbial contamination in mushrooms.
Keywords: button mushroom; production environment; microbial safety; cross-contamination
1. 서론
버섯은 조섬유, 단백질, 비타민, 미네랄이 풍부한 고품질의 영양 식품이다(Thakur, 2020). 그중 양송이버섯은 세계에서 가장 많이 재배되고 있는 버섯으로 국내 시장뿐만 아니라, 세계적으로 소비가 증가하고 있다(Valverde 등, 2015). 하지만 버섯에서 식중독세균이 검출됨에 따라 버섯의 안전관리에 대한 우려가 증대되고 있다. 국내 유통 중 신선편이 농산물의 오염도를 조사한 보고에 따르면 버섯에서 Staphylococcus aureus와 Bacillus cereus가 검출되었다고 보고되었고(Jeon 등, 2020), 2020년에는 국내에서 생산한 수출 팽이버섯에서 L. monocytogenes가 검출되어 리콜된 사례가 발생한 바 있어 버섯의 안전관리가 필요한 실정이다(CDC, 2020). 버섯은 수확 후 부패하기 쉽고 품질이 빠르게 저하되며, 저장기간이 3-8일로 짧다(Marçal 등, 2013). 또한, 버섯의 큐티클층이나 왁스층과 같은 보호막 구조는 타 작물에 비하여 약하고, 조직의 수분함량과 호흡률이 높아 병원성미생물에 쉽게 오염될 수 있다고 보고되고 있다(Qin 등, 2015, Venturini 등, 2011). 하지만 일반적인 세척 과정을 통해 버섯에 오염된 세균을 완전히 제거할 수 없어(Ding 등, 2011), 소비자에게 안전한 버섯을 공급하기 위해서는 버섯 생산단계부터 미생물 오염을 예방하는 것이 중요하다.
양송이버섯은 타 버섯과 달리 배지를 만드는 데 계분을 사용하는 것이 가장 큰 특징이다. 계분에는 Salmonella spp. 등 식중독세균이 오염되어 있다는 보고가 있어 충분한 발효 과정이 이루어지지 않으면 버섯의 안전성에 영향을 미칠 수 있다(Akram과 Kwon, 2010). 또한, 미생물안전성이 확보되지 않은 복토의 사용과 수확 및 수확 후 처리과정의 위생관리의 미흡으로 인하여 버섯이 식중독세균에 오염될 가능성이 높다. 따라서 양송이버섯 생산과정의 미생물학적 안전성을 평가하고, 오염원을 조사하여 사전에 관리하는 것이 중요하다.
또한, 최근에는 농산물의 유해미생물 오염 경로를 구명하는 데 multi-locus sequence typing(MLST)을 이용한 유전자 typing법을 활용하고 있다(Frosth 등, 2020). MLST는 6-7개의 house-keeping gene의 염기서열을 비교하여 세균종을 특성화하는 기술이다. 이 기술은 house-keeping gene의 절편(450-500 bp)을 PCR로 증폭한 후, sanger sequencing을 통해 염기서열을 확인한 다음 각 loci의 염기서열의 비교를 통하여 allele number를 설정하고, 7개의 allele number를 조합하여 sequence type을 결정하는 방식이다. 같은 sequence type을 가질 경우, 서로 연관성이 높은 균주라는 점을 이용하여 오염경로를 추적하는 데 활용된다. Feng 등(2015)은 MLST 분석을 통해 키위 농장과 주변 환경과의 연관성을 보고하였다(Feng 등, 2015). Nakamura 등(2021)은 MLST 분석을 통해 식품제조공장에서 최종 제품에서 검출된 E. coli의 오염원을 추적 가능하며, 위생 관리를 위해 사용될 수 있다고 보고하였다(Nakamura 등, 2021). 또한, Véghová 등(2017)이 수행한 연구에서 MLST 분석으로 육류 가공시설의 오염 경로를 확인하였다(Véghová 등, 2017).
따라서 본 연구는 안전한 양송이버섯 생산을 위한 위생관리지침마련에 필요한 기초자료를 수집하고, 미생물의 오염 경로를 구명하기 위해 양송이버섯의 재배에서부터 수확 후 단계에서 양송이버섯과 직접 접촉하는 시료를 대상으로 미생물 오염도를 조사하고, MLST법을 이용하여 E. coli의 오염 경로를 조사하였으며, 그 결과를 보고하고자 한다.
2. 재료 및 방법
2.1. 시료 채취 및 전처리
본 연구는 2021년 5월부터 10월까지 양송이버섯 생산농가 4개소(A, B, C, D)를 대상으로 미생물 오염도와 경로를 조사하였다(Table 1). A, B, C 농가는 양송이버섯 재배에 사용되는 배지를 퇴비화 과정을 거쳐 직접 생산하는 농가였으며, D 농가는 양송이버섯용 배지를 배지 제조시설에서 구입하여 구입한 배지에 종균을 접종하여 버섯을 생산하는 농가였다. 또한, A, B 농가는 배지를 퇴비화할 때 공기를 주입하지 않고, C 농가는 배지 퇴비화 시 공기를 주입하는 농가였다. D 농가에서 사용한 배지 또한 공기 주입 시설이 있는 배지 제조 시설에서 구입한 배지를 사용하였으며, D 농가의 배지를 제조하는 시설에서 배지 퇴비화 과정 중 미생물 변화를 조사하기 위하여 퇴비화 단계별 시료를 공급받아 본 연구에 사용하였다.
Table 1.
Number of collected samples by button mushroom production stages, sample type, and farms
| Production stages |
Sample type |
n |
Farms |
| A |
B |
C |
D |
| Raw materials (n=33) |
|
|
Rice straw |
6 |
3 |
- |
- |
3 |
|
|
Wheat straw |
6 |
3 |
- |
- |
3 |
|
|
Heaped rice straw |
3 |
- |
3 |
- |
- |
|
|
Heaped wheat straw |
3 |
- |
- |
3 |
- |
|
|
Chicken manure |
12 |
3 |
3 |
3 |
3 |
|
|
Liquid fertilizer |
3 |
- |
- |
3 |
- |
|
|
Subtotal |
33 |
9 |
6 |
9 |
9 |
| Composting with pasteurization (n=72) |
|
|
Compost stack |
12 |
3 |
3 |
3 |
3 |
|
|
1st turned compost |
12 |
3 |
3 |
3 |
3 |
|
|
2nd turned compost |
12 |
3 |
3 |
3 |
3 |
|
|
3rd turned compost |
12 |
3 |
3 |
3 |
3 |
|
|
4th turned compost |
12 |
3 |
3 |
3 |
3 |
|
|
Pasteurized compost |
12 |
3 |
3 |
3 |
3 |
|
|
Subtotal |
72 |
18 |
18 |
18 |
18 |
| Fruiting (n=33) |
|
|
Spawn |
9 |
- |
3 |
3 |
3 |
|
|
Colonized bed |
12 |
3 |
3 |
3 |
3 |
|
|
Casing soil |
12 |
3 |
3 |
3 |
3 |
|
|
Subtotal |
33 |
6 |
9 |
9 |
9 |
| Harvesting (n=60) |
|
|
Casing soil layer |
12 |
3 |
3 |
3 |
3 |
|
|
Harvested mushroom |
12 |
3 |
3 |
3 |
3 |
|
|
Knife |
12 |
3 |
3 |
3 |
3 |
|
|
Basket |
12 |
3 |
3 |
3 |
3 |
|
|
Gloves |
12 |
3 |
3 |
3 |
3 |
|
|
Subtotal |
60 |
15 |
15 |
15 |
15 |
| Packaging (n=36) |
|
|
Bench |
12 |
3 |
3 |
3 |
3 |
|
|
Scale |
12 |
3 |
3 |
3 |
3 |
|
|
Packaged mushrooms |
12 |
3 |
3 |
3 |
3 |
|
|
Subtotal |
36 |
9 |
9 |
9 |
9 |
| Total (n=234) |
|
|
57 |
57 |
60 |
60 |
Download Excel Table
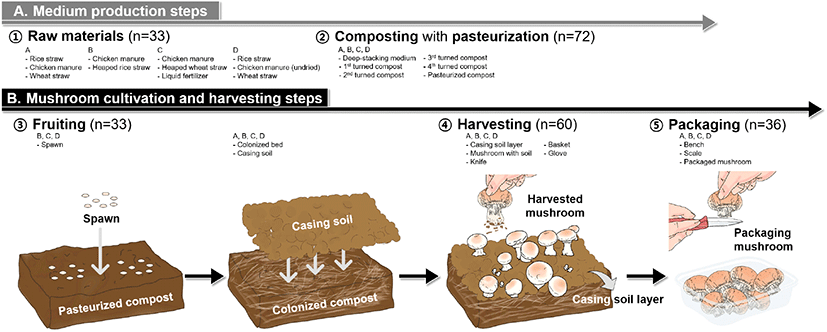
양송이버섯은 Fig. 1과 같이 생산된다. 본 연구에서는 양송이버섯 생산과정을 볏짚 또는 밀짚 등의 발효를 통한 퇴비화(composting), 균사 배양(colonization), 복토(casing soil) 덮기, 발이(fruiting), 양송이버섯 수확(harvesting) 및 포장(packaging)의 다섯 단계로 구분하였다. 본 연구에 사용된 시료는 다음의 과정에서 채취되었다. 양송이버섯은 특수 제조된 배지를 이용해 생산되는데, 그 배지는 볏짚(rice straw), 생계분(undried chicken manure), 계분(chicken manure), 밀짚(wheat straw), 가적 밀짚(heaped wheat straw) 및 볏짚(heaped rice straw), 액비(liquid fertilizer) 등을 각 농가의 제조 방법에 따라 혼합하여 쌓아 두고, 이 혼합 배지(deep-stacking medium)의 온도가 자연 발효를 통해 60°C-85°C까지 상승할 때, 지속적인 호기성 발효를 돕고 공기를 주입할 목적으로 배지를 뒤집었다(1st-4th turned compost). 이후 발효의 마무리 단계로 정열 과정(60°C 살균)을 거쳐 배지를 저온살균했다. 버섯의 발이는 이 살균된 배지(pasteurized compost)에 버섯 종균(spawn)을 접종하고 균사를 피운 뒤, 균사가 핀 배지(colonized bed)에 식양토, 코코피트, 피트모스 등으로 구성된 복토(casing soil)를 덮어 버섯의 자실체 형성을 촉진에 의해 이루어진다. 본 연구에는 버섯과 복토와의 연관성을 면밀히 분석하기 위해 복토를 뚫고 발이된 버섯을 수확한 것(harvested mushroom)과 선별 포장된 버섯(packaged mushroom)을 모두 채취하였다. 또한, 수확 및 포장 과정에서 버섯과 접촉되는 복토층(casing soil layer), 장갑(glove), 바구니(basket), 칼(knife), 작업대(bench), 저울(scale) 또한 본 연구를 위해 채취하여 시료로 사용하였다(Fig. 1).
Fig. 1.
A schematic model of mushroom cultivation.
The button mushroom cultivation consists of medium production (composting), mushroom production, and harvesting stages.
Download Original Figure
각 시료의 채취 방법은 다음과 같다. 약 200 g의 원료(밀짚, 볏짚, 계분), 배지, 종균, 복토 및 버섯을 멸균팩에 채취하였다. 작업자의 장갑은 양송이버섯을 수확하는 작업자를 대상으로 채취하였으며, 장갑을 시료채취용 멸균팩에 넣고 무게의 9배에 해당하는 0.85% 생리식염수를 가하여 30초간 문질러 채취하였다. 양송이버섯의 수확 및 포장과정에서 칼, 바구니, 작업대, 저울 등 평판 시료는 100 cm2의 면적을 면봉으로 문질러 채취하였다. 채취된 시료는 아이스박스에 담아 실험실까지 운반한 후 24시간 내에 분석하였다. 수집된 시료는 위생지표세균(total aerobic bacteria, total coliforms, Escherichia coli)과 식중독 세균(E. coli O157:H7, Listeriamonocytogenes, Salmonella spp., Staphylococcus aureus)의 분석을 위해 사용되었다.
2.2. 위생지표세균의 측정
위생지표세균의 측정을 위해 볏짚, 생계분, 계분, 밀짚, 가적밀짚, 가적볏짚, 액비, 본퇴적배지, 1-4차 뒤집기 한 배지, 살균된 배지, 종균, 균사 핀 배지, 복토, 복토층, 수확한 버섯 및 포장된 버섯을 포함하는 시료를 각각 25 g을 취해 0.85% 멸균 생리식염수 225 mL를 첨가하여 균질화하였다. Swab법으로 채취된 시료는 30초간 vortex한 후 사용하였다. 균질화된 시료는 단계 희석하여 petrifilm에 각 희석농도별로 1 mL씩 분주하였다. 일반세균 측정에는 PetrifilmTM aerobic count plate(PCA, 3M Center, St. Paul, MN, USA)를, coliform 및 E. coli 의 측정에는 PetrifilmTME. coli/coliform count plate(3M Center)를 37°C, 24시간 배양하여 측정하였다. 각 plate의 양성 집락은 제조사의 기준으로 판별하였다. 미생물 균수는 log colony forming unit(CFU/g)으로 나타냈다. 또한, E. coli 의 정성 분석을 위해 각 시료를 25 g 취해 멸균된 buffered peptone water(BPW; Difco, Sparks, MD, pH 7.2)에서 증균시킨 후, EC broth(Oxoid, Basingstoke, Hampshire, UK)에서 재 증균하여 가스를 생성한 양성 의심 시료에 한해서 EMB agar(Oxoid, UK)에 도말하여 금속 광택을 나타내는 집락을 VITEK(VITEK-2 compact, Biomerieux, France)을 이용해 최종 동정하였다.
2.3. 병원성 미생물 분리 및 동정
병원성 미생물은 E. coli O157:H7, L. monocytogenes, Salmonella spp., S. aureus를 정성분석하였으며 실험은 식품공전법에 준하여 분석하였고, 구체적인 방법은 다음과 같다.
E. coli O157:H7을 분석하기 위해 각 시료를 25 g 취해 멸균된 BPW(Difco)에서 1차 증균, mEC broth(Oxoid) 에서 2차 증균하여 가스를 생성한 양성 의심 시료에 한해서 CHROMagarTM O157(CHROMagar, Paris, France)에 도말하여 양성으로 의심되는 집락을 PowerCheckTME. coli O157:H7 Detection Kit(Power Check PCR kit, Kogen, Korea)를 이용하여 PCR로 1차 확인 후 VITEK (Biomerieux)을 이용해 최종 동정하였다. L. monocytogenes는 Listeria enrichment broth(Oxoid)에서 1차 증균, Frasher broth(Difco)에서 2차 증균 후 Palcam(Oxoid) 배지에서 분리하였다. 분리된 Listeria spp.를 CHROMagarTMListeria(CHROMagar)에 도말하여 양성으로 의심되는 집락을 VITEK(Biomerieux) 기기를 이용하여 1차 확인한 후 PowerCheckTMListeria monocytogenes Detection Kit(Power Check PCR kit, Kogen, Korea)로 최종 동정하였다. Salmonella spp.는 BPW(Difco)에서 1차 증균, Rappaport Vassiliadis R10 Broth(Difco), Tetrathionate Broth(Difco)에서 각각 2차 증균하여 xylose-lysine-tergitol 4(Difco)에 도말하여 양성으로 의심되는 집락을 VITEK(Biomerieux) 기기와 PowerCheckTMSalmonella spp. Detection Kit(Power Check PCR kit, Kogen, Korea)로 최종 동정하였다. S. aureus는 BPW(Difco)에서 1차 증균, 10% NaCl이 첨가된 tryptone soya broth (Oxoid)에서 2차 증균 후 CHROMagarTMStaph aureus (CHROMagar)에 도말하여 양성으로 의심되는 집락을 VITEK(Biomerieux)을 이용해 최종 동정하였다.
2.4. Multi-locus sequence typing(MLST) 분석
분리된 68개의 E. coli 균주에 대해 Solgent사(Daejeon, Korea)에 multi-locus sequence typing(MLST) 분석을 의뢰하여 진행하였다. 7개의 housekeeping gene(adk, fumC, gyrB, icd, mdh, purA, recA)에 대한 염기서열 분석 결과는 MLST database에 입력하여 allelic number와 ST를 확인하였다. 이 결과를 바탕으로 UPGMA(unweighted pair group of arithmetic means) tree를 작성하고, 유전자형 간의 유전적 관계를 평가하였다.
2.5. 통계 분석
모든 실험은 3개의 독립적인 샘플에 대해 3반복으로 수행되었으며, 결과를 평균±표준편차로 나타내었다. 실험 결과는 통계처리 프로그램(SPSS version 27; SPSS Inc., Chicago, IL, USA)의 Duncan’s multiple range test를 이용하여 p⟨0.05 수준에서 유의적 차이를 검증하였다.
3. 결과 및 고찰
3.1. 배지 퇴비화 과정 중 미생물 변화
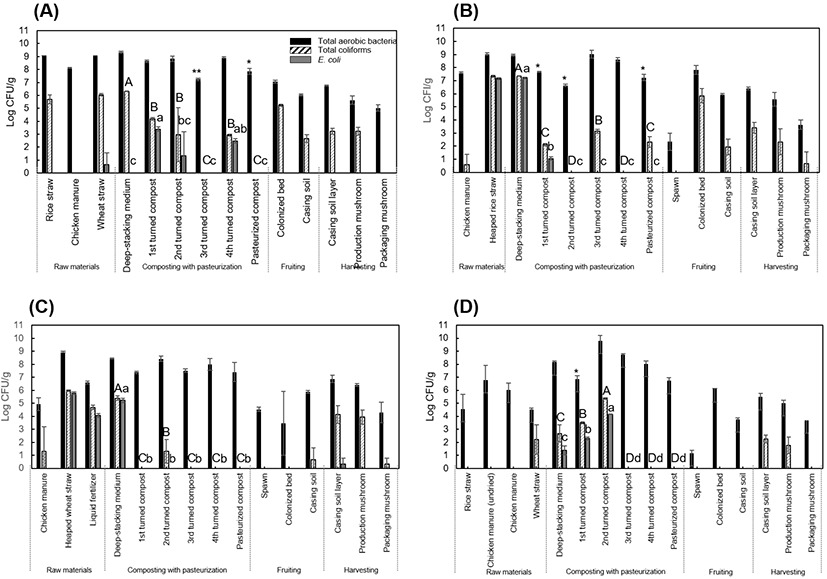
Fig. 2는 4곳의 농가에서 양송이버섯 배지 퇴비화 과정 중 수집한 시료에 대한 위생지표세균(total aerobic bacteria, coliform, Escherichia coli)의 변화를 조사한 결과이다. 퇴비화 과정에서 80°C 이상의 고열이 발생하기 때문에 1-4차 뒤집기 한 배지 및 살균된 배지에서 일반세균 수가 감소될 것으로 추정하였으나, 약 7 log CFU/g 이상을 유지하였다. 4회차 뒤집기 한 배지의 일반세균 수는 공기주입 여부에 따라 A, B와 C, D의 유의적인 차이가 있었다(p⟨0.05). 그러나 그 차이는 0.76 log CFU/g 수준이었고, 정열(퇴비화 후 버섯 재배사에서 버섯 배지를 60°C의 증기를 이용하여 4시간 이상 살균처리) 처리 후 4곳의 일반세균 수는 모두 유의적인 차이가 없었다(p⟩0.05). 또한, coliform과 E. coli 의 경우, 공기주입 과정이 없는 A, B 농가에서는 3차 뒤집기 배지부터 살균 배지에 이르기까지, coliform 또는 E. coli 가 지속적으로 검출되었다(Fig. 2). 하지만 공기주입 시설이 있는 C, D 농가는 3차 뒤집기 배지에서 coliform 및 E. coli 가 모두 검출 한계 이하로 감소되어 검출되지 않았다.
Fig. 2.
The number of indicator bacteria samples collected from each production process of 4 button mushroom farms.
* Different capital letters indicate significant differences (p⟨0.05) of coliform at composting with pasteurization step; different lower case letters show significant differences (p⟨0.05) of E. coli at composting with pasteurization step.
Download Original Figure
Table 2는 A, B, C, D 농가에서 채취한 각 시료에서 E. coli, L. monocytogenes, Salmonella spp., S. aureus의 정성 평가결과이다. 퇴비화 과정 중 공기 주입이 없는 A, B 농가의 경우 4차 뒤집기 배지에서 E. coli가 검출된 데 반해, 공기주입이 있는 C, D 농가의 4차 뒤집기 배지에서는 E. coli 가 검출되지 않아 공기주입 시설이 없는 농가보다 공기주입 시설이 있는 농가가 효율적으로 E. coli 를 사멸시키는 것으로 나타났다. 또한, 배지의 저온 살균과정에서 coliform과 E. coli 는 공기주입 여부와 관계없이 B 농가의 coliform을 제외하고 검출한계 이하로 감소하였다.
Table 2.
Detection of E. coli, L. monocytogenes, Salmonella spp., and S. aureus in samples collected from each production process of button mushroom in farm A, B, C and D. Salmonella spp. was detected in the deep-stacking medium (Farm C, D), 1st and 2nd turned compost (Farm D). Salmonella spp. was negative in the other samples. S. aureus was negative in all samples
| Production stages |
Farm A |
Farm B |
Farm C |
Farm D |
| Sample type |
E. coli
|
L. monocytogenes
|
E. coli
|
L. monocytogenes
|
E. coli
|
L. monocytogenes
|
E. coli
|
L. monocytogenes
|
| Raw materials |
| Rice straw |
+1)(3/3) |
+(2/3) |
-2) |
- |
-2) |
- |
ND |
ND |
| Chicken manure |
ND |
ND |
+(1/3) |
ND |
+1)(3/3) |
ND |
ND |
ND |
| Chicken manure (undried) |
- |
- |
- |
- |
- |
- |
ND |
ND |
| Wheat straw |
+(3/3) |
+(2/3) |
- |
- |
- |
- |
+(2/3) |
ND |
| Heaped wheat straw |
- |
- |
- |
- |
+(3/3) |
+(2/3) |
- |
- |
| Heaped rice straw |
- |
- |
ND |
ND |
- |
- |
- |
- |
| Liquid fertilizer |
- |
- |
- |
- |
+(3/3) |
+(2/3) |
- |
- |
| Composting |
| Deep-stacking medium |
+(3/3) |
+(2/3) |
+(3/3) |
ND |
+(2/3) |
+(2/3) |
+(3/3) |
ND |
| 1st turned compost |
+(3/3) |
+(2/3) |
+(3/3) |
ND |
ND |
ND |
+(3/3) |
ND |
| 2nd turned compost |
ND |
+(2/3) |
ND |
ND |
ND |
ND |
ND |
ND |
| 3rd turned compost |
+(3/3) |
ND |
ND |
ND |
ND |
ND |
+(1/3) |
ND |
| 4th turned compost |
+(3/3) |
ND |
+(3/3) |
ND |
ND |
ND |
ND |
ND |
| Pasteurization |
| Pasteurized compost |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| Fruiting |
| Spawn |
- |
- |
ND |
ND |
ND |
ND |
ND |
ND |
| Colonized bed |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| Casing soil |
ND |
ND |
ND |
ND |
ND |
ND |
+(2/3) |
ND |
| Harvesting |
| Casing soil layer |
+(2/3) |
ND |
ND |
ND |
+(1/3) |
ND |
+(1/3) |
ND |
| Harvested mushroom |
+(1/3) |
ND |
ND |
ND |
+(2/3) |
ND |
ND |
ND |
| Knife |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| Basket |
ND |
ND |
- |
- |
ND |
ND |
ND |
ND |
| Glove |
+(2/3) |
ND |
ND |
ND |
+(3/3) |
ND |
+(1/3) |
ND |
| Packaging |
| Bench |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
ND |
| Scale |
- |
- |
ND |
ND |
- |
ND |
ND |
ND |
| Packaged mushroom |
ND |
ND |
ND |
|
ND |
ND |
ND |
ND |
Download Excel Table
또한, 배지 원료에서는 Salmonella spp.의 경우 C, D 농가의 혼합배지와 D 농가의 1차 뒤집기 한 배지에서 검출되었다(data not shown). L. monocytogenes는 A 농가의 배지 원료(볏짚, 밀짚), 혼합배지, 1차, 2차 뒤집기 배지, C 농가의 가적 밀짚, 액비, 혼합배지에서 검출되었으나, 퇴비화 과정을 마친 최종 배지에서는 병원성 미생물(E. coli O157:H7, S. aureus, Salmonella spp., L. monocytogenes) 모두 검출되지 않았다(Table 2).
이상의 결과를 종합해 보면 퇴비화 과정 중에 일반세균 수는 유지가 되고, coliform, E. coli, Salmonella spp.와 L. monocytogenes는 감소되거나 검출되지 않았는데, 그 이유는 발효 과정 중 온도가 상승함에 따라 고온성 세균의 밀도가 증가하고, 병원성 미생물은 사멸되기 때문으로 추정된다. Meng 등(2020)의 결과에 따르면 퇴비의 호기성 발효 시 온도 상승으로 인해 활성 퇴비에서 Limnochordaceae과에 속하는 호열성 및 통성 혐기성 세균이 우세하게 증가한다고 보고하였다. 또한, Chandna 등(2013), Lee 등(2017)이 보고한 결과에 따르면 퇴비화 과정에서 발생된 열에 의해 살균 배지의 모든 병원성 미생물이 제거되었다고 보고하였다. 따라서 퇴비화 과정의 공기주입 여부가 일반세균 총량에 영향을 미치지 않지만, 미생물 군집의 구성을 변화시켜 위해 세균이 사멸되는 방향으로 발효가 진행된 것으로 판단된다.
3.2. 재배 및 수확 과정 중 미생물 변화
버섯의 재배 및 수확 단계 중 수집된 시료에서 위생지표세균의 정량적 변화를 Fig. 2에, E. coli 및 병원성 미생물의 정성 결과는 Table 2에 나타냈다. 먼저 재배 및 수확 단계에서 일반세균, coliform, E. coli 의 변화를 보면 일반세균 수는 종균에서 1-4 log 범위의 상이한 수준을 나타냈고, 균사 핀 배지와 복토는 정열과정을 거쳐 살균된 배지와 유사한 수준이었다. 그러나 coliform에서 공기주입 설비 여부에 따라 차이를 나타냈다. 공기주입 설비가 없는 A, B 농가의 coliform은 종균이 균사 핀 배지에서 다시 5 log CFU/g 이상 검출되었다. 종균을 접종 후 균사를 피우기까지 최소 15일 이상 배양하기 때문에 저온 살균과정에서 충분히 감소되지 못한 미생물이 균사 핀 배지에서 검출될 가능성이 크다. 그러나 공기 주입 시설이 있는 C, D 농가의 균사 핀 배지에서 coliform이 검출되지 않은 것으로 보아 공기 주입 시설이 coliform을 효과적으로 사멸시키는 것으로 판단된다. 이상의 결과로 볼 때 퇴비화 단계의 공기주입 시설이 퇴비화 과정 이후 재배 단계의 오염수준에도 영향을 미치는 것으로 판단된다. Meng 등(2018)의 연구에 따르면 퇴비화가 진행되면서 중온성에서 고온성 균으로 구성이 변화하며 대장균 등 병원성 균이 포함된 Proteobacteria의 비율이 급격히 감소한다고 보고하였다.
복토는 자실체를 형성시키고 버섯을 지지하며 버섯의 양분 및 수분을 공급할 목적으로 균사가 핀 배지 위에 흙이나 피트모스를 덮는 과정을 말하는데, 복토과정에 사용되는 흙과 피트모스는 일반적으로 살균처리 없이 사용되기 때문에 수확된 양송이버섯의 직접적인 오염 원인으로 작용될 수 있다. 복토 단계 이후에 양송이버섯은 약 20일 전후의 생육 기간을 거쳐 수확된다. 수확 단계에서도 오염된 장갑, 칼, 저울 등의 다양한 환경 조건에 의해 양송이버섯이 교차 오염될 잠재적 위험 가능성을 가지고 있다. 수확 과정 중 수집한 시료에서 위생지표세균의 변화를 Fig. 2와 Table 3에 나타냈다. Coliform은 C, D 농가의 균사 핀 배지에서 검출되지 않았지만 복토를 덮은 후 수확과정에서 채취한 복토층과 버섯에서 모두 coliform이 검출되었다(Fig. 2). 또한, A, C 농가의 장갑에서 각각 2.09±1.49 log CFU/g, 4.15±0.74 log CFU/g의 coliform이 검출되었다(Table 3). 복토층에 E. coli 가 검출된 A, C, D 농가에서는 수확한 버섯과 장갑에서도 E. coli 양성을 나타냈다(Fig. 2, Table 2 and 3).
Table 3.
The number of indicator bacteria in samples collected from harvest and packing environments of four button mushroom farms
| Environmental swabs |
Total aerobic bacteria |
Total coliforms |
E. coli
|
|
|
A |
B |
C |
D |
A |
C |
C |
| Knife |
6.36±0.15 |
1.50±0.4 |
5.46±0.53 |
2.80±1.21 |
ND2) |
ND |
ND |
| Basket |
2.48±1.76 |
-1) |
5.38±0.79 |
2.73±0.34 |
ND |
ND |
ND |
| Glove |
5.99±0.35 |
3.04±0.06 |
8.05±0.42 |
4.26±0.68 |
2.09±1.49 |
4.15±0.74 |
0.98±1.39 |
| Bench |
5.22±0.20 |
1.79±0.39 |
2.83±0.39 |
2.03±0.85 |
ND |
ND |
ND |
| Scale |
- |
2.91±0.08 |
3.29±0.11 |
1.58±0.52 |
- |
ND |
ND |
| Packaged mushroom |
5.03±0.26 |
3.64±0.36 |
4.28±0.79 |
3.69±0.22 |
ND |
ND |
ND |
Download Excel Table
수확단계의 포장된 양송이버섯의 일반세균수는 모두 5 log CFU/g 이하로 네 농가의 일반세균수 및 coliform 수는 모두 학교급식위생관리지침서에서 권장하는 비가열조리식품의 미생물 권장허용치에 적합하였다(Table 2 and 3). 한국에서 비가열조리식품의 미생물 권장허용치는 일반세균 6 log CFU/g 미만, coliform 3 log CFU/g 미만, E. coli 1 log CFU/g 미만으로 권장하고 있다(Ministry of Education, 2021). 본 연구 결과는 수확 및 포장된 버섯이 권장 허용치에 적합하였지만, 오염도가 비교적 높은 복토에 의한 교차오염뿐만 아니라, 양송이버섯 배양 후 채취 단계나 포장 단계에서 청결하지 못한 장갑으로 인해 교차오염될 수 있음을 나타낸다. 따라서 복토의 소독과 장갑 등 작업도구, 작업장의 위생관리가 이루어져야 할 것이다.
3.3. MLST를 이용한 E. coli 오염경로 분석
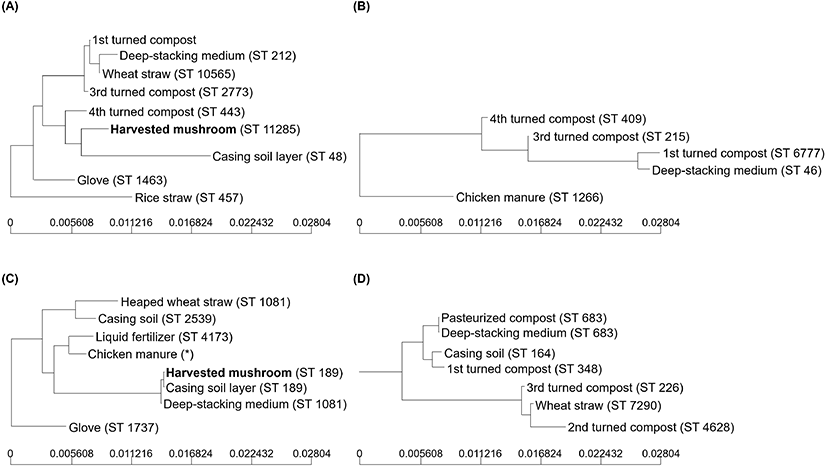
양송이버섯 생산 단계에서 오염경로를 추정하기 위해 분리된 E. coli 68균주를 대상으로 7개의 house keeping gene에 대한 MLST 분석을 통해 UPGMA dendrogram을 구성하였다(Fig. 3). ST 번호는 MLST 사이트(http://mlst.warwick.ac.uk/mlst/)에서 allele sequence를 비교하여 부여하였다(Fig. 3). 분석 결과 A, B, C, D 농가는 각각 9, 5, 8, 7종의 시료에서 E. coli 가 검출되었다. A 농가의 시료 중 1, 3차 뒤집기 배지와 밀집의 시료는 비교적 유사한 패턴을 보였다. 또한, A 농가의 수확한 버섯과 복토층이 유사한 것으로 나타났다. 그러나 ST 번호는 일치하지 않았다. B 농가는 원료와 배지 및 뒤집기 시료와의 유사도가 낮고 패턴이 가장 크게 변화하였다. C 농가에서 분리된 E. coli는 혼합배지와 복토층, 수확한 버섯에서 분리된 균주의 유사도가 높았으며, 그중 수확한 버섯과 복토층의 ST 번호가 189로 일치하였다. 따라서 C 농가의 수확한 버섯에 오염된 E. coli는 복토층에서 교차오염된 것으로 추정된다. D 농가에서 분리된 E. coli는 살균된 배지와 혼합배지와 유사한 패턴을 보였으며, ST 번호 또한 683으로 일치하였다. Li등 (2016)에 따르면, 돼지고기 생산 과정에서 분리된 동일한 ST 유형을 가진 Salmonella 균주는 환경과 도살된 돼지 사이에 교차 오염이 발생했음을 나타낸다고 보고하였다. 이상의 결과로 볼 때 원료 및 복토에 오염되어 있는 미생물이 배지 및 버섯에 교차오염되는 것으로 판단된다.
Fig. 3.
UPGMA tree and STs of the isolated E. coli from production process of button mushroom by production stage in farm A, B, C, and D.
*The allele value is identified, but the ST value is not assigned.
Download Original Figure
본 연구의 결과를 종합해 보면 양송이버섯에서 병원성 미생물은 검출되지 않았으며, 원료 및 배지에서 검출된 Salmonella spp.와 Listeriamonocytogenes는 퇴비화 과정에서 완전히 사멸되었고, E. coli O157:H7과 S. aureus 또한 검출되지 않아 안전성 면에서는 크게 우려할 수준은 아닌 것으로 판단된다. 하지만 불충분한 퇴비화 과정을 거친 배지, 오염된 복토와 장갑은 양송이버섯에 교차오염을 일으킬 가능성이 있다. 따라서 안전한 양송이버섯을 생산하기 위해서는 퇴비화 과정에 공기주입 시설을 갖추고, 작업자 및 작업도구의 위생관리, 복토의 살균 처리 등이 이루어져야 할 것으로 생각된다. 또한, 원료 또는 오염된 복토로부터의 교차오염을 예방하기 위해 배지제조 구역과 버섯 배양 및 수확 구역을 구분하여 운영하고, 작업자에 의한 교차오염이 발생되지 않도록 개인위생에 대한 교육을 통한 인식개선이 필요할 것으로 사료된다.
Acknowledgment
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ01564201)의 지원에 의해 이루어진 것임.
References
Akram K, Kwon JH. Food irradiation for mushrooms: A review. J Korean Soc Appl Bi, 53, 257-265 (2010)

Chandna P, Nain L, Singh S, Kuhad RC. Assessment of bacterial diversity during composting of agricultural byproducts. BMC Microbiol, 13, 1-14 (2013)

De Reu K, Grijspeerdt K, Herman L. A Belgian survey of hygiene indicator bacteria and pathogenic bacteria in raw milk and direct marketing of raw milk farm products. J Food Saf, 24, 17-36 (2004)

Ding T, Rahman SME, Oh DH. Inhibitory effects of low concentration electrolyzed water and other sanitizers against foodborne pathogens on oyster mushroom. Food Control, 22, 318-322 (2011)

Feng Y, Yang Q, Wang L, Li G, Lv X, Han QA, Liu X, Xia X. Survey of microbial contamination and characterization of
Escherichia coli in kiwifruit orchards in Shaanxi, China, 2013. Foodborne Pathog Dis, 12, 857-863 (2015)

Frosth S, Karlsson-Lindsjo O, Niazi A, Fernstrom LL, Hansson I. Identification of transmission routes of
Campylobacter and on-farm measures to reduce
Campylobacter in chicken. Pathogens, 9, 363 (2020)

Jay JM, Loessner MJ, Golden DA. Indicators of food microbial quality and safety. Modern Food Microbiol, 1, 473-495 (2005)

Jeon EB, Kim JY, Choi MS, Choi SH, Bang HJ, Park SY. Microbial contamination levels in the raw materials of home meal replacement shabu-shabu meal kit distributed in markets. J Food Hyg Sa, 35, 375-381 (2020)

Lagnika C, Zhang M, Mothibe KJ. Effects of ultrasound and high pressure argon on physico-chemical properties of white mushrooms (
Agaricus bisporus) during postharvest storage. Postharvest Biol Technol, 82, 87-94 (2013)

Lee CJ, Yoo YM, Moon JW, Cheong JC, Kong WS, Kim YG, Lee BE, Yoon MH, Sa TM. Characteristics and distribution of microorganisms in a rice straw compost for cultivation of button mushrooms (
Agaricus bisporus). Korean J Mycol, 45, 43-53 (2017)

Li Y, Cai Y, Tao J, Kang X, Jiao Y, Guo R, Wang G, Pan Z, Jiao X.
Salmonella isolated from the slaughterhouses and correlation with pork contamination in free market. Food Control, 59, 591-600 (2016)

Marcal S, Sousa AS, Taofiq O, Antunes F, Morais AM, Freitas AC, Barros L, Ferreira IC, Pintado M. Impact of postharvest preservation methods on nutritional value and bioactive properties of mushrooms. Trends Food Sci Technol, 110, 418-431 (2021)

Meng X, Liu B, Xi C, Luo X, Yuan X, Wang X, Zhu W, Wang H, Cui Z. Effect of pig manure on the chemical composition and microbial diversity during co-composting with spent mushroom substrate and rice husks. Bioresour Technol, 251, 22-30 (2018)

Meng X, Yan J, Zuo B, Wang Y, Yuan X, Cu Z. Full-scale of composting process of biogas residues from corn stover anaerobic digestion: Physical-chemical, biology parameters and maturity indexes during whole process. Bioresour Technol, 302, 122742 (2020)

Nakamura A, Takahashi H, Arai M, Tsuchiya T, Wada S, Fujimoto Y, Shimabara Y, Kuda T, Kimura B. Molecular subtyping for source tracking of
Escherichia coli using core genome multilocus sequence typing at a food manufacturing plant. PloS One, 16, e0261352 (2021)

Park J, Kim YJ, Suh SH, Kim MG, Kwak HS, Kim SH, Heo EJ. Evaluation of hygiene indicators and sampling plan for detecting microbial contamination in health functional foods. J Food Prot, 85, 844-848 (2022)

Perez-Arnedo I, Cantalejo MJ, Martinez‐Laorden A, Gonzalez-Fandos E. Effect of processing on the microbiological quality and safety of chicken carcasses at slaughterhouse. Int J Food Sci, 56, 1855-1864 (2021)

Qin Y, Liu D, Wu Y, Yuan M, Li L, Yang J. Effect of PLA/PCL/cinnamaldehyde antimicrobial packaging on physicochemical and microbial quality of button mushroom (
Agaricus bisporus). Postharvest Biol Technol, 99, 73-79 (2015)

Thakur MP. Advances in mushroom production: Key to food, nutritional and employment security: A review. Indian Phytopatho, 73, 377-395 (2020)

Valverde ME, Hernandez-Perez T, Paredes-Lopez O. Edible mushrooms: Improving human health and promoting quality life. Int J Microbiol, 2015, 376387 (2015)

Veghova A, Minarovicova J, Korenova J, Drahovska H, Kaclikova E. Prevalence and tracing of persistent
Listeria monocytogenes strains in meat processing facility production chain. J Food Saf, 37, e12315 (2017)

Venturini ME, Reyes JE, Rivera CS, Oria R, Blanco D. Microbiological quality and safety of fresh cultivated and wild mushrooms commercialized in Spain. Food Microbiol, 28, 1492-1498 (2011)