1. 서론
병풀(Centella asiatica L. Urban)은 미나리과(Apiceae)에 속하는 다년생 초본식물로 호랑이풀 및 고투 콜라(Gotu Kola)라고 불린다(Bylka 등, 2013). 고온 다습한 환경에서 자라는 특성으로 인해 인도, 마다가스카르를 비롯한 중국, 말레이시아, 인도네시아를 포함한 아시아에 주로 분포하며, 국내에서는 남해 및 제주도 일대에 자생하고 있는 것으로 보고되고 있다(Choi 등, 2021; Mohd Razali 등, 2019). 병풀은 항암효과(Orhan, 2012), 면역 활성(Ha 등, 2009), 심혈관 보호효과(Mohd Razali 등, 2019) 및 항염증(Kwon 등, 2008) 등의 활성을 가지고 있을 뿐만 아니라, 피부 관련 콜라겐 합성(Bylka 등, 2013) 및 피부 재생(Bylka 등, 2014) 등의 효과가 보고되고 있다. 위와 같은 이유로 현재는 식품으로 활용되기보다 피부 손상 및 상처 치유 등의 피부 관련 의약품에 주로 쓰이고 있다.
병풀은 triterpenoid류인 madecassoside, asiaticoside, madecassic acid, asiatic acid와 폴리페놀 및 플라보노이드 등이 유효성분으로 다량 존재하는 것으로 알려져 있다(Shin 등 2022). 특히 triterpenoid 중 높은 함량을 나타내는 aisiaticoside는 항균 및 항진균 활성으로 인해 피부질병, 상처 치유 효과가 있어 화장품 소재로 각광을 받고 있다(Kil 등, 2018; Kim 등, 2002). 현재, 병풀은 식품의약품안전처의 식품원료 목록에서 잎을 제외한 잎자루, 줄기 및 꽃 등은 식품원료로 등록되어 있지 않으며, 재배농가에서는 잎자루를 포함하여 줄기와 꽃을 포함하지 않고 수확하기에는 많은 어려움이 따르는 실정이다. 병풀은 미나리과 식물로 생육특성상 포복성을 띠기 때문에 줄기가 뻗어 나가면서 줄기마디에 뿌리가 내리고 잎이 발생하게 된다. 만약 잎자루가 짧다면 잎만 수확하는 것이 가능하나 잎이 커지는 동시에 잎자루도 성장하기 때문에 잎과 잎자루를 분리하여 수확하기가 사실상 어려워, 농가에서는 이를 함께 수확하고 있는 실정이다(Kim 등, 2002). 최근 병풀은 토경, 수경 재배 및 수직 또는 다단으로 재배하는 등 다양한 재배 방법이 시도되고 있지만, 줄기, 꽃 및 잎자루를 포함하지 않고 수확하기에는 어려운 상황이다(Choi 등, 2020; Oh 등, 2021).
병풀에 대한 연구는 잎(Choi 등, 2021; Eom 등, 2021; Goo 등, 2018; Lee 등, 2021; Shin 등, 2020)을 이용한 연구가 대부분이며, 이외에 뿌리 및 잎자루(Kil 등, 2018; Zainol 등, 2003) 등의 효능을 평가한 연구가 보고되고 있지만, 병풀 꽃에 대한 연구는 매우 부족한 실정이다. 따라서 본 연구에서는 병풀 꽃을 기능성 소재로서 활용하기 위해 줄기 및 잎을 대조군으로 이용하여 Eom 등(2021) 및 Shin 등(2022)의 유효성분의 함량과 활성이 우수하였던 70% 에탄올 추출물을 조제하였다. 이후 총폴리페놀 함량과 triterpenoid 화합물을 분석하여 유효성분으로 활용하고자 하였으며, 항산화, 대식세포 및 피부세포를 이용한 항염증 활성을 검토하였다. 이를 통해 병풀 잎뿐만 아니라 꽃의 기능성 소재로서 활용가능성을 확인하고, 병풀 꽃의 유효성분 및 생리활성의 기초자료로서 활용될 수 있을 것으로 판단된다.
2. 재료 및 방법
본 연구에서 사용된 병풀은 충청북도농업기술원(Cheongju, Korea) 시설하우스 내 고형베드에 식재하여 양액재배(EC 1.5 dS⋅m−1, pH 6.5)한 것을 사용하였으며, 분석을 위해 잎, 줄기 및 꽃을 각각 분리하여 동결건조(Ilshin Biobase, Seoul, Korea)하고, 건조물은 분쇄기(Hanil, Seoul, Korea)를 통해 분말 형태로 사용하였다. 총폴리페놀 함량 및 항산화 활성은 70% 에탄올로 10배 가하여 진탕추출기(VS-203D, Vision Scientific Co., Daejeon, Korea)로 280 rpm, 2시간 동안 추출한 뒤 여과하여 사용하였다. 항염증 활성 및 triterpenoid 성분 분석은 선행 연구(Eom 등, 2021; Shin 등, 2020)를 참고하여 추출물을 동결건조하여 분석에 이용하였다.
병풀 부위에 따른 자유라디칼 소거능은 2,2-diphenyl-1-picrylhydrazyl(DPPH, Sigma-Aldrich, USA) 및 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS, Sigma-Aldrich, USA)를 이용하여 평가하였다. DPPH 라디칼 소거능 경우, Choi 등(2003)의 방법에 따라 0.4 mM DPPH 용액을 흡광도값이 1.3-1.4가 되도록 희석한 후 추출물 0.2 mL에 DPPH 용액 0.8 mL를 가하고, 실온에서 30분간 방치한 후 분광광도계(Cary UV-Vis spectrophotometer, Agilent Technologies, Santa Clara, CA, USA)를 사용하여 525 nm에서 흡광도를 측정하였다. ABTS 소거활성의 경우 7.4 mM ABTS와 2.6 mM potassium persulfate 혼합액을 24시간 암소에 방치하여 ABTS 양이온을 형성시킨 후, 735 nm에서 흡광도가 1.4-1.5가 되도록 증류수로 희석하였다. 희석된 ABTS 용액 1 mL에 시료 50 μL를 가하여 30분간 반응 후 흡광도를 측정하였다(Jang 등, 2012). DPPH 및 ABTS 라디칼 소거능은 시료 첨가군과 비첨가군의 흡광도 차이를 백분율(%)로 나타냈으며, 표준물질로는 ascorbic acid(Sigma-Aldrich, St. Louis, MO, USA)를 이용하였다. 항산화 활성 분석 시 ABTS 라디칼 소거능은 추출물을 100배 희석하여 측정하였으며, DPPH 라디칼 소거능의 경우, 400배 희석하여 분석에 이용되었다. 총폴리페놀 함량은 Folin-Ciocalteu’s 방법에 따라 Folin-Ciocalteu reagent(Sigma-Aldrich, St. Louis, MO, USA)가 시료의 페놀성 화합물에 의해 환원된 결과, 몰리브덴 청색으로 발색하는 것을 원리로 측정하였다(Jang 등, 2012). 시료 50 μL에 2% Na2CO3 1 mL를 혼합하여 3분 방치하고 50% Folin-Ciocalteu 용액 50 μL를 혼합하여 1시간 반응시킨 후 750 nm에서 흡광도를 측정하였다. 표준물질은 gallic acid(Sigma-Aldrich, USA)를 이용하여 검량선을 작성하였고 총폴리페놀 함량은 mg%(mg GAE/100 g)로 나타내었다.
병풀 부위에 따른 triterpenoid 성분인 madecassoside, asiaticoside, madecassic acid 및 asiatic acid의 함량을 평가하기 위해, Eom 등(2021)의 방법을 참고하여 Table 1과 같은 조건을 이용하였다. 표준물질은 Sigma-Aldrich에서 구입하였으며, 메탄올에 용해하여 농도별로 검량선을 작성하고 시료에 존재하는 triterpenoid 함량을 mg/g으로 나타내었다.
면역세포주를 이용한 항염증 활성을 측정하기 위해 마우스 유래 대식 세포주인 RAW 264.7을 한국세포주은행(Korean Cell Line Bank; KCLB, Seoul, Korea)에서 분양받았다. 세포주는 1% penicillin-streptomycin(P/S; Gen DEPOT, Katy, TX, USA)과 10% fatal bovine serum(FBS; Gibco, Waltham, MA, USA)이 첨가된 DMEM(Dulbecco’s modified Eagle medium; HyClone, San Angelo, TX, USA) 배지에서 37°C, 5% CO2 조건이 유지되는 배양기(Sanyo, Sakata, Japan)에서 2-3일 간격으로 계대배양하여 실험에 사용하였다. RAW 264.7 세포를 6×104 cells/well로 96 well plate에 도포하고 배양기에서 80% confluency될 때까지 세포를 안정화시켰다. 이후, 상등액을 모두 제거하고 FBS가 함유되지 않은 serum-free DMEM 160 μL와 시료 20 μL를 첨가하고 배양하였으며, 30분 후 염증 유발 물질로 1 μg/mL lipopolysaccharide from Escherichia coli (LPS: Sigma-Aldrich Co.) 20 μL를 첨가하여 24시간 동안 재배양하였다. LPS로 유도된 RAW 264.7 세포의 시료에 따른 독성평가는 3-(4,5-dimethylthiazol-2-y1)-2,5-diphenyltetrazolium bromide(MTT; Invitrogen, Eugene, OR, USA) 시약을 이용하여 Shin 등(2020)의 방법을 참고하여 550 nm의 흡광도에서 측정하였으며, 시료 처리군의 세포생존율은 LPS 대조군에 대한 세포생존율(cell viability, %)로 나타냈다. 한편, 배양 상등액에 존재하는 tumor necrosis factor-alpha(TNF-α), interleukin-6 (IL-6), monocyte chemoattractant protein-1(MCP-1) 및 산화질소(nitric oxide, NO)의 함량은 Invitrogen 및 BD Bioscience(San Diego, CA, USA)에서 구입한 enzyme-linked immunosorbent assay(ELISA) kit 및 griess assay를 통해 측정되었다. 또한, 제공된 standard reference를 이용하여 작성된 표준곡선을 통해 함량(ng/mL)으로 계산되었으며, 산화질소 함량은 NaNO2(Sigma-Aldrich)를 이용하여 작성된 표준곡선을 통해 함량(μM)으로 계산되었다.
피부세포주를 이용한 항염증 활성을 측정하기 위해 인간유래 각질형성 세포주인 HaCaT keratinocyte를 한국세포주은행(Korean Cell Line Bank; KCLB, Seoul, Korea)에서 분양받았다. 세포주는 RAW 264.7과 동일한 조건으로 배양되었으며, 분석에 이용되었다. HaCaT 세포를 2×104 cells/well로 96 well plate에 도포하고 배양기에서 mono layer(100% confluency)될 때까지 세포를 안정화시켰다. 이후, 상등액을 모두 제거하고 FBS가 함유되지 않은 serum-free DMEM 160 μL와 시료 20 μL를 첨가하고 배양하였으며, 1시간 후 염증 유발 물질로 각각 10 ng/mL의 TNF-α와 interferon-γ(T+I) 20 μL를 첨가하여 24시간 동안 재배양하였다. T+I로 유도된 HaCaT 세포의 시료에 의한 독성평가는 MTT법을 통해 분석하였으며, 시료처리군의 세포생존율은 T+I 유도군에 대한 세포생존율(cell viability, %)로 나타냈다. 한편, 배양 상등액에 존재하는 IL-6 및 IL-8의 함량은 BD Bioscience(San Diego, CA, USA)에서 구입한 ELISA kit를 통해 측정되었으며, 제공된 standard reference를 이용하여 작성된 표준곡선을 통해 함량(pg/mL)으로 계산되었다.
모든 시험은 3번 반복하여 실시하였으며, 결과는 평균±표준편차(standard deviation, SD)로 나타냈다. 통계분석은 SPSS(Statistical Package for the Social Science, Ver. 26, SPSS Inc., Chicago, USA)를 이용하였다. 항산화 활성 및 유효성분 분석은 분산의 동질성을 비교하기 위해 Levene’s test를 실시한 후, 동질성을 갖는 경우 분산분석(ANOVA)을 실시한 후 측정값 간의 유의성을 Duncan’s multiple range test로 p⟨0.05 수준에서 검증하였다. 한편, 항염증 활성의 경우 Student’s t-test를 이용하여 p⟨0.05, p⟨0.01, p⟨0.001 수준에서 유도군과의 유의성을 검증하였다.
3. 결과 및 고찰
병풀 부위에 따른 총폴리페놀 함량 및 항산화 활성은Table 2에 나타내었다. 총폴리페놀 함량의 경우 잎, 줄기 및 꽃순으로 확인되었다. Kim과 Won(2009)의 국내 일부 지역에서 자생하는 엉겅퀴(Cirsium japonicum)의 경우는 잎(115.7 mg/g), 줄기(40.1 mg/g) 및 꽃(30.2 mg/g) 순으로 잎의 폴리페놀 함량이 가장 높게 나타났으며, 이는 본 연구 결과와 동일한 경향을 나타내었다. 하지만, Mok 등(2011)의 연구결과에서 엉겅퀴의 부위별 총폴리페놀 함량은 잎(62.1 mg/g), 꽃(61.3 mg/g) 및 줄기(26.4 mg/g) 순으로 확인되어 같은 엉겅퀴에서도 다른 결과가 나타나 생육환경에 따라 많은 차이가 나타난 것을 확인할 수 있었으며, 산채류인 엉겅퀴와 병풀은 대게 잎에서 총폴리페놀 함량이 높은 것으로 확인되었다. 구절초의 꽃, 잎과 줄기 및 뿌리를 연구한 또 다른 연구에서는(Chung과 Jeon, 2011) 꽃, 잎과 줄기 순으로 다른 결과가 나타났다. 또한, 털부처꽃(Lythrum salicaria)의 채취 부위 및 채취 시기에 따른 총폴리페놀 함량은 채취 시기에 따라 여름 시기(7월)에는 꽃에서 총폴리페놀이 검출되지 않았으나, 계절이 지나가면서 지속적으로 증가하여 8월부터 9월 말까지는 부위 중 제일 높은 함량을 차지했고, 그 다음으로 잎부분에서 높은 함량으로 나타났다(Lee 등, 2010). 위 결과들을 종합해 볼 때, 작물의 채취하는 시기에 따라 함량 차이가 나타나는 것으로 판단되며, 추후 수확 시기에 따른 분석이 필요할 것으로 사료된다.
ABTS 라디칼 소거능 결과, 잎(90.56%), 줄기(72.01%) 및 꽃(50.18%) 순으로 확인되었으며, DPPH 라디칼 소거능은 잎(51.52%), 줄기(35.68%) 및 꽃(24.64%) 순으로 동일한 경향이 나타났고, 총폴리페놀 함량 결과와 동일한 순으로 확인되었다. Kil 등(2018)의 연구에서 병풀의 잎, 잎자루 및 전잎(잎과 잎자루)의 부위별 총폴리페놀 함량을 분석한 결과, 잎의 함량이 가장 높게 보고되었다. 또한, Zainol 등(2003)의 연구에서 네 가지 서로 다른 병풀 품종의 부위별 평가에서 잎이 가장 많은 페놀화합물을 함유하고 있었으나, 항산화 활성은 잎자루, 뿌리 및 잎 순으로 저해되어 본 연구결과인 총폴리페놀 함량과 항산화 활성의 상관관계에 대한 상이한 결과를 나타냈다. 하지만, 엉겅퀴(Mok 등, 2011)의 연구에서 총폴리페놀 함량은 잎 다음으로 꽃에서 높게 검출되어 ABTS 라디칼 소거능과 양의 상관관계를 추정할 수 있었다. 또한, Shin 등(2021)의 연구에서 병풀 용매추출물을 이용하여 총폴리페놀 함량과 항산화 활성 간의 양의 상관관계를 확인하여 본 연구에서도 상관성을 추정할 수 있었다. 위 결과를 종합해 볼 때, 동일한 품종에서도 채취 시기, 부위 및 추출 방법 등의 차이에 대한 분석이 필요할 것으로 사료되며, 추후 항산화 활성과 총폴리페놀 간의 상관관계에 대해 분석할 필요성이 있을 것으로 판단된다.
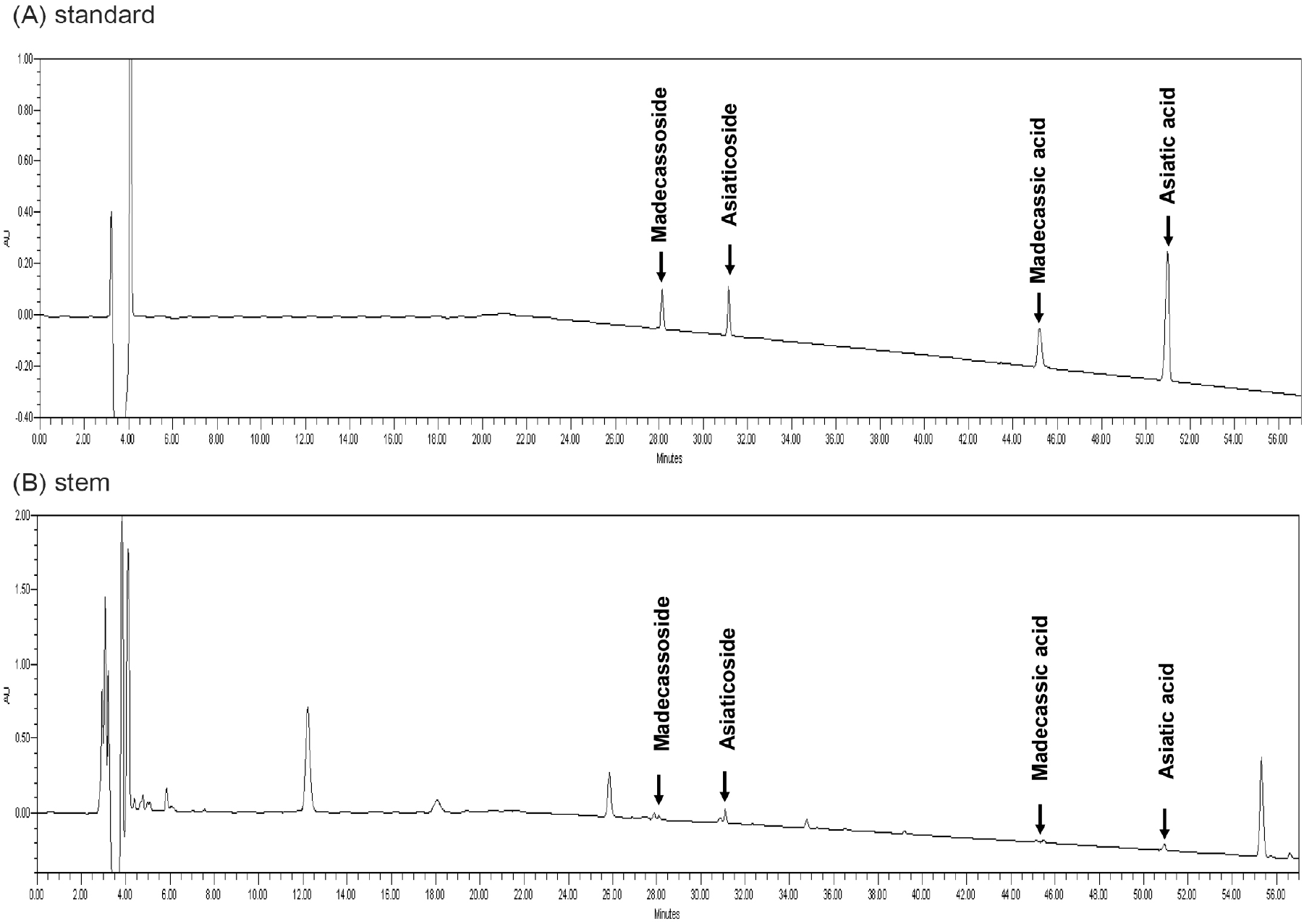
병풀의 유효성분인 triterpenoid 화합물의 함량을 도출하기 위해 HPLC-UV를 이용하여 표준품과 시료의 retention time을 비교한 결과, 시료 3종은 모두 유효성분을 포함하고 있음을 확인하였다(Fig. 1). 이후 표준품을 이용한 검량선 작성 후 정량 분석결과는 Table 3에 나타냈다. Madecasoside의 경우, 줄기, 꽃 및 잎의 순으로 확인되었으며, asiaticoside는 줄기, 잎 및 꽃 순으로 함유하고 있는 것으로 확인되었다. Madecassic acid는 줄기, 꽃 및 잎 순으로 확인되었으며, asiatic acid는 줄기, 잎 및 꽃 순으로 검출되었다. 병풀 부위에 따른 유효성분 함량을 비교한 결과, asiaticoside를 제외한 성분은 모두 잎에서 가장 많이 함유되어 있는 것으로 확인되었으며, asiaticoside는 꽃에서 가장 높게 함유되어 있는 것으로 나타났다. 총유효성분은 줄기에서 12.50 mg/g으로 가장 낮게 분포하는 반면, 꽃(54.20 mg/g) 및 잎(60.65 mg/g)의 순으로, 잎에서 유효성분을 가장 많이 함유하는 것으로 확인되었다. Eom 등(2021)의 선행연구에서 동일한 조건으로 추출한 병풀 추출물에서는 madecassic acid가 검출되지 않았지만 본 연구 결과에서는 검출된 것으로 보아, 동일한 종이라도 재배산지 및 재배조건에 따라 차이가 나타나는 것으로 판단된다. 또한, 분석방법에 따라 다른 결과가 나타나는 것으로 추정되며, 정확한 분석을 위한 Seong 등(2021)에서 제시한 분석법 검증(method validation)의 항목인 검출한계(limited of detection) 및 정량한계(limited of quantification)의 분석이 수반되어야 할 것으로 판단된다. 유효성분의 정량 분석 결과를 종합해 볼 때, 잎에서 줄기와 꽃에 비해 총유효성분의 함량이 가장 높은 것을 확인할 수 있었으며, 네 가지 성분 중 asiaticoside만이 꽃 추출물이 가장 높게 함유하고 있는 것으로 나타났다. 이는 Qiu 등(2015) 및 Wan 등(2013)의 보고에 따르면 asiaticoside가 우수한 항염증 활성 효과가 있으며, 항염증 활성이 가장 우수하였던 꽃 추출물의 유효성분 중 asiaticoside가 항염증 활성과 연관성이 높을 것으로 추정되었다.
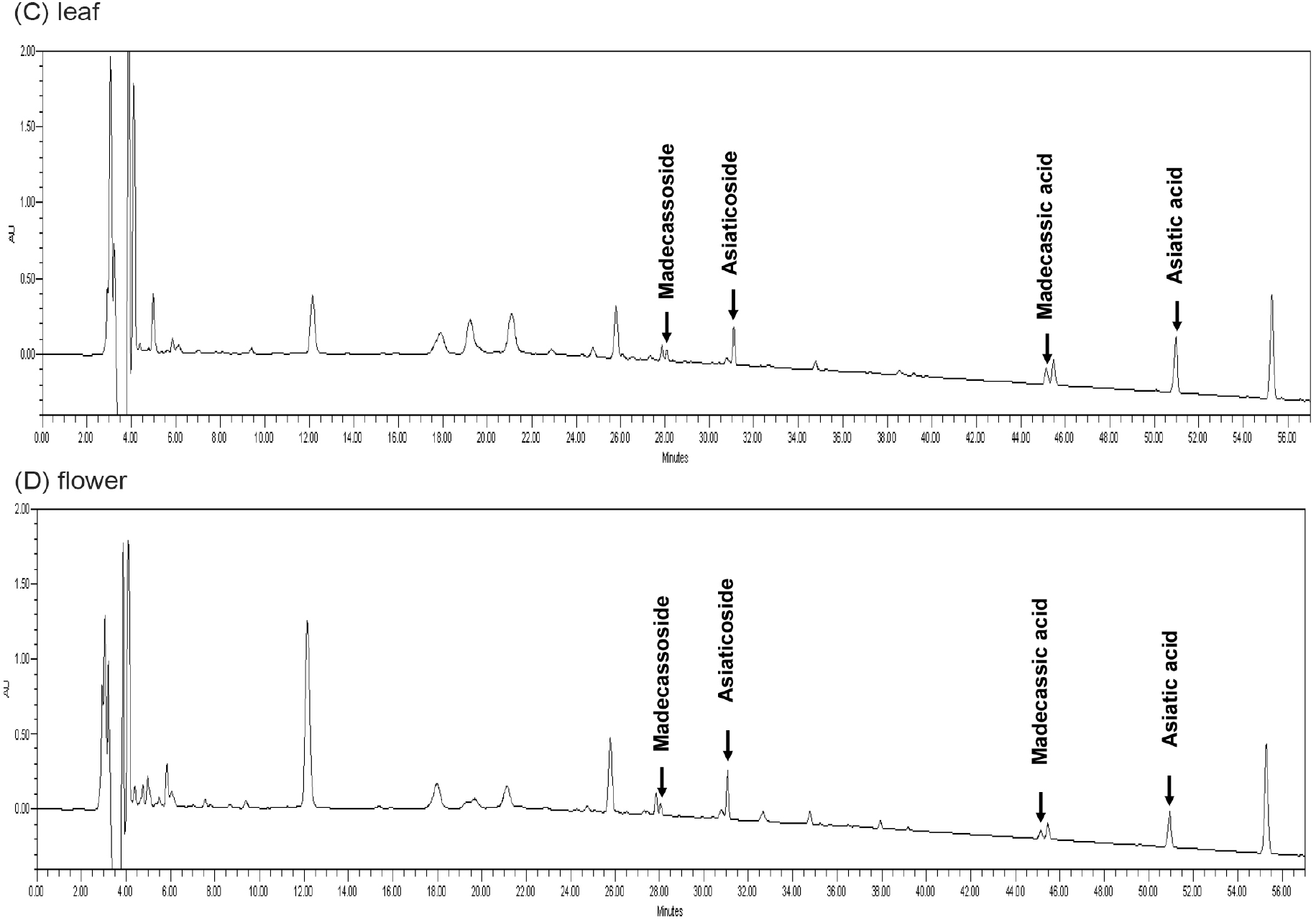
대식세포는 체내 염증반응에 관여하는 주된 세포로 알려져 있으며(Chen 등, 2001), RAW 264.7 세포를 이용하여 그람 음성균의 세포벽 성분인 LPS를 처리하여 염증을 유도하고, 시료 처리를 통해 염증 매개인자인 TNF-α, IL-6, MCP-1 및 산화질소(NO) 생성에 미치는 영향을 확인하고자 하였다. 먼저, RAW 264.7 세포를 이용한 세포독성 평가 결과, 시료 3종은 25-100 μg/mL의 농도범위에서 LPS 유도군 대비 통계적으로 유의한 세포독성은 확인되지 않았다(Fig. 2(A)). 또한, 시료 3종은 100 μg/mL의 농도범위에서 LPS 유도군 대비 통계적으로 유의한 33.0-63.1%의 세포증식 활성을 나타냈으며, 이는 Shin 등(2020) 및 Eom 등(2021)의 연구에서 70% 에탄올 추출물 처리를 통해 세포증식 활성이 나타나는 것과 유사한 경향을 나타내는 것으로 확인되었다. 한편, LPS로 염증이 유도된 RAW 264.7 세포에 NO 억제 활성을 평가한 결과는 Fig. 2(B)에 나타내었다. 양성대조군(positive control, PC)으로 Chen 등(2001)의 연구에서 NO 억제제로 알려진 N-nitroarginine methyl ester(L.NAME, 50 μg/mL)를 이용하였으며, LPS 유도군(44.4 μM) 대비 18.9 μM(62.8%)의 유의한 억제활성을 나타냈다. 줄기 처리군의 경우, 25-100 μg/mL의 농도범위에서 LPS 유도군 대비 15.7-30.7 μM(33.7-70.6%)의 유의한 NO 억제활성을 나타냈으며, 동일 농도 범위에서 잎 처리군은 LPS 유도군 대비 12.2-25.2 μM(47.3-79.3%)의 억제활성을 나타냈다. 꽃 처리군의 경우 8.5-28.3 μM (39.6-88.3%)의 우수한 억제활성을 나타냈으며, 25 μg/mL 농도에서는 잎이 우수하였으나, 50-100 μg/mL의 농도범위에서는 꽃이 가장 우수한 NO 억제활성을 나타내는 것으로 확인되었다. TNF-α 억제활성 평가결과는 Fig. 2(C)에 나타내었다. PC 처리군의 경우, dexamethasone(50 μg/mL)을 이용하였으며(Jeon 등, 2000), 3.4 ng/mL의 TNF-α 생성량을 나타냈으며 LPS 유도군(20.9 ng/mL) 대비 통계적으로 유의한 억제활성을 나타냈다. 줄기 처리군의 경우, 25-100 μg/mL의 농도범위에서 LPS 유도군 대비 10.2-16.4 ng/mL(22.3-53.5%)의 억제활성을 나타냈으며, 잎 처리군은 10.5-16.7 ng/mL(21.1-51.8%)의 줄기와 유사한 TNF-α 억제활성을 나타내었다. 반면에 꽃 처리군의 경우, LPS 유도군 대비 8.0-16.1 ng/mL(24.1-64.8%)의 억제활성을 나타냈으며, 시료 3종 중 가장 우수한 것으로 확인되었다. IL-6 평가 결과는 Fig. 2(D)에 나타냈으며, PC 대조군은 LPS 유도군(8.1 ng/mL) 대비 1.0 ng/mL(93.9%)의 유의한 억제활성을 나타냈다. 줄기 처리군의 경우, 25-100 μg/mL의 농도범위에서 LPS 유도군 대비 5.4-7.2 ng/mL(12.2-35.8%)의 통계적으로 유의한 억제활성을 나타냈으며, 잎 처리군은 4.6-6.5 ng/mL(22.0-46.0%)의 억제활성을 나타냈다. 특히, 꽃 처리군의 경우 LPS 유도군 대비 3.1-5.9 ng/mL(29.2-65.7%)의 가장 우수한 IL-6 억제활성을 나타냈다. 마지막으로, MCP-1 억제활성의 결과는 Fig. 2(E)에 나타냈다. PC 대조군은 LPS 유도군(6.5 ng/mL) 대비 4.6 ng/mL(29.4%)의 통계적으로 유의한 억제활성을 나타냈으며, 줄기 및 잎 처리군은 통계적으로 유의한 억제활성은 확인되지 않았다. 반면, 꽃 처리군의 경우 25-50 μg/mL의 농도범위에서는 유의한 억제활성은 확인되지 않았지만, 100 μg/mL의 농도에서는 LPS 유도군 대비 4.6 ng/mL (28.9%)의 MCP-1 억제활성을 나타냈다. Goo 등(2018) 및 Jo 등(2014) 등의 연구와 같이 병풀의 항염증 활성은 많은 보고가 되어 있는 반면, 병풀 꽃에 대한 연구는 거의 없는 실정으로 병풀 꽃을 항염증 소재로 활용하기 위한 기초자료로서 활용될 수 있을 것으로 판단된다. 또한, 유사한 연구로 Mok 등(2011)의 연구에서 엉겅퀴의 부위별 항염증 활성에서 잎이 가장 우수한 활성을 나타낸 것에 반해, 본 연구에서는 꽃이 가장 우수한 활성을 나타냈다는 점에서 상이한 결과를 나타냈으며, 추가적으로 병풀과 유사한 산형과와의 비교가 필요할 것으로 판단된다. 따라서 RAW 264.7 세포주를 이용한 항염증 억제활성 평가결과를 종합하면, 시료 3종 중 꽃 추출물이 잎과 줄기 추출물보다 NO, TNF-α, IL-6 및 MCP-1 억제 활성이 우수한 것으로 확인되었으며, 병풀 잎이나 줄기보다 항염증 활성이 우수한 꽃을 항염증 소재로서 활용할 수 있을 것으로 사료된다.
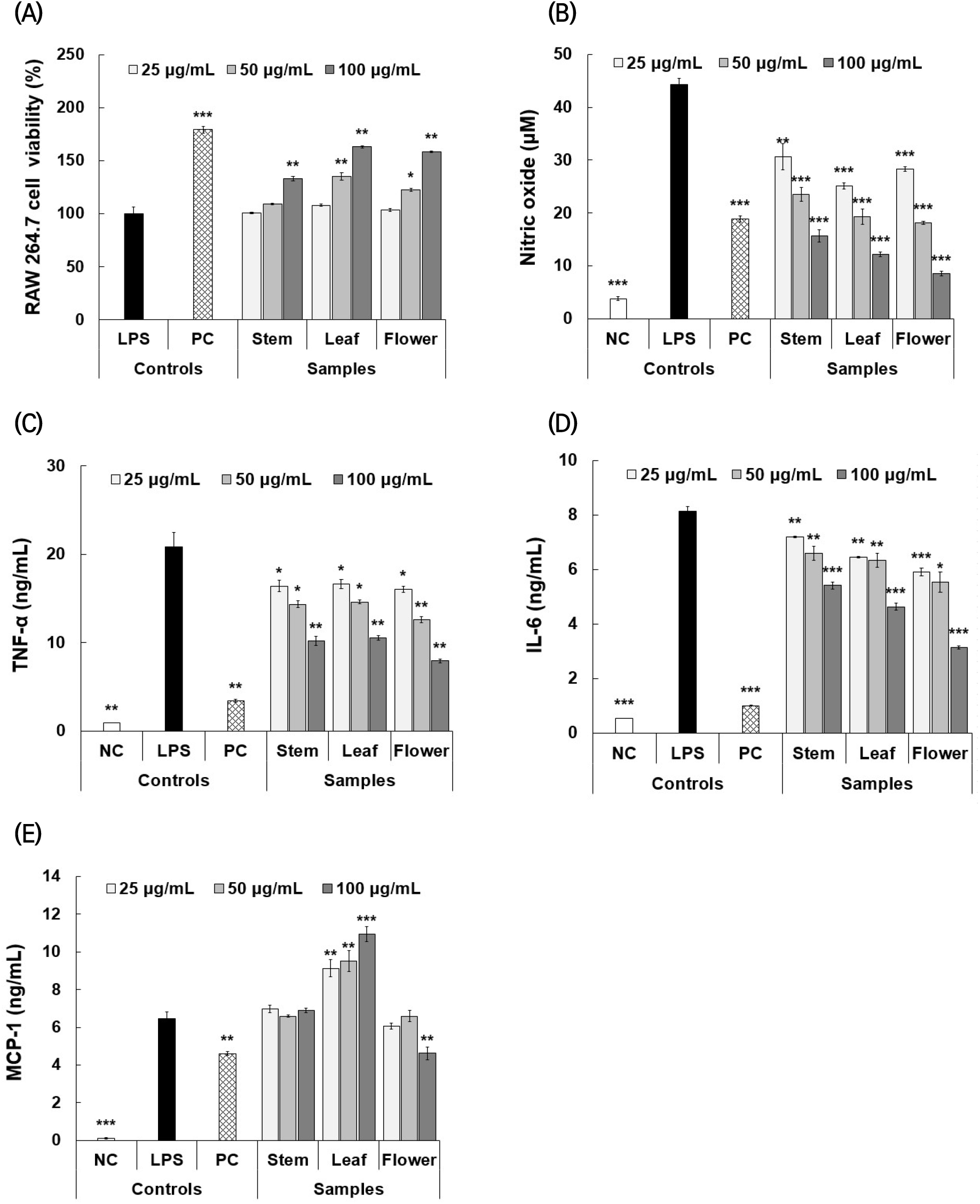
인간유래 각질형성 세포주인 HaCaT 세포는 염증성 사이토카인(TNF-α 및 IFN-γ, T+I) 처리 시 IL-6와 같은 사이토카인, IL-8, TARC(Thymus and activation regulated chemokine) 및 RANTE(regulated on activation, normal T cell expressed and secreted)와 같은 케모카인 분비를 촉진하여 아토피성 피부염을 유발하는 것으로 알려져 있기 때문에(Ha 등, 2020), 이를 활용하여 시료 처리를 통해 IL-6 및 IL-8 생성에 미치는 영향을 평가하고자 하였다. 먼저, 세포독성 평가결과(Fig. 3(A)), 25-100 μg/mL의 농도범위에서 T+I 유도군 대비 시료에 따른 유의한 세포독성은 확인되지 않았다. 또한, 시료 3종 모두 대식세포와 유사하게 25-100 μg/mL의 농도범위에서 T+I 유도군 대비 통계적으로 유의한 세포증식 활성(13.1-52.5%)을 나타냈다. IL-6 억제활성 결과는 Fig. 3(B)에 나타냈으며, PC 대조군은 T+I 유도군(1,100.0 pg/mL) 대비 442.5 pg/mL(59.8%)의 유의한 억제활성을 나타내었다. 줄기 처리군의 경우, 25-100 μg/mL의 농도범위에서 T+I 유도군 대비 480.2-902.4 pg/mL(18.0-56.3%)의 통계적으로 유의한 억제활성이 확인되었으며, 잎 처리군의 경우 779.4-518.8 pg/mL(29.1-52.8%)의 억제활성을 나타냈다. 반면, 꽃 처리군의 경우 T+I 유도군 대비 795.5-308.5 pg/mL(27.7-72.0%)의 억제활성을 나타냈으며, 25-50 μg/mL의 농도범위에서는 잎과 유사한 억제활성을 나타냈으나, 고농도인 100 μg/mL의 농도에서는 꽃이 우수한 IL-6 억제활성을 나타내는 것으로 확인되었다. IL-8 억제활성의 결과는 Fig. 3(C)에 나타냈다. PC 대조군은 T+I 유도군(971.7 pg/mL) 대비 268.8 pg/mL(72.3%)의 억제활성을 나타냈으며, 줄기 처리군은 25-100 μg/mL의 농도범위에서 T+I 유도군 대비 892.6-350.6 pg/mL(8.1-63.9%)의 통계적으로 유의한 IL-8 억제활성이 확인되었다. 잎 처리군의 경우 T+I 유도군 대비 468.3-715.9 pg/mL(26.3-51.8%)의 유의한 억제활성이 나타났다. 특히, 꽃 처리군의 경우 25-100 μg/mL의 농도범위에서 T+I 유도군 대비 103.5-654.3 pg/mL (32.7-89.4)의 PC 대조군보다 우수한 IL-8 억제활성을 나타냈다. Eom 등(2021), Lee 등(2019) 및 Shin 등(2020)의 연구에서 피부세포를 통한 여러 생리활성은 보고되고 있지만, 국내 병풀 꽃을 활용하여 피부염 억제 활성을 평가한 것은 국내에서 처음으로 판단되며, 이를 통해 병풀과 더불어 병풀 꽃 또한 피부 관련 기능성 소재로서 활용할 수 있을 것으로 예상된다. 결론적으로 대식세포 및 피부세포를 통한 항염증 억제 활성은 꽃 추출물이 줄기나 잎보다 우수한 활성을 나타냈으며, 이를 통해 항염증 소재로서 활용가능성을 확인할 수 있었다.
4. 요약
피부재생효과 등이 우수하여 의약 및 화장품 소재로 많이 쓰이고 있는 병풀의 소비확대를 위하여, 현재 식품원료로 잎만 사용되고 있는 병풀을 줄기와 꽃까지 기능성을 조사하여 병풀의 부위에 대한 원재료 가능성을 알아보고자 하였다. 병풀의 잎, 줄기 및 꽃 3가지 부위 각각의 생리활성을 평가한 결과, 총폴리페놀 함량 및 항산화 활성은 잎, 줄기 및 꽃 순으로 나타났다. 또한, 병풀에 존재하는 주요 유효성분인 triterpenoid 화합물을 분석한 결과, 모든 부위에서 asiaticoside 및 asiatic acid가 높은 함량을 가진 것으로 나타났으며, 총함량의 경우 잎(60.65 mg/g), 꽃(54.20 mg/g)이 검출되고 줄기에서는 12.50 mg/g이 검출되어 줄기에서의 유효성분 함량이 나머지 부위보다 약 4-5배가량 적게 나타났다. RAW 264.7 및 HaCaT 세포를 이용해 세포독성 평가를 진행한 결과, 25-100 μg/mL의 농도범위에서 유의적인 세포 독성은 확인되지 않았다. RAW 264.7 세포를 통한 염증 억제활성 평가 결과, 시료 3종 중 꽃 추출물이 잎과 줄기 추출물보다 NO, TNF-α, IL-6 및 MCP-1 억제 활성이 우수한 것으로 확인되었으며, HaCaT 세포에서 IL-6 및 IL-8의 생성량을 유의적으로 감소시켰다. 최종적으로, 현재 병풀 잎만을 의약품, 화장품 및 식품가공 소재로 쓰고 있으나, 줄기와 꽃, 특히 꽃의 경우 우수한 염증억제 활성을 나타내 기능성 소재로 활용할 수 있을 것으로 판단된다.










