서 론
오디(Morus alba, mulberry)는 뽕나무속(Morous)에 속하는 열매로 다량의 glucose와 fructose를 함유하고 있으며, malic acid, citric acid, tartaric acid 및 acetic acid 등의 유기산을 다량 함유하고 있는 과실이다(Kim 등, 2006; Kim 등, 2008). 또한, 오디는 cyanidin-3-glucoside, cyanidin-3rutinoside 등의 anthocyanin 및 resveratrol과 같은 생리활성 물질이 다량 함유되어 있는 것으로 보고되고 있다(Kim 등 2003; Kim 등, 2010). 오디는 항산화(Arfan 등, 2012), 항당뇨(Kim 등, 1996), 혈관신생억제(Lee과 Kim, 2008), 혈행개선(Park 등, 2014) 및 피부보호(Jeong 등, 2013) 등의 효능이 있는 것으로 보고되고 있으며, 이를 활용하여 막걸리(Kim 등, 2013), 요구르트(Sung과 Choi, 2014), 약과(Shin 등, 2014), 초콜릿(Park과 Joo, 2011) 등 다양한 형태의 가공식품 개발 연구가 진행되고 있다.
와인은 특유의 향미와 기능성으로 인해 음료로서 소비되는 것에 국한되지 않고, 2차 가공의 원료로써 활용되기도 한다. 그 중 발효식초는 과실의 당을 이용하여 효모발효를 진행 후 알코올을 생성시키고, 생성된 알코올을 이용하여 초산발효를 진행하여 제조되는 발효식품이다(Solieri 등, 2006). 따라서 와인은 발효식초의 영양성분 구성 및 품질에 있어서 직접적인 영향을 주는 중요한 요인으로 작용한다(Verzelloni 등, 2007). 또한, 과실의 효모 발효 과정 중 생성되는 대사산물들은 최종 식초의 대사산물 해석에 있어 중요하지만, 기존 연구들은 식초 자체의 품질에만 초점을 맞추어 연구가 진행되었을 뿐, 발효식초의 원료로써 작용하는 와인의 대사산물에 대한 연구는 거의 없는 실정이다.
대사체학은 유기체 내 대사체에 대한 포괄적인 분석을 진행하여 정성적 및 정량적으로 해석하는 학문이다(Xu과 Wu, 2015). 대사체 분석은 주로 NMR 분광법(nuclear magnetic resonance spectroscopy), GC/MS(gas chromatography-mass spectrometry) 및 LC/MS(liquid chromatography-mass spectrometry) 분석법이 활용되는데(More 등, 2015; Seo 등, 2016), 이 중 GC/MS 분석법은 대사체학에서 널리 사용되는 방법 중 하나로 300개 이상의 화합물을 구별할 수 있는 분석법이다(Jonsson 등, 2004). 이러한 대사체학은 와인(Lee 등, 2009; Son 등, 2009; Seo 등, 2015), 맥주(Heuberger 등, 2012; Andres-Iglesias 등, 2014) 및 사케(Takahashi 등, 2016)와 같은 주류의 발효 과정 중 생성된 대사산물 분석에도 활용되었으나, 식초 제조를 위한 와인 발효에서의 대사체 연구는 미비하다.
따라서 본 연구에서는 발효식초 제조를 위해 누룩에서 선별한 Saccharomyces cerevisiae JIS(KCCM 43338) 효모를 활용하여 오디와인을 제조한 후 이화학적 분석 및 대사체 분석을 진행하였다.
재료 및 방법
본 실험에 사용된 오디는 2019년 전라북도 고창에서 재배되어 수확한 후 급속 냉동하여 실험에 사용하였다. 알코올 발효에 사용된 효모는 누룩에서 분리․동정한 후 기탁한 Saccharomyces cerevisiae JIS(KCCM 43338)를 한국미생물보존센터(KCCM, Seoul, Korea)에서 동결건조된 형태로 분양을 받아 사용하였다. 상업용 효모와 비교를 위해 Saccharomyces cerevisiae K1-V1116(Lalvin, Montreal, Canada) 효모와 Saccharomyces bayanus EC-1118(Lalvin, Montreal, Canada) 효모를 대조구로 사용하였으며, 각각의 효모들은 YM broth 배지에서 28°C에서 48시간 배양 후 사용하였다.
오디와인 제조는 −20°C에서 동결시킨 오디를 4°C에서 해동한 후, blender로 분쇄하여 사용하였다. 분쇄한 오디는 발효용기에 넣고 오디 중량 대비 1배의 용수를 혼합한 뒤, 설탕을 첨가하여 22.5±0.5 °Brix로 조정하였으며, 준비된 혼합물은 9개(n=3/접종 효모)의 5 L의 발효 용기에 동일한 양으로 각각 분리하여 효모 발효액을 접종하였다. 접종 시 효모의 초기 균수는 2×106 CFU/mL였으며, 28°C의 배양기에서 정치된 상태로 발효를 진행하였다.
발효 과정 중 가용성 고형분 함량은 디지털 굴절계(PR-32, Atago, Tokyo, Japan)를 사용하여 °Brix를 측정하였다. 알코올 함량은 발효가 완료된 오디 와인을 체로 걸러 시료 100 mL를 취한 후 증류 방법을 통해 측정하였다. 자세히는 오디 와인 시료 100 mL를 증류하여 얻어진 70 mL에 증류수 30 mL를 첨가하여 100 mL로 용량을 보정하고, 주정계(Scale: 0–10; 10–20, Deakwang Inc., Seoul, Korea)를 이용하여 비중을 측정하였다. 그 후 Gay-Lussac 표에 따라 15°C로 보정하여 알코올 함량을 % (v/v) 농도로 나타내었다(Son 등, 2009).
원심분리(4°C, 13,800 rpm, 15 min)한 오디 와인 시료 100 μL를 동결건조한 후 100 μL의 methoxyamine hydrochloride/pyridine(20 mg/mL)를 첨가하고 20 μL의 ribitol solution(0.5 mg/mL)을 내부표준물질로써 첨가한 후 1분간 vortexing하였다. 그 후 2분간 ultra-sonication한 후 암전에서 반응시켰다(30°C, 75 rpm, 90 min). 반응이 종료된 후 각각의 시료에 50 μL의 N-methyl-N-trimethylsilyl-trifluoroacetamide(MSTFA) solution을 첨가하고 2차 반응을 시켰다(37°C, 75 rpm, 30 min). 그리고 12,000 rpm에서 5분간 원심분리를 진행하고, 상등액을 GC vial에 넣은 후 분석을 진행하였다. 유도체화된 오디 와인 시료의 분석은 autosampler가 부착된 GC/MS(QP2020, Shimadzu, Kyoto, Japan)를 이용하였다. 분리에 사용된 컬럼은 Rtx-5ms(30 m×0.25 mm×0.25 μm)를 사용하였으며, GC oven은 80°C에서 2분간 유지한 후 15°C/min의 조건으로 330°C까지 상승시키고, 330°C에서 6분간 유지하였다. GC/MS의 온도설정은 injector(230°C), transfer line(250°C), ion source(200°C)로 각각 설정하였다. 이동상으로는 99.9% 고순도 헬륨을 1 mL/min의 유속으로 사용하였고, scan 범위는 50–600 m/z로 설정하였다. 시료의 주입량은 1 μL로 설정하였으며, split ratio는 1:20의 비율로 설정하여 분석을 진행하였다.
GC/MS data 전처리를 위한 raw data 파일은 GC solution software(Shimadzu, Kyoto, Japan)에서 netCDF 형식으로 변경한 후, MetAlign software(Lommen 2009)를 사용하여 baseline correction, data scaling 및 alignment를 진행하였다. 그리고 AIoutput software(Tsugawa 등, 2011) 사용하여 peak detection 및 identification을 진행하였다. Identification된 대사산물은 NIST library와 HMDB(The human metabolome database)를 활용하여 검증하였다. GC/MS data의 normalization은 내부표준물질로 사용된 ribitol을 이용하여 각각의 분석값을 보정하여 진행하였고, 전처리 과정이 끝난 data는 SIMCA software(SIMCA 14.0, Umetics, Malmö, Sweden)를 사용하여 principal component analysis(PCA) 및 partial least squares-discriminant analysis(PLS-DA)를 실시하였다.
결과 및 고찰
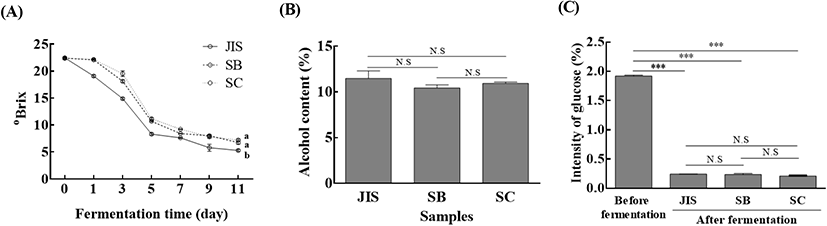
효모를 달리한 오디와인의 가용성 고형분 함량 변화, 알코올 농도 차이 및 glucose 차이를 Fig. 1에 나타내었다. °Brix는 가용성 고형분 함량을 의미하는 단위로 포도의 경우 0.5%의 오차가 있는 등 과일에 따라 오차가 존재하지만, 와인 연구에서는 당도를 간접적으로 확인할 수 있는 지표로 사용된다(Margalit, 2003). 가용성 고형분의 함량을 측정하기 위해 사용되는 굴절계는 발효 초기에 알코올이 생성되기 전까지는 오차가 없지만, 알코올 발효가 진행되어 알코올이 생성되면 굴절계의 굴절률에 영향을 미쳐 원래의 값보다 더 높은 값을 보인다(Son 등, 2009). 다만 알코올 발효 중 굴절계로 측정한 °Brix 값은 당 소모 및 알코올 생성량과 높은 상관성을 갖기 때문에 굴절계를 통한 °Brix 측정은 효모의 당 소모 패턴을 간접적으로 확인할 수 있다(Son 등, 2009). 발효 초기(0일) 가용성 고형분 함량은 22.5±0.05 °Brix로 동일하게 보정하였는데, 발효가 지속될수록 점차 감소하여 발효 종료(11일 경과)에는 Saccharomyces cerevisiae JIS(JIS) 효모를 접종한 와인이 5.3±0.20 °Brix로 가장 낮은 가용성 고형분 함량을 보였고, Saccharomyces bayanus EC-1118(SB) 효모를 접종한 와인이 6.7±0.32 °Brix, Saccharomyces cerevisiae K1-V1116(SC) 효모를 접종한 와인이 7.2±0.15 °Brix의 함량을 보였다(Fig. 1A). 발효 1일차에 SB 효모와 SC 효모를 접종한 와인은 각각 22.1±0.10 °Brix, 22.1±0.11 °Brix로 발효 초기의 가용성 고형분 함량과 큰 차이를 보이지 않았으나, JIS 효모를 접종한 오디와인은 19.1±0.20 °Brix로 발효 초기에 비해 약 3 °Brix가 감소하였다. 이러한 패턴은 발효가 종료되는 시점(발효 11일 경과)까지 유지되었다. 발효 종료 후 각각의 오디와인 알코올을 증류하여 알코올 함량을 분석한 결과를 Fig. 1(B)에 나타내었다. JIS 효모를 접종한 와인이 11.4±0.83%로 접종 효모 중 가장 높은 알코올 함량을 보였고, SC 효모를 접종한 와인이 10.9±0.15%의 알코올 함량을 보였으며 SB 효모를 접종한 와인이 10.4±0.35%로 가장 낮은 알코올 함량을 보였으나 각각의 오디와인간의 유의성은 없었다. Kim 등(2008)은 S. cereivisiae를 포함하여 총 4가지 효모로 오디와인 발효를 진행했는데, 발효결과 10.1–11.0%의 알코올 함량을 보여 본 실험결과와 유사한 실험결과를 보여주었다. 이러한 결과는 GC/MS로 glucose 농도를 분석한 Fig. 1(C)의 결과에서도 유사하게 나타났는데, 모든 와인의 glucose 농도가 발효가 진행됨에 따라 감소한 결과를 보였지만, 접종 효모간의 유의적 차이는 없었다. 본 실험결과에서 JIS 효모를 접종한 오디와인의 가용성 고형분 함량은 상업용 효모인 SB 효모를 접종한 와인과 SC 효모를 접종한 와인에 비해 빠른 당 소모속도를 보인 것으로 보였지만(Fig. 1A), 실제 알코올 함량 및 glucose 농도의 결과에서는 유의적인 차이를 보이지 않았기 때문에 JIS 효모가 상업용 효모에 비해 우수한 발효능력을 보였다고는 말할 수 없다. 다만, 상업용 효모 대비 JIS 효모의 당 소모량 및 최종 알코올 생성량을 고려했을 때, JIS 효모도 상업용 효모와 같이 오디와인 발효에 활용될 수 있음을 시사한다.
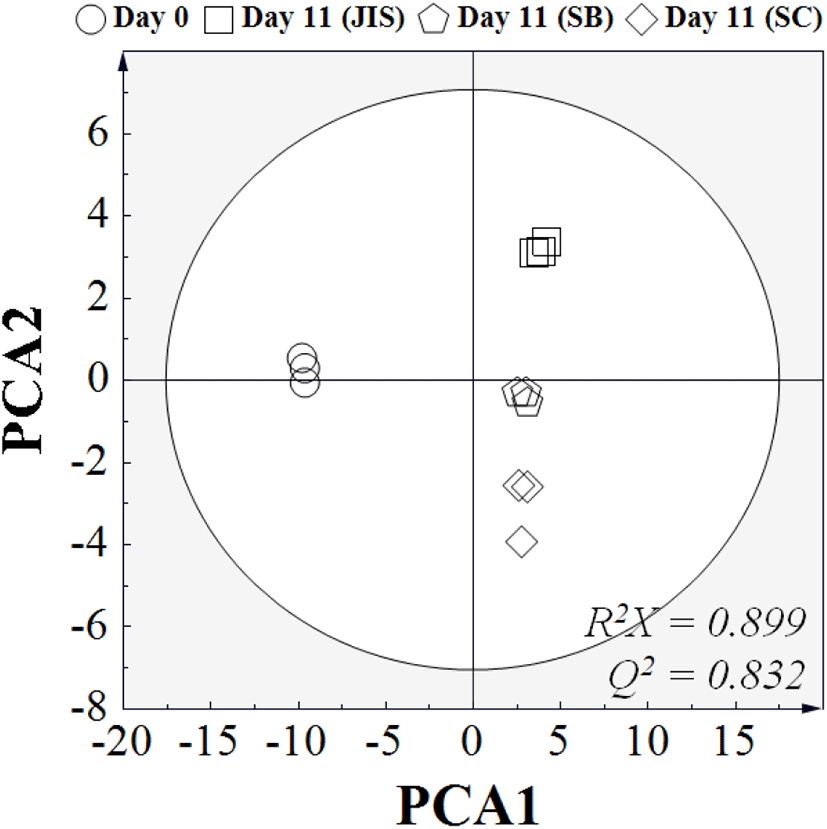
오디와인의 발효 전후 대사산물 패턴 변화를 확인하고자 GC/MS 분석을 통해 얻어진 data를 이용하여 PCA를 실시하였다(Fig. 2). GC/MS 기기의 재연성과 신뢰성 검증은 QC(quality control) 샘플을 이용하여 측정하였는데, 분석결과 RSD(%)가 5% 이하로 확인되었다(data not shown). GC/MS 분석결과, 총 1,665개의 feature가 검출되었으며, 그중 62개의 대사산물이 식별되었다. 1,665개의 data를 이용하여 PCA 분석을 진행한 결과, 발효 전(0일)과 발효 후(11일 경과)의 대사산물 프로파일은 뚜렷하게 구분되는 패턴을 보였고, 발효 종료(11일 경과) 시점에서도 접종 효모에 따른 그룹 간의 차이가 명확한 것을 확인할 수 있었다. 하지만 발효 종료 시점의 그룹 간 차이는 발효 기간에 따른 차이보다 크지 않은 것을 확인할 수 있는데, 이는 발효 기간에 따른 대사산물 차이가 접종 효모에 따른 대사산물 차이보다 크다는 것을 의미한다.
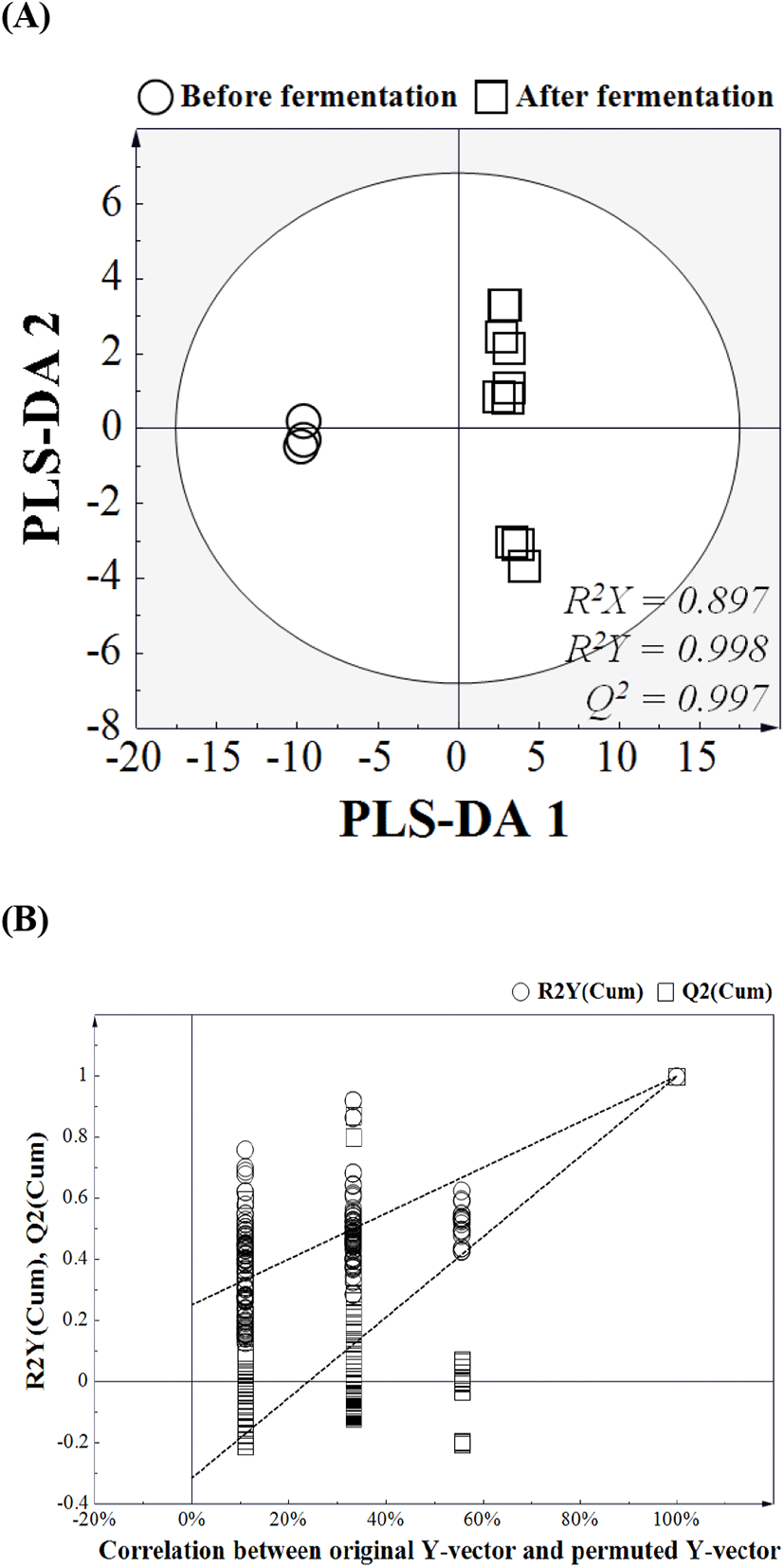
오디와인의 발효 전후 차이에 기여하는 대사산물을 확인하기 위해 발효 전후의 대사산물들에 대한 PLS-DA를 진행하였다(Fig. 3). PCA 및 PLS-DA는 복잡한 질량 분석 data를 효율적으로 분석할 수 있는 다변량 통계분석 방법이다. 이 두 분석방법 간에는 차이가 존재하는데, PCA가 독립변수만을 이용하여 주성분을 구하고, 이를 활용하여 회귀식을 구하는 방식이라면, PLS는 독립변수만이 아니라 종속변수도 동시에 이용하여 새로운 변수를 찾고, 이를 회귀식으로 구하므로 PCA보다 그룹 간 차이를 더욱 명확하게 보여준다(Leem, 2016). 또한, PLS는 그룹 간의 차이에 기여하는 대사산물이 무엇인지 순차적으로 확인할 수 있는 장점을 가지고 있다. 하지만 이러한 PLS는 임의로 지정한 종속변수를 활용하기 때문에 반드시 순열 검증 테스트(permutation test)를 진행하여 over-fit을 검증하여야 한다(Szymanska 등, 2012). 본 연구에서는 200번의 순열테스트를 진행하였고(Fig. 3B), 테스트 결과를 토대로 모델의 적합도를 판단하였다. 발효 전후 오디와인의 샘플을 GC/MS로 분석하고 이를 PLS-DA를 진행한 결과, PCA 결과와 유사한 패턴을 보여 발효 전후의 오디와인은 명확한 대사산물 차이를 보이는 것으로 확인되었으며, 이러한 차이에 기여한 대사산물을 기여도(VIP>1.0)에 따라 Table 1에 나타내었다. 차이에 기여하는 대사산물은 총 24개였으며, 그중 glucose와 glucosamine을 제외한 22개의 대사산물은 발효에 의해 증가하는 것으로 나타났다. 이러한 결과는 오디와인 발효 중 효모가 당(glucose)을 소모하여 lactic acid, succinic acid 등의 유기산 및 leucine, isoleucine, alanine, serine 등 유리아미노산 및 glucitol, inositol 등의 당알코올을 생성한다는 것을 보여준다.
| Metabolites | RT1) | Target MS | VIP score | Day 11 / Day 0(↑ / ↓2)) | p-value3) |
|---|---|---|---|---|---|
| Lactic acid | 4.97 | 117 | 1.12 | ↑ | *** |
| Glycolic acid | 5.12 | 147 | 1.01 | ↑ | *** |
| 2-Aminoethanol | 7.02 | 174 | 1.06 | ↑ | *** |
| Leucine | 7.25 | 158 | 1.11 | ↑ | *** |
| Glycerol | 7.29 | 147 | 1.12 | ↑ | *** |
| Phosphoric acid | 7.31 | 299 | 1.09 | ↑ | *** |
| Isoleucine | 7.48 | 158 | 1.10 | ↑ | *** |
| Glycine | 7.62 | 174 | 1.04 | ↑ | *** |
| Succinic acid | 7.63 | 249 | 1.11 | ↑ | *** |
| Methionine | 7.63 | 147 | 1.09 | ↑ | *** |
| Serine | 8.10 | 204 | 1.09 | ↑ | *** |
| Alanine | 8.71 | 248 | 1.04 | ↑ | ** |
| Homoserine | 8.90 | 218 | 1.06 | ↑ | *** |
| Aspartic acid | 9.51 | 232 | 1.08 | ↑ | *** |
| 4-Aminobutyric acid | 9.60 | 174 | 1.03 | ↑ | *** |
| Threonic acid | 9.74 | 147 | 1.06 | ↑ | *** |
| Quinic acid | 12.18 | 345 | 1.12 | ↑ | *** |
| Glucose | 12.42 | 103 | 1.12 | ↓ | *** |
| Glucosamine | 12.57 | 203 | 1.11 | ↓ | ** |
| Galactitol | 12.70 | 217 | 1.10 | ↑ | *** |
| Glucuronic acid | 12.80 | 333 | 1.09 | ↑ | *** |
| Gluconic acid | 13.13 | 147 | 1.11 | ↑ | *** |
| Inositol | 13.73 | 217 | 1.12 | ↑ | *** |
| Lactose | 16.80 | 204 | 1.11 | ↑ | *** |
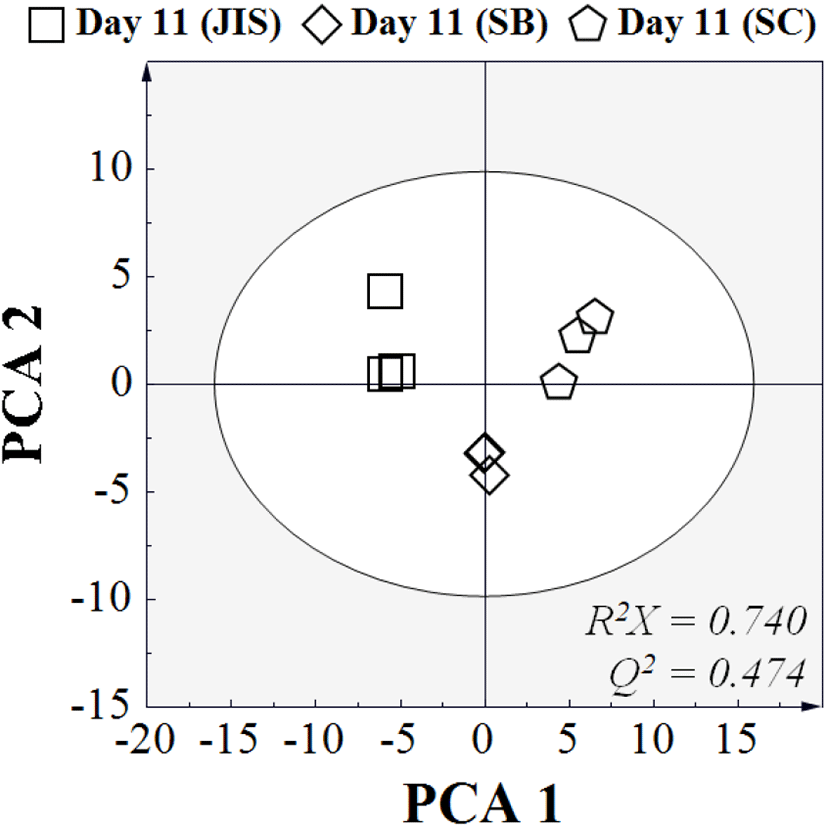
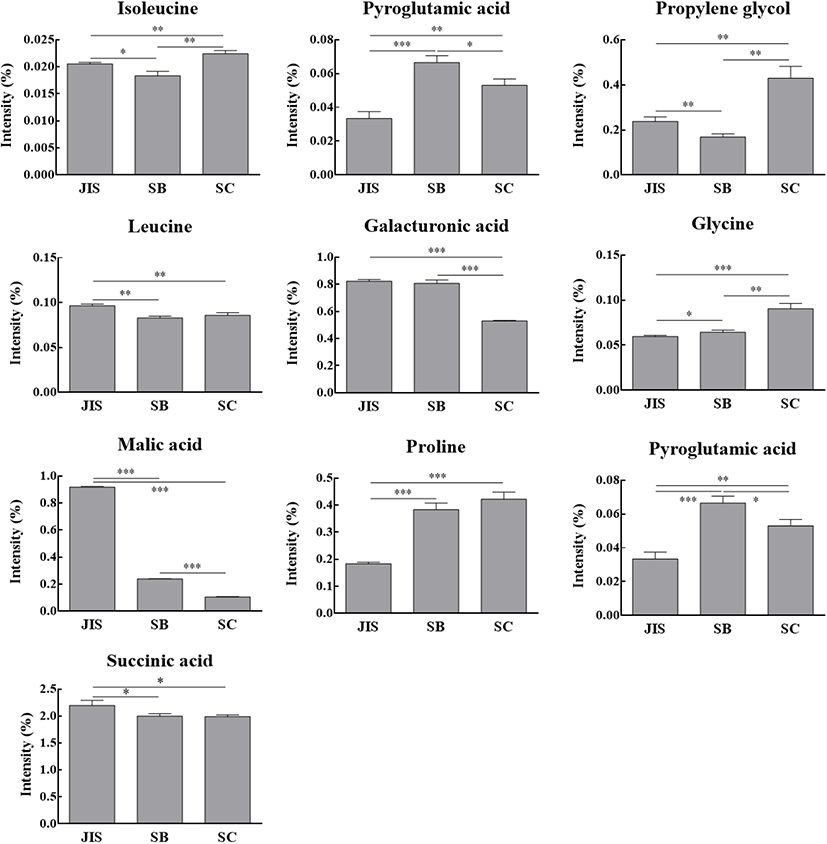
Fig. 4는 발효 후 효모에 따른 오디와인의 대사산물 프로파일을 PCA score plot으로 나타낸 결과이다. 분석결과, 세가지 접종 효모에 따라 발효 종료 후 명확한 대사산물 차이를 보이는 것으로 나타났는데, 이러한 결과는 동일한 원료 및 발효 조건이라고 하더라도 접종 효모가 다르면 최종 발효 대사산물에 차이가 발생한다는 것을 의미한다. 각각의 효모 간의 차이에 기여하는 대사산물을 확인하기 위해 PLS-DA를 진행하였고(Fig. 5), 이를 Fig. 6에 나타내었다. 분석결과, isoleucine, pyroglutamic acid, propylene glycol 및 leucine을 포함한 총 10개의 대사산물이 각각의 효모에 따라 차이를 보이는 것으로 나타났다. JIS 효모를 접종했을 때 가장 높은 함량을 보인 대사산물은 leucine, galacturonic acid, malic acid 및 succinic acid 였고, SB 효모를 접종했을 때 가장 높은 함량을 보인 대사산물은 pyroglutamic acid 및 glutamic acid 였으며, SC 효모를 접종했을 때 가장 높은 함량을 보인 대사산물은 isoleucine, propylene glycol, glycine 및 proline이었다.
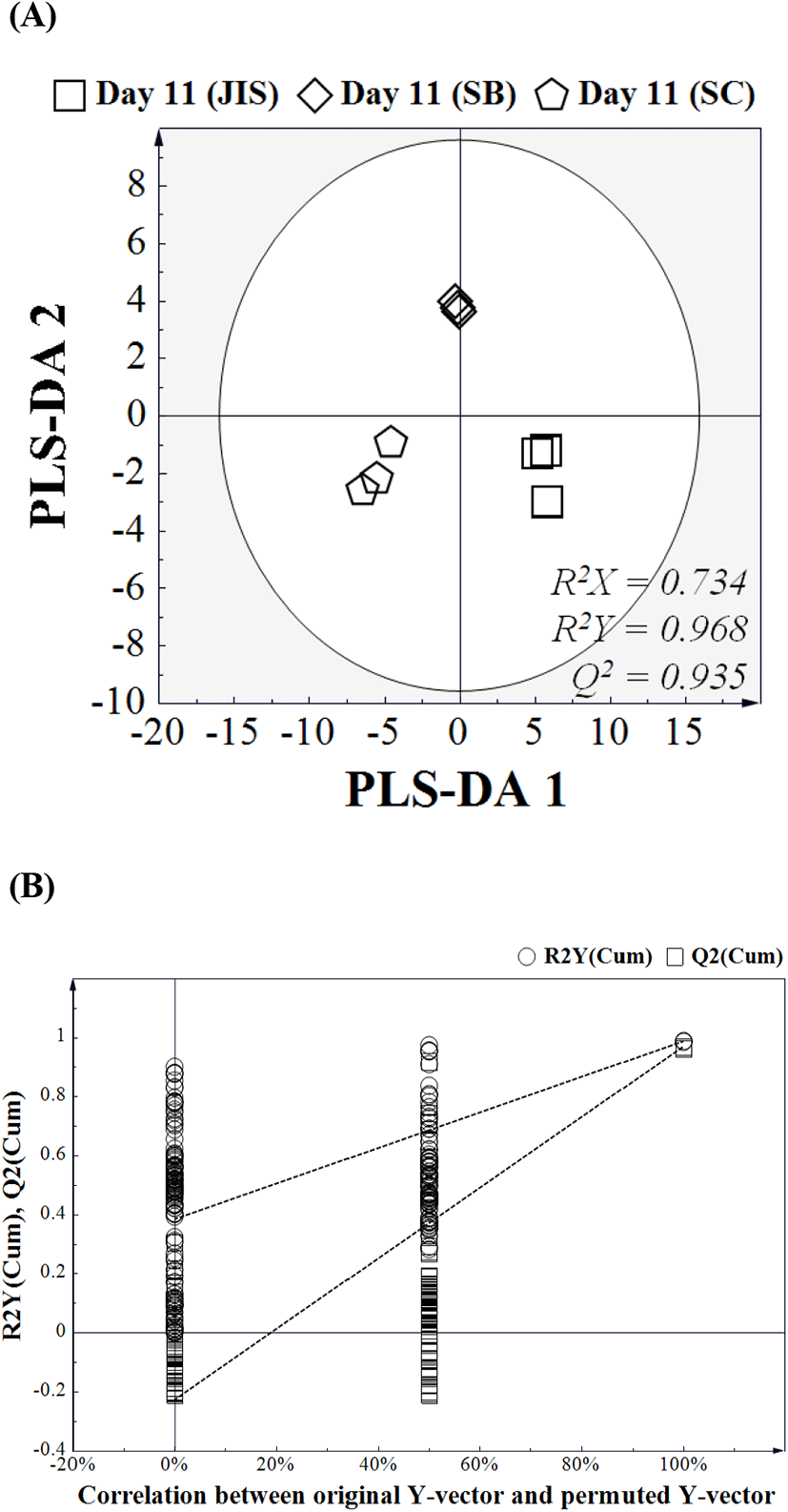
일반적으로 와인의 발효에 활용되는 효모는 와인의 품질을 결정하는 가장 중요한 요인으로 작용한다(Pretorius, 2000). 효모는 그 종류에 따라 포도당 소모 속도, 알코올 생성 능력, 생성된 알코올에 대한 내성 및 생성된 대사산물의 종류 등에 차이가 있기 때문에, 원료에 따라 적합한 효모가 달라질 수 있다. SC 효모와 SB 효모는 와인 제조에서 가장 보편적으로 활용되는 효모로 알코올 발효에 적합한 알코올 생성 능력 및 알코올 내성을 가지고 있다(De Melo Pereira 등, 2010). 본 연구에서 활용한 JIS 효모는 기존 오디 와인 제조를 위한 누룩에서 선택적으로 분리한 효모로, 오디의 환경(산도, 수분, 성상 등)에 잘 적응한 효모이다. 본 연구의 이화학적 분석 결과에서 JIS 효모는 상업용 효모인 SC 및 SB와 유사한 당 소모 속도 및 알코올 생성 능력을 보였는데, 이는 JIS 효모가 상업용 효모와 마찬가지로 오디의 환경 조건에서 정상적인 알코올 발효를 진행할 수 있고, 이를 토대로 향후 오디와인 제조를 위한 효모로 활용이 가능하다는 것을 의미한다(Dashko 등, 2014).
GC/MS 기반의 대사체학은 와인의 발효에 미치는 환경적 요인 및 유전적 요인(품종)에 따른 대사산물 차이를 명확히 구분할 수 있는 연구방법이다(Gougeon 등, 2009). 본 연구에서 각각의 오디 와인들을 분석한 결과, 동일한 원료, 동일한 발효 온도 및 발효 시간을 적용했음에도 10개의 대사산물이 접종 효모에 따라 유의적으로 차이를 보이는 것으로 나타났다. 흥미로운 것은 JIS와 SC는 S. cerevisiae로 서로 같은 종(species)이지만 아미노산(isoleucine, leucine, pyroglutamic acid, glycine, proline, glutamic acid), 유기산(malic acid, succinic acid) 및 기타 대사산물(propylene glycol, galacturonic acid)의 결과에서 서로 유의적인 차이가 있는 것으로 나타났는데, 이는 동일한 S. cerevisiae 효모라고 할지라도 발효 종료 후 생성된 대사산물은 서로 다를 수 있다는 것을 의미한다. 특히 차이가 있는 것으로 확인된 유기산인 malic acid와 succinic acid는 미생물의 대사뿐만 아니라, 발효가 종료된 와인의 품질에도 직접적인 영향을 미치는 유기산으로 알려져 있다(Giudici 등, 1995; Lamikanra, 1997). Alves 등(2015)의 연구는 4종류의 S. cerevisiae(야생효모 및 상업효모)를 동일한 조건하에 포도 와인 발효를 진행한 결과, 접종 효모에 따라 휘발성 대사산물간 차이가 있는 것으로 나타나, 본 연구결과의 주장을 뒷받침한다.
발효식초의 품질은 원료 와인, 접종된 초산균, 발효 조건 및 숙성 조건 등의 요인에 따라 결정된다. 그 중 발효식초의 원료로 활용되는 와인은 발효식초의 품질을 결정하는 결정적 요인으로 작용하는데, 특히 와인 발효에 접종된 효모의 종류에 의해서 영향을 받는다(Ciani, 1998; Tesfaye 등, 2003). 다른 효모 종(S. cereivisae, Candida stellate, Kloeckera apiculate)을 각각 접종하여 와인을 만든 후 이를 원료로 발효식초를 제조한 Ciani(1998)는 효모 종에 따라 acetic acid bacteria의 성장 및 식초의 분석 프로파일이 모두 다르다는 것을 확인하였다. 이러한 기존 연구의 결과는 본 연구에서 효모를 달리하여 제조한 오디와인을 이용하여 식초를 각각 제조했을 때, 식초의 발효 패턴 및 분석 프로파일이 달라질 수 있다는 것을 시사한다. 다만, 원료로 활용된 와인에 존재하는 효모 자체가 acetic acid bacteria의 성장 및 식초의 분석 프로파일에 영향을 미치는 것인지, 혹은 와인 내 발효산물이 영향을 미치는지에 대해서는 추가적인 연구가 필요할 것으로 판단된다.
이러한 접종 효모 차이에 기인하여 차이를 보인 대사산물들은 개별 효모의 우수성 및 와인 품질의 우수성을 보여주는 지표로 활용할 수는 없지만, 발효식초 등 와인을 원료로 새로운 발효를 진행하거나 제품을 생산할 때 원료의 초기 대사산물 정보를 제공함으로써 2차 가공품의 표준화에 기여할 수 있을 것으로 판단된다.











